2022-09-13 京都大学
関山直孝 理学研究科助教、児玉高志 同研究員(現:大阪大学)、杤尾豪人 同教授、高場圭章 理化学研究所特別研究員、眞木さおり 同研究員、米倉功治 グループディレクター(東北大学教授を併任)らの共同研究グループは、筋萎縮性側索硬化症(ALS: Amyotrophic lateral sclerosis)の発症に関わる機構として、T-cell intracellular antigen-1(TIA-1)のプリオン様ドメインに生じるアミノ酸変異が高密度な凝縮構造を形成することがその一因となっていることを解明しました。
細胞質に形成されるストレス顆粒(SGs)の主要な構成因子の一つであるTIA-1は、特定の立体構造を持たない天然変性タンパク質領域であるプリオン様ドメイン(PLD)を持ちます。TIA-1のPLDには、神経変性疾患の一種である筋萎縮性側索硬化症(ALS)に関するアミノ酸変異(ALS変異)が確認されていましたが、これらの変異がどのように病気を引き起こすのかはわかっていませんでした。本研究では、核磁気共鳴法(NMR: Nuclear magnetic resonance)や分子動力学シミュレーション、そして3次元電子線結晶構造解析を用いて、ALS変異が引き起こす微細な構造変化を明らかにしました。この成果は、TIA-1が形成する凝縮構造を標的としたALS治療薬の開発などに貢献することが期待されます。
本研究成果は、2022年9月12日に、科学雑誌「Proceedings of the National Academy of Sciences of the United States of America」に掲載されました。
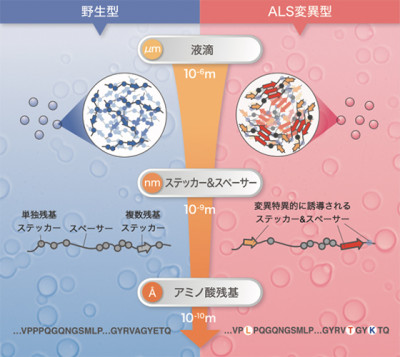
図:TIA-1の液滴形成は階層的なメカニズムで制御されており、ALS変異は周辺領域のステッカー&スペーサー骨格を変化させ高密度な凝縮構造を誘起していました。
研究者のコメント
「本研究は、天然変性タンパク質の可逆的な自己凝縮機構を解き明かすことを目的として始めました。当初は試料調製法や実験手法が確立しておらず手探りの状態でしたが、凝縮体の状態や分子の構造が徐々に明らかになっていく中で、対象に対する自分のイメージも明確になってきました。今後は、このイメージをさらに拡張していき、より普遍的な原理を解き明かして行きたいです。」(関山直孝)
研究者情報
研究者名:関山 直孝
研究者名:杤尾 豪人