2022-09-15 理化学研究所,慶應義塾大学,かずさDNA研究所
理化学研究所(理研)生命医科学研究センター消化管恒常性研究チームの李 優先基礎科学特別研究員(研究当時)、本田賢也チームリーダー(慶應義塾大学医学部微生物学・免疫学教室教授)、新幸二客員主管研究員(慶應義塾大学医学部微生物学・免疫学教室准教授)、かずさDNA研究所ゲノム事業推進部の川島祐介ユニット長らの国際共同研究グループは、タンパク質を分解する消化酵素の一つであるトリプシンを分解するヒト腸内細菌を同定し、このトリプシンの分解が細菌やウイルスなどの病原体の感染防御に寄与していることを突き止めました。
本研究成果は、腸内細菌が口から侵入してきた細菌やウイルスが引き起こす感染症に対する予防・治療への新たな創薬シーズとなり、新しい医薬品の開発につながると期待できます。
今回、国際共同研究グループは、プロテオーム解析[1]・ノトバイオート解析[2]を利用して、腸内細菌と宿主タンパク質の相互作用の網羅的解析を行いました。その結果、腸内細菌の一種であるParaprevotella clara[3]がトリプシンの分解を促進していること、腸内トリプシンの分解が細菌、ウイルスの感染防御につながることを明らかにしました。
本研究は、英国の科学雑誌『Nature』オンライン版(9月7日付:日本時間9月8日)に掲載されました。
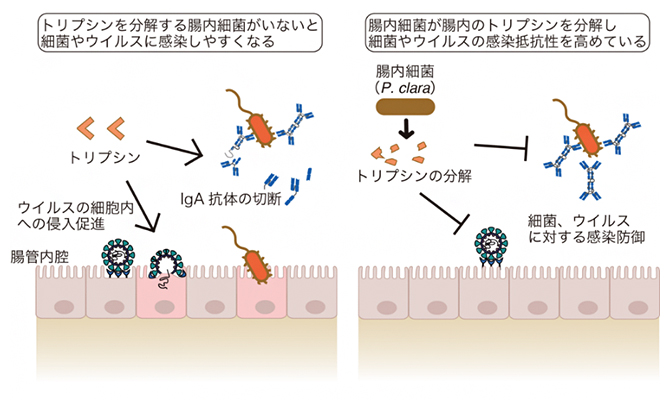
腸内細菌がトリプシンを分解し病原体の感染防御に働くことを示す概要図
背景
ヒトの消化管には500~1,000種類の腸内細菌が生息し、その数は約100兆個に上るといわれています。このような膨大な種類と数の腸内細菌は多種多様な機能を持ち、ヒトの健康と密接に関わっています。しかし、個々の腸内細菌の役割については、培養が難しいこと、種類が多いことなどの理由から、解明されていないことがまだ多く残されています。
消化管内には、食物を分解し栄養を吸収するため、アミラーゼやトリプシン、リパーゼなどの消化酵素が豊富に存在しています。これらの消化酵素は主に口腔・胃・小腸内で糖質やタンパク質、脂質を分解し、小腸粘膜での栄養吸収に重要な役割を担っています。しかし、これらの消化酵素が活性を保ったまま大腸内に存在すると、腸管内で大事な働きをしている糖やタンパク質を分解して悪影響を及ぼす可能性があります。
そこで本研究では、消化酵素の制御における腸内細菌の役割を解明することを目指し、国内外の研究者と共同で研究を行いました。
研究手法と成果
国際共同研究グループは、腸内細菌が腸管内に存在するどのようなタンパク質に影響を与えているかを探索するため、腸内細菌が存在しない無菌マウス[4]と腸内細菌が存在するSPFマウス[5]の盲腸[6]内容物に含まれるタンパク質をプロテオーム解析という手法を用いて、網羅的に解析しました。その結果、腸内細菌の有無でトリプシンというタンパク質分解酵素(プロテアーゼ)の量や活性に著しい差があることが判明しました。トリプシンは無菌マウスの盲腸内には多量に存在していましたが、SPFマウスの盲腸内や便中にはほとんど存在しないことが分かりました(図1上)。
一方で、トリプシンを産生する膵臓におけるトリプシン量は無菌マウスとSPFマウスで違いがありませんでした。また、小腸の空腸[6]と回腸[6]の内容物では無菌マウスとSPFマウスのトリプシン活性に違いがなかったのに対し、盲腸、大腸、便ではSPFマウスでトリプシン活性が有意に減少していることが分かりました(図1下)。このことから盲腸、大腸に存在する腸内細菌がトリプシンの分解に関与していることが想定されました。
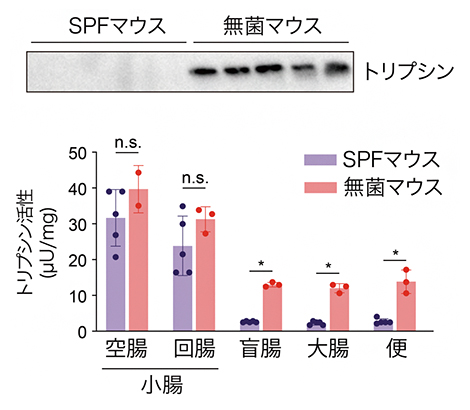
図1 腸内細菌によるトリプシンの分解
(上)SPFマウスと無菌マウスの便中のトリプシン量をウェスタンブロットで検証した。
(下)SPFマウスと無菌マウスの空腸、回腸、盲腸、大腸の内容物と便を採取し、トリプシンの活性を検証した。
ヒト腸内細菌を用いることで、ヒトへ応用しやすいと考え、ヒト腸内細菌からトリプシンの分解に関与する細菌種の特定を試みました。健康なヒト便を定着させたマウスを用いて、トリプシン量の減少を指標に細菌種を絞り込み、その後このマウスの盲腸内に存在していた細菌株を分離し、試験管内でトリプシンを分解できる細菌を探索しました。その結果、「Paraprevotella clara(P. clara)」という細菌がトリプシンの分解に関与していることを見いだしました。
次に、P. claraがどのような仕組みでトリプシンを分解しているかについて検証した結果、P. claraの外膜上のタンパク質がトリプシンと結合し、トリプシン同士の接着を促進することで、トリプシンが自己消化[7]により分解していることが示唆されました。そこで、P. claraの外膜上に存在するタンパク質のうち、トリプシン分解に関与するタンパク質を再度プロテオーム解析により探索した結果、「00502」と名付けた新しいタンパク質がトリプシンとの結合・分解に必須であることを突き止めました。
さらに、P. claraによる大腸内トリプシンの分解が宿主にとってどのようなメリットがあるのかについて、動物モデルを用いて検証しました。P. clara単独では無菌マウスにうまく定着させることができなかったため、P. claraの定着をサポートしてくれる2株(Parabacteroides merdae、Bacteroides uniformis)と共に、野生型のP. clara(2-mix+WT)および00502をコードする遺伝子を欠損させたP. clara(2-mix+Δ00502)を別々の無菌マウスに定着させ、便中トリプシン活性を測定しました。
その結果、2-mix+WT定着マウスでは便中トリプシン活性がほとんど認められなかったのに対し、2-mix+Δ00502定着マウスでは高いトリプシン活性が認められました(図2左)。これらのマウスの盲腸内タンパク質の違いを解析したところ、消化管内での病原体の排除に重要な抗体IgA[8]の量が、トリプシンが多い2-mix+Δ00502定着マウスで少なくなっていることが分かりました(図2中)。実際に、腸管出血性大腸菌のマウス病原菌であるCitrobacter rodentium[9]を両マウスに感染させたところ、トリプシンが少なくIgAが多い2-mix+WT定着マウスで炎症に伴う体重減少が軽減され、盲腸組織内に侵入した細菌数の低下が確認できました(図2右)。
このことから、P. claraが腸内トリプシンを分解することで、腸内にIgAが多い状態を維持することができ、病原体の侵入を防いでいることが想定されました。
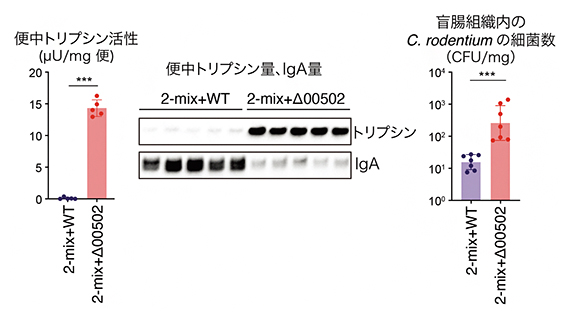
図2 P. claraのトリプシン分解による細菌感染防御
(左・中) 野生型の(2-mix+WT)マウスと00502遺伝子を欠損させた(2-mix+Δ00502)マウスの便中のトリプシン活性(左)、トリプシン量・IgA量(中)を測定した。
(右) 2-mix+WTマウスと2-mix+Δ00502マウスに腸管出血性大腸菌のマウス病原菌のCitrobacter rodentium(C. rodentium)を感染させ、感染14日目の盲腸組織に侵入したC. rodentium細菌数を測定した。
コロナウイルスなどのエンベロープ(ウイルスの外側を覆う脂質二重膜)を持つウイルスは、細胞内へ侵入の際にプロテアーゼによる切断を受ける必要があるため、大腸内のトリプシン量が減少するとコロナウイルスの腸内での感染が抑制される可能性が考えられます。そこで、マウスに感染するコロナウイルスであるマウス肝炎ウイルス[10](Mouse hepatitis virus-2; MHV-2)を用いて、ウイルスへの感染防御能について調べました。
その結果、予想通り、トリプシン量が多い2-mix+Δ00502定着マウスと比較して、トリプシン量が少ない2-mix+WT定着マウスでは、ウイルス感染による死亡率の抑制、体内(肝臓や脳)におけるウイルス量の減少が確認できました(図3)。また、ヒトの新型コロナウイルス感染症においても、P. claraの00502遺伝子が便中に検出された患者では、下痢の症状が軽く、酸素吸入が必要とならない軽症者の割合が高いことが分かりました。
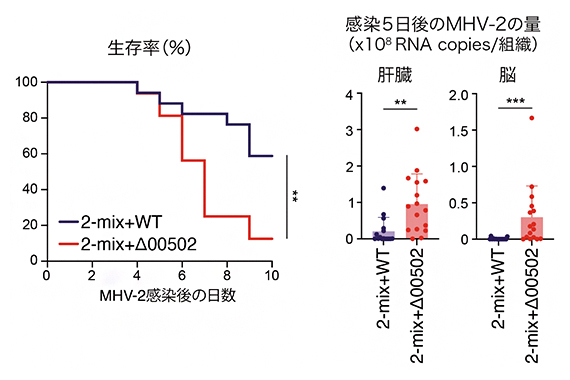
図3 P.claraのトリプシン分解によるウイルス感染防御
2-mix+WTマウスと2-mix+Δ00502マウスにMHV-2を感染させ、生存率(左)と感染5日目の肝臓、脳内でのMHV-2ウイルスのRNA量(右)を測定した。
以上のことから、P. claraは大腸内のトリプシンの分解を促すことで、経口的に侵入してきた細菌やウイルスなどの病原体に対する防御機構を高めていることが明らかになりました。
今後の期待
本研究では、腸管内のトリプシンの活性を腸内細菌が制御していることを見いだしました。さらに、トリプシン分解細菌種の同定を行い、腸管内トリプシンの分解が病原体の感染防御に重要であることを明らかにしました。本成果は、トリプシン分解腸内細菌であるP. claraを用いた細菌やウイルスの腸管感染症に対する予防・治療の応用へとつながると期待できます。
また、P. claraが新型コロナウイルス感染症に伴う下痢症状の軽減や重症化を抑える効果を持っている可能性もあり、新型コロナウイルス感染症の予防や治療への応用が期待できます。
補足説明
1.プロテオーム解析
タンパク質(プロテイン)の発現量を網羅的に解析する技術。タンパク質は鎖状につながったアミノ酸が立体構造をとることででき上がっているため、アミノ酸配列を解読することにより、タンパク質を同定できる。この原理を利用して、試料中のタンパク質を断片化して質量分析計により質量数を測定することで、どんなタンパク質がどれくらいの量、試料中に存在しているのかを知ることができる。
2.ノトバイオート解析
無菌動物に特定の微生物のみを定着させた動物を作製し、その微生物の機能や役割、局在などを解析すること。腸内細菌の作用が試験管内とヒトの腸内では一部異なることが知られており、ヒト腸内に近い環境であるマウス腸内を用いて解析を行うことで、ヒトへの応用に近づくと考えられる。また特定の微生物の宿主への影響を解析する際にも必要不可欠な手法である。
3.Paraprevotella clara
グラム陰性の桿菌でプレボテラ属に類縁のパラプレボテラ属に属する細菌。2009年にヤクルト中央研究所においてヒト糞便から初めて単離された。これまで機能が分かっていなかった細菌である。
4.無菌マウス
無菌状態で飼育できる特殊な飼育装置(アイソレーター)内で滅菌した餌を与えて飼育した、腸内細菌や皮膚などの常在菌を含め、細菌や微生物を全く持たないマウス。常在菌を持たないため、生理学的、免疫学的にいくつかの異常が見られる。
5.SPFマウス
病原体を保有していないマウス。一般的な研究機関のマウス飼育施設は病原体を持ち込まないように制御された環境で維持され、定期的に実験マウスが病原体に感染していないか検査している。腸内細菌や皮膚などには常在菌が生着しており、通常のマウスとして実験に使用される。SPFはSpecific-pathogen-freeの略。
6.盲腸、空腸、回腸
消化管は口側から順に口腔、食道、胃、小腸(十二指腸・空腸・回腸)、大腸(盲腸・結腸・直腸)、肛門に分けられる。胆のうや膵臓と十二指腸が管でつながっており、消化酵素や消化を助ける胆汁が流入する。回腸、空腸へと送られた食べ物は消化酵素の働きで小分子にまで分解され、小腸上皮細胞から吸収される。空腸と回腸に厳密な境目はなく、口側から約40%(2.4m)が空腸、それ以降の60%(3.6m)が回腸とされる。回腸末端には回盲弁と呼ばれる弁があり、回腸と盲腸を隔てている。盲腸以降には腸内細菌が非常に多く生息しており、消化酵素でも分解できない食物繊維などを分解し消化を補助している。盲腸、結腸では主に腸内細菌から産生された代謝物、水分を吸収し、便の形成をしている。
7.自己消化
細胞や組織が自己に保有する酵素により、体の成分を分解すること。今回は、トリプシンが周りのトリプシンを分解することで、トリプシンの活性がなくなることを意味する。
8.IgA
抗体(免疫グロブリン)の一種で、腸管や気道などの粘膜や初乳に多く存在している。細菌やウイルスなどの病原体が体内に侵入するのを防いでいる。また、同時に腸内細菌の多様性の維持にも関与していることが分かっている。
9.Citrobacter rodentium
マウスにおいて感染性の大腸炎を誘導する病原性細菌で、ヒトの腸管病原性および腸管出血性大腸菌の感染モデルとして用いられる。
10.マウス肝炎ウイルス
マウスに感染するコロナウイルスで、新型コロナウイルス(SARS-CoV-2)と同じベータコロナウイルス属のウイルス。マウス肝炎ウイルス(MHV)には多数の株が存在し、肝炎・脳炎などを起こす多臓器親和性の株と、腸炎を主病変とする腸管親和性の株に大別される。今回使用したMHV-2は高病原性の多臓器親和性の株である。
国際共同研究グループ
理化学研究所 生命医科学研究センター
消化管恒常性研究チーム
チームリーダー 本田 賢也(ホンダ・ケンヤ)
(慶應義塾大学 医学部 微生物学・免疫学教室 教授)
客員主管研究員 新 幸二(アタラシ・コウジ)
(慶應義塾大学 医学部 微生物学・免疫学教室 准教授)
基礎科学特別研究員(研究当時) 李 優先(リ・ユウセン)
研究員(研究当時) 渡辺 栄一郎(ワタナベ・エイイチロウ)
大学院生リサーチ・アソシエイト(研究当時) 松永 崇宏(マツナガ・タカヒロ)
マイクロバイオーム研究チーム
副チームリーダー 須田 亙(スダ・ワタル)
客員主管研究員 服部 正平(ハットリ・マサヒラ)
かずさDNA研究所 ゲノム事業推進部
ユニット長 川島 祐介(カワシマ・ユウスケ)
副所長 小原 收(オハラ・オサム)
慶應義塾大学 医学部
微生物学・免疫学教室
大学院医学研究科博士課程 王 主君(ワン・ジュジュン)
助教 古市 宗弘(フルイチ・ムネヒロ)
専任講師 竹下 梢(タケシタ・コズエ)
大学院医学研究科博士課程 吉田 宏司(ヨシダ・コウジ)
専任講師(研究当時) 西山 啓太(ニシヤマ・ケイタ)
訪問研究員(研究当時) ショーン・カーニー(Sean M. Kearney)
特任研究員 笹島 悟史(ササジマ・サトシ)
大学院医学研究科博士課程 張 暁曦(チョウ・ギョウギ)
内科学教室(呼吸器)
准教授(研究当時) 石井 誠(イシイ・マコト)
教授 福永 興壱(フクナガ・コウイチ)
感染症学教室
専任講師 南宮 湖(ナムグン・ホウ)
教授 長谷川 直樹(ハセガワ・ナオキ)
臨床検査医学
専任講師 上蓑 義典(ウワミノ・ヨシフミ)
日本獣医生命科学大学 獣医学部
准教授 氏家 誠(ウジケ・マコト)
マサチューセッツ工科大学・ハーバード大学ブロード研究所(米国)
グループリーダー ダミアン・プリクタ(Damian R. Plichta)
研究員 チ・ヤン・アン(Qi Yan Ang)
共同ディレクター ラムニック・ザビエル(Ramnik J. Xavier)
研究支援
本研究は、日本医療研究開発機構(AMED)次世代治療・診断実現のための創薬基盤技術開発事業(腸内マイクロバイオーム制御による次世代創薬技術の開発)における研究開発課題「有益細菌探索に基づく合理的に設計された新規MB制御医薬品の創出(研究開発代表者:本田賢也)」とウイルス等感染症対策技術開発事業における研究開発課題「腸内細菌モデュレーションによるSARS-CoV2感染制御(研究開発代表者:本田賢也)」、日本学術振興会(JSPS)科学研究費助成事業特別推進研究「常在細菌叢の動作原理理解に基づく微生物製剤の開発(研究代表者:本田賢也)」などによる支援を受けて行われました。
原論文情報
Youxian Li, Eiichiro Watanabe, Yusuke Kawashima, Damian R. Plichta, Zhujun Wang, Makoto Ujike, Qi Yan Ang, Runrun Wu, Munehiro Furuichi, Kozue Takeshita, Koji Yoshida, Keita Nishiyama, Sean M. Kearney, Wataru Suda, Masahira Hattori, Satoshi Sasajima, Takahiro Matsunaga, Xiaoxi Zhang, Kazuto Watanabe, Jun Fujishiro, Jason M. Norman, Bernat Olle, Shutoku Matsuyama, Ho Namkoong, Yoshifumi Uwamino, Makoto Ishii, Koichi Fukunaga, Naoki Hasegawa, Osamu Ohara, Ramnik J. Xavier, Koji Atarashi & Kenya Honda, “Identification of trypsin-degrading commensals in the large intestine”, Nature, 10.1038/s41586-022-05181-3
発表者
理化学研究所
生命医科学センター 消化管恒常性研究チーム
基礎科学特別研究員(研究当時) 李 優先(リ・ユウセン)
客員主管研究員 新 幸二(アタラシ・コウジ)
(慶應義塾大学医学部微生物学・免疫学教室准教授)
チームリーダー 本田 賢也(ホンダ・ケンヤ)
(慶應義塾大学医学部微生物学・免疫学教室教授)
かずさDNA研究所ゲノム事業推進部
ユニット長 川島 祐介(カワシマ・ユウスケ)
報道担当
理化学研究所 広報室 報道担当
慶應義塾大学信濃町キャンパス総務課:山崎・飯塚・奈良
かずさDNA研究所 広報・研究推進グループ

