2022-10-07 国立がん研究センター
発表のポイント
- 日本人を含むアジア人の肺腺がんの半数に見られるEGFR遺伝子変異のある肺がんにおいて、薬剤耐性の原因となる融合遺伝子を包括的に調べました。
- 遺伝子解析で検出される多くの融合遺伝子候補のうち、実際に薬剤耐性の原因となっているのは一部であり、その見分け方と克服するための有効な併用療法を細胞実験により提唱しました。
- 研究を進めることで、融合遺伝子によって薬剤耐性となった肺がんへの治療応用が期待されます。
概要
米国Dana-Farber Cancer Institute(Dr. Pasi A. Jänne)と国立がん研究センター(理事長:中釜 斉、所在地:東京都中央区)研究所(所長:間野博行)分子病理分野(研究員:小林 祥久)を中心とした国際共同研究チームは、日本人を含むアジア人の肺腺がんの半数を占めるEGFR遺伝子変異のある肺がんの薬剤耐性機序としての融合遺伝子を包括的に調べ、実際に薬剤耐性の原因となっているものとそうでないものの見分け方と克服するための有効な併用療法を患者治療データと細胞実験データから提唱しました。研究成果は、英国時間2022年9月24日付(日本時間9月25日)に国際学術誌「Nature Communications」に掲載されました。
進行期・再発のEGFR遺伝子変異のある肺がんには、EGFRチロシンキナーゼ阻害剤が標準治療となっていますが、約1年から2年で薬剤耐性を獲得して効かなくなってしまうことが問題です。耐性機序の一つとして、EGFR遺伝子以外の2つの遺伝子が融合して新たな融合遺伝子を形成する現象が見られます。融合遺伝子を正確に検出する方法は確立しておらず、また、どのように治療すれば良いか明らかになっていません。
本研究は、504人のEGFR遺伝子変異のある肺がん患者さんのDNA検体を次世代シークエンサーで解析し、潜在的な融合遺伝子を包括的に調べました。1実際の患者さんの治療経過、2RNAシークエンス、3ゲノム編集細胞実験のデータを統合することで各融合遺伝子の役割を調べたところ、薬剤耐性としての機能をもつ融合遺伝子は一部でしかないことがわかりました。また、細胞実験から融合遺伝子に有効な併用療法、さらに併用療法に対する将来的な薬剤耐性機序とその克服法を明らかにしました。
今後さらに研究を進めることで、薬剤耐性の原因となっている融合遺伝子をどのように見つければ良いかと、それを克服するための治療への応用が期待されます。
背景
EGFR遺伝子変異のある肺がんの薬剤耐性機序
肺がんは最も死亡者数の多いがん種です。肺腺がんのうち、日本人を含むアジア人の半数、欧米人の約20%でEGFR遺伝子の活性型変異が見られます。進行期及び再発のEGFR遺伝子変異肺がんには、第三世代EGFRチロシンキナーゼ阻害剤 (オシメルチニブ)(注1)が標準治療となっていますが、約1~2年で薬剤耐性を獲得して効かなくなってしまうことが問題です。これまでに薬剤耐性機序として、
- 薬剤結合ポケットの構造変化で薬が結合できない (例: EGFR C797S二次変異)
- EGFR遺伝子以外の他の発がん遺伝子の変異・遺伝子増幅・融合遺伝子からの発がんシグナルが出る
- 腺がんから他の種類の病理組織への転換 (小細胞がん、扁平上皮がん)
などが報告されていますが研究段階で、その克服法として標準治療化されたものはまだ存在しません。
技術的に検出が難しい薬剤耐性機序としての融合遺伝子
DNAはエクソンとイントロンが交互に繰り返される配列をしています。DNAからmRNAに転写されてアミノ酸配列へと翻訳される過程の途中で、イントロンを除去してエクソンだけをつなぎ合わせるスプライシングが起こります。
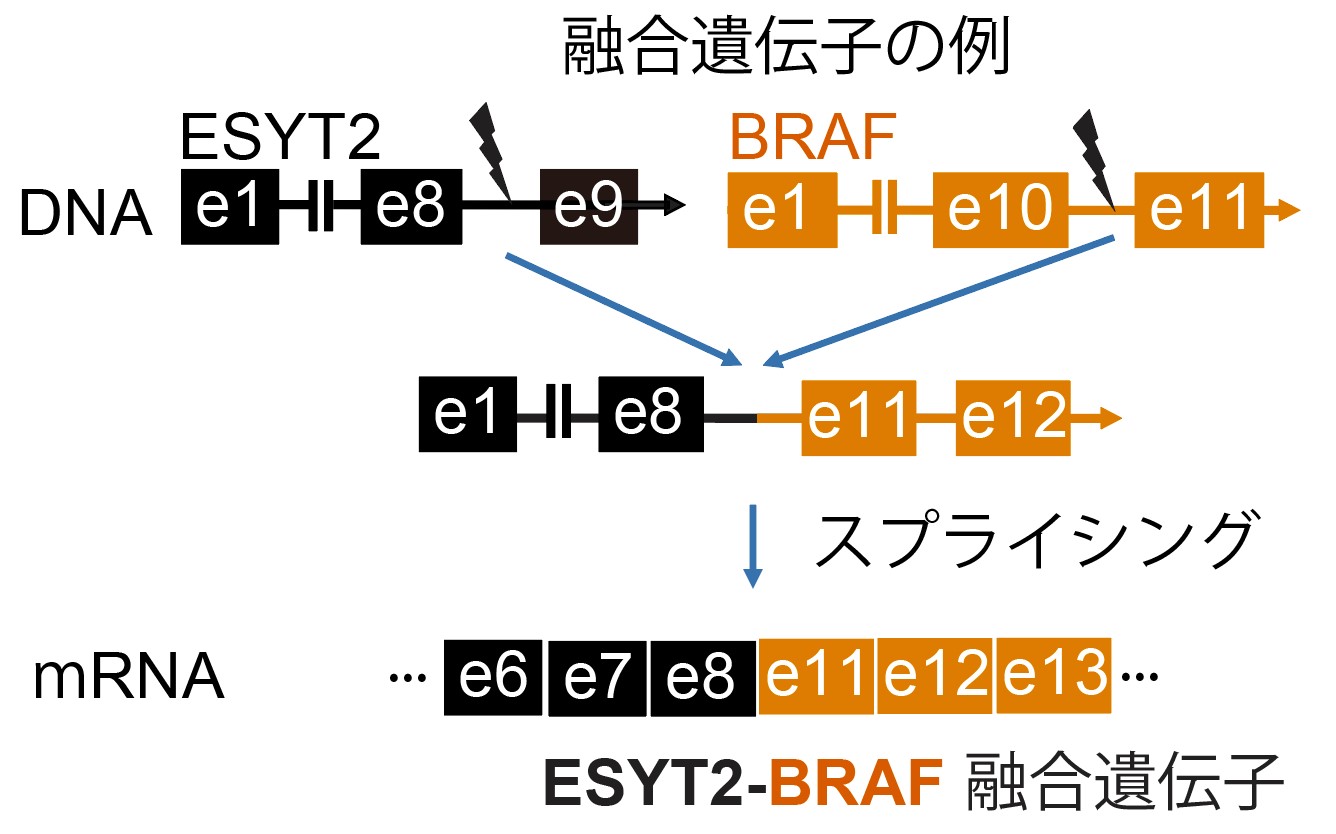
図1 ESYT2-BRAF融合遺伝子の例
エクソン (e)とエクソンの間のイントロンでDNAが切れて、別の遺伝子のイントロンとつながって融合遺伝子ができ、つなぎ目はスプライシングによって除去されます。ESYT2-BRAF融合遺伝子では、BRAF遺伝子の自己制御領域(e1からe10に含まれている)がESYT2遺伝子と置き換わっているためブレーキが効かず、発がんシグナルが生じ続けると考えられています。
融合遺伝子の多くは、そのbreakpoint (切断点)がイントロンに位置しています。DNA配列を解析するための次世代シークエンサーの技術が発達してきていますが、特に以下の2つの理由から融合遺伝子の検出は技術的に困難なことが多いのが現状です。
- 患者さんの治療につながる遺伝子変異を検出するためのパネル (解析対象となる遺伝子領域のセット)には、あらかじめエクソンのホットスポット変異(注2)が標的として設定されており、イントロンは標的に含まれていないことが多い。
- イントロンには繰り返し配列が散見され、次世代シークエンサーで読まれた100から200塩基程度の長さの配列からどの遺伝子のイントロンの一部であるかを同定することが困難なことが多い。
研究成果
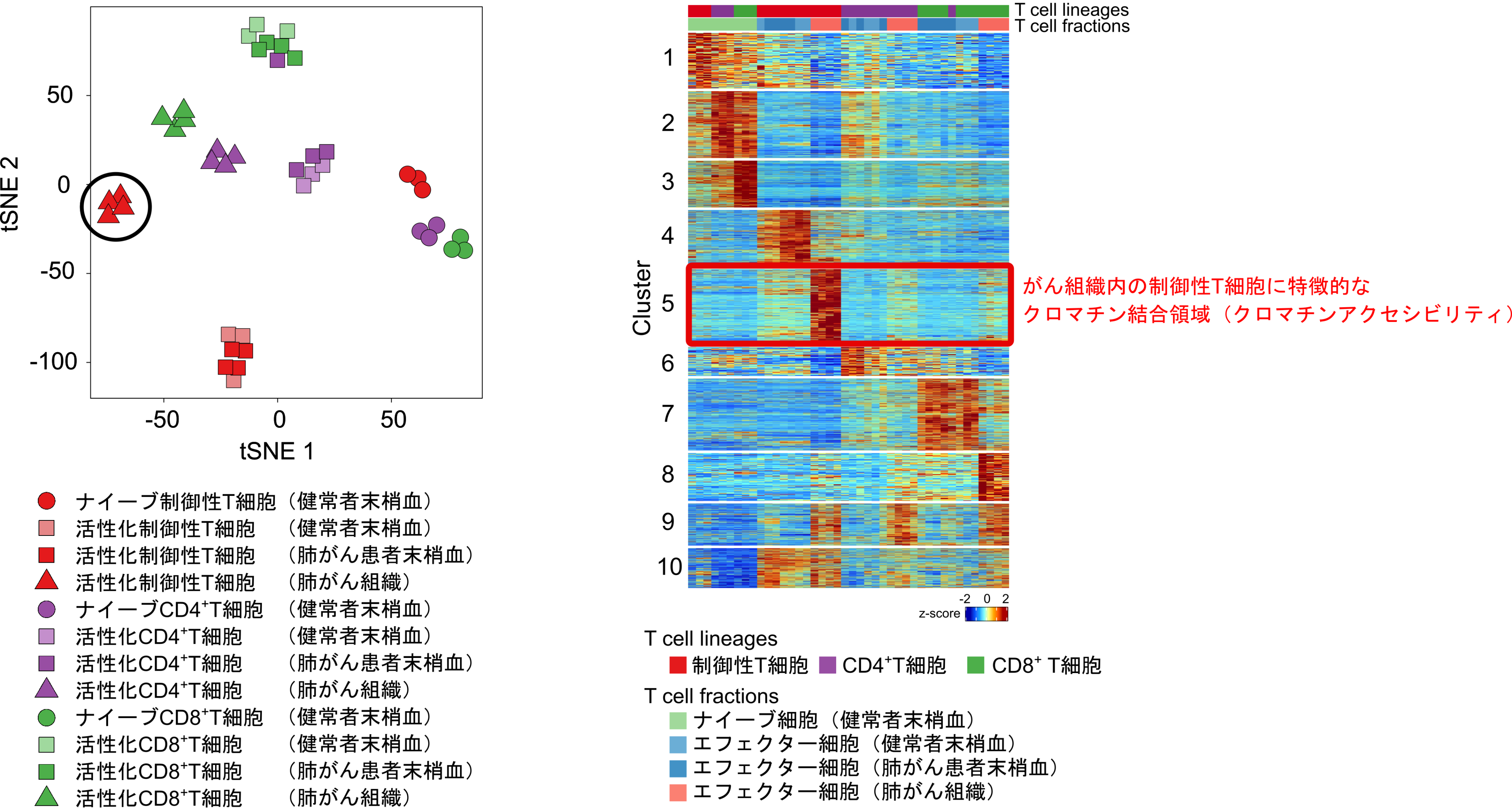
ポイント1. 次世代シークエンサーで検出される融合遺伝子候補のうち、実際に薬剤耐性の原因となっているのはごく一部であることが判明しました。
まず、504人のEGFR遺伝子変異のある肺がん患者さんのDNA検体を次世代シークエンサー (あらかじめ設定されていない標的遺伝子も広く検出できるハイブリッドキャプチャー)で解析したところ、104種類の融合遺伝子候補が検出されました。がんに関連する遺伝子のタイプには、がんを引き起こす発がん遺伝子やがんを抑えるがん抑制遺伝子などがありますが、薬剤耐性を起こしやすく尚且つ薬剤で治療標的になりやすいという観点から、発がん遺伝子を含む融合遺伝子37個についてさらに解析を進めました。
- 実際の患者さんの治療経過
- スプライシングによってイントロンが除去された後のRNAを解析することで新規発がん融合遺伝子TMEM87A-RASGRF1の発見に成功した実績のあるRNAシークエンス
(Cooper# and Kobayashi# et al. Clin Cancer Res 2020 PMID: 32312893)(#は共筆頭著者) - CRISPR-Cas9ゲノム編集細胞モデル (注3)(Kobayashi et al. Nature 2022 PMID: 35236983)
を使った実験データの3つのアプローチを統合することで各融合遺伝子の役割を調べたところ、薬剤耐性としての機能をもつ融合遺伝子は一部でしかないことがわかりました。
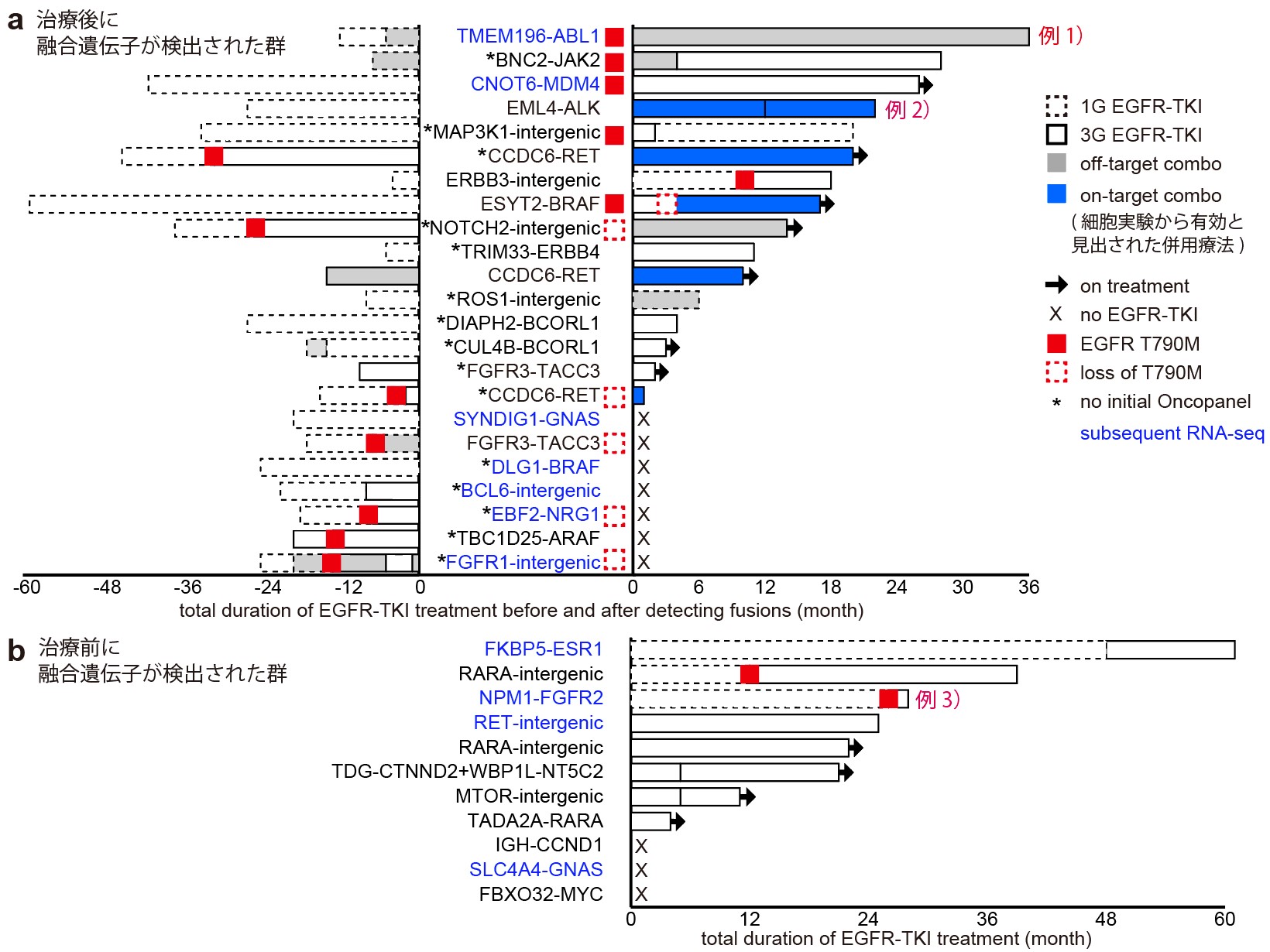
図2 発がん遺伝子を含む融合遺伝子が検出されたEGFR変異肺がん患者の治療経過
融合遺伝子が検出されたタイミングとその前後でEGFR阻害剤によって治療された期間のまとめ。
例1) TMEM196-ABL1: 第一世代EGFR阻害剤 (1G EGFR-TKI)で1年治療後、白血病の原因として有名なABL1遺伝子を含む融合遺伝子が検出されたにもかかわらず、その後第三世代 (3G) EGFR-TKIによる治療が3年続いたことから、この融合遺伝子には薬剤耐性の役割がないと判断できます。
例2) EML4-ALK: 1G EGFR-TKIで2年治療された後、EML4-ALK融合遺伝子が検出され、細胞実験から見出されたEGFR阻害剤とALK阻害剤の併用療法 (on-target combo注4)が2年間有効であったことから、この融合遺伝子は薬剤耐性の原因であったと判断できます。
例3) NPM1-FGFR2: 治療前からEGFR変異と一緒に発がん遺伝子FGFR2を含む融合遺伝子が検出されたがEGFR-TKIが2年効いたことから、この融合遺伝子は薬剤耐性の役割がないと判断できます。
ポイント2. 融合遺伝子の克服に有効な阻害剤とEGFR阻害剤との併用療法、さらに併用療法に対する将来的な薬剤耐性機序とその克服法を明らかにしました。
EGFR遺伝子変異のある肺がん患者さんが薬剤耐性として融合遺伝子を獲得した状況を模して、CRISPRゲノム編集技術を応用することでEGFR遺伝子変異のある肺がん細胞株からESYT2-BRAFなどの融合遺伝子を作成しました。これらのモデルは確かにEGFR阻害剤に耐性となることを確認し、薬剤スクリーニングによってそれぞれの融合遺伝子に効く薬を同定しました。さらに、がんはあらゆる治療に対してさらなる薬剤耐性を獲得してしまうため、融合遺伝子に効く薬剤とEGFR阻害剤の併用療法で長期間細胞モデルを培養することで薬剤耐性株を樹立し、その耐性機序を解析しました。
がんは、
- EGFR遺伝子側の耐性機序 (Fusion Side)
- 融合遺伝子側の耐性機序 (EGFR side)
- 共通のシグナル経路の耐性機序 (Down stream)
- 新規耐性機序 (Other)
など様々な原因で耐性となることがわかりました。さらなる細胞実験により、これらの様々な耐性機序を克服するために有効な薬剤もそれぞれ同定しました。
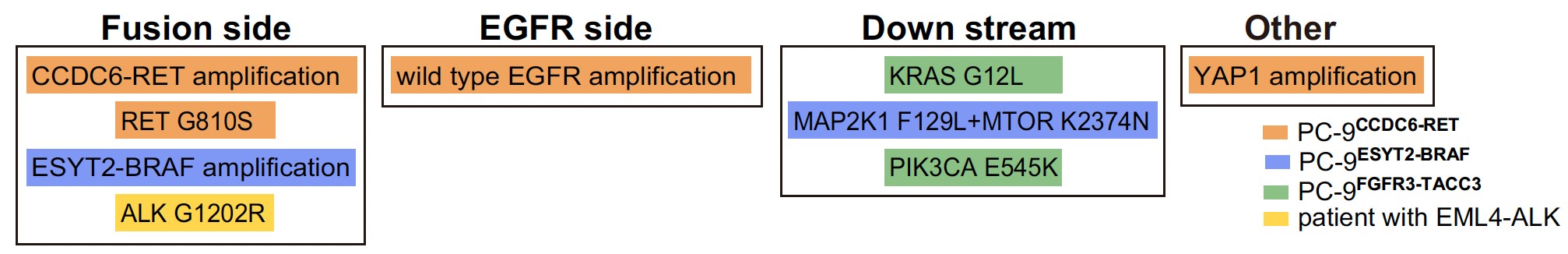
図3 融合遺伝子に効く薬剤とEGFR阻害剤の併用療法に対するさらなる薬剤耐性機序のまとめ
肺がん細胞株PC-9にゲノム編集でそれぞれの融合遺伝子CCDC6-RET (オレンジ色)、ESYT2-BRAF (青色)、FGFR3-TACC3 (緑色)を作成した細胞モデルを、EGFR阻害剤と各融合遺伝子に有効な薬の併用療法によって治療した後に出現した薬剤耐性機序の一覧です。実際の肺がん患者さんで (黄色)、EGFR阻害剤による治療後にEML4-ALK融合遺伝子を獲得して、EGFR阻害剤とALK阻害剤の併用療法後にさらなる耐性機序としてALK G1202R二次耐性変異が生じました。
展望
融合遺伝子という現象は複雑であるため、正しく検査で見つけること自体が困難です。しかし、本研究を含むこれまでの研究から、正しく見つけることができれば、ALK阻害剤やRET阻害剤などすでに保険承認されている薬とEGFR阻害剤の併用療法が実際に患者さんのがんに効くことが研究段階で示されています。本研究では、DNAを使った次世代シークエンス、RNAシークエンス、臨床情報、細胞実験など病院と研究所の総力戦で治療標的となる融合遺伝子の検出に挑みましたが、個々の患者さんに対して行うことは非現実的であるため、将来的には単一の検査で治療標的となる融合遺伝子を正しく検出できる方法の開発が求められます。さらに次のステップとして、その検査の結果に応じて有効な併用療法の効果を評価する臨床試験を行うことで、治療法の保険収載・実臨床での患者さんの治療につながると期待されます。融合遺伝子の克服には、研究・臨床の両方の面からのさらなる研究が必要です。
発表論文
雑誌名
Nature Communications
タイトル
Genomic and biological study of fusion genes as resistance mechanisms to EGFR inhibitors.
著者
Kobayashi Y, Oxnard GR, Cohen EF, Mahadevan NR, Alessi JV, Hung YP, Bertram AA, Heppner DE, Ribeiro MF, Sacardo KP, Saddi R, Macedo MP, Blasco RB, Li J, Kurppa KJ, Nguyen T, Voligny E, Ananda G, Chiarle R, Katz A, Tolstorukov MY, Sholl LM, Jänne PA.
DOI
10.1038/s41467-022-33210-2.
URL
https://www.nature.com/articles/s41467-022-33210-2
掲載日
2022年9月24日 (日本時間9月25日)
研究費
- 日本学術振興会 海外特別研究員 (代表 小林祥久)
- 上原記念生命科学財団 海外リサーチフェローシップ (代表 小林祥久)
- 上原記念生命科学財団 研究奨励金 (代表 小林祥久)
- 科研費若手研究21K15581 (代表 小林祥久)
- AMED革新的がん医療実用化研究事業JP22ck0106699 (代表 小林祥久)
- SGH財団 第33回SGHがん研究助成 (代表 小林祥久)
- 鈴木謙三記念医科学応用研究財団 令和3年度調査研究助成(代表 小林祥久)
用語解説
[注1] EGFRチロシンキナーゼ阻害剤
EGFR遺伝子変異による異常な酵素の活性を抑えることで、がん細胞の増殖に関わるシグナル伝達を止めてがんの増殖を抑える薬剤です。現在標準治療として広く使われている薬剤は第三世代EGFRチロシンキナーゼ阻害薬と呼ばれ、第一世代EGFRチロシンキナーゼ阻害薬の治療後に生じるEGFR T790M二次耐性変異に対しても効果を発揮するように開発された薬剤です。
[注2] ホットスポット変異
遺伝子の変異のうち、高頻度に集中して生じるものを指します。
[注3] CRISPR-Cas9ゲノム編集細胞モデル
CRISPR-Cas9は、元々細菌がウイルスの侵入を排除するための自己防御 (免疫)として備わっている機能です。このシステムを応用することで目的の遺伝子のDNAを切断して、任意の配列を挿入、置換、欠失することができる新しい遺伝子改変術です。この本技術を応用してがん細胞のDNAを直接編集することで実験細胞モデルを構築しました。
同様のゲノム編集細胞モデルを活用した過去のプレスリリースもご参照ください。
2022年3月3日発表プレスリリース
最多の発がん遺伝子を標的とした治療応用に期待RAS遺伝子変異による発がんに関わる新たなメカニズムとその弱点を発見し核酸医薬による新規治療を提唱ーNature誌に論文発表ー
https://www.ncc.go.jp/jp/information/pr_release/2022/0303/index.html
[注4] on-target combo
EGFR阻害剤と別の薬剤の併用療法のうち、細胞実験から融合遺伝子に効果があることを見出した薬剤を用いた組み合わせを指します。
報道関係からのお問い合わせ
研究に関するお問い合わせ
国立研究開発法人国立がん研究センター
研究所 分子病理分野
研究員 小林 祥久
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室