小児に認知症を引き起こし、早期に死亡する稀な神経系疾患に関する研究により、この疾患の治療法の可能性が浮き彫りになりました。 Studies into a rare nervous system disorder that causes dementia and early death in children have highlighted a possible treatment for the condition.
2022-10-10 エディンバラ大学

この研究結果は、視力低下、認知・運動機能障害、発作、早期死亡を引き起こすこの病気の子どもに対する有効な治療法の開発につながる可能性がある。
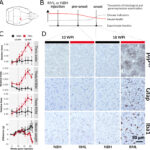
マウスの脳に毎月PPT1酵素を投与したところ、6カ月間の治療で運動機能の改善、脳細胞の病気の兆候の減少、脳質の損失の減少が見られた。
研究チームはまず、マウスで有益な効果を得るために必要な酵素の投与量と投与経路を検証し、その結果を外挿することで、患羊に有効な酵素注入治療法を決定した。
この重要なステップは、マウスで有望な治療法が、より大きな脳で同様の治療効果を発揮するようにスケールアップできることを実証したのである。
この研究は、CLN2と呼ばれる別のバッテン病に対する同様のアプローチに基づいており、セルリポナーゼ・アルファ(ブリヌーラ)と呼ばれる治療法につながった。この治療法は、世界各地のセンターが協力して臨床試験に成功し、NHSから承認された。
<関連情報>
- https://www.ed.ac.uk/news/2022/enzyme-therapy-shows-promise-for-childhood-dementi
- https://www.jci.org/articles/view/163107
マウスおよびヒツジにおけるCLN1病に対する酵素補充療法の異種間有効性 Cross-species efficacy of enzyme replacement therapy for CLN1 disease in mice and sheep
Hemanth R. Nelvagal, Samantha L. Eaton, Sophie H. Wang, Elizabeth M. Eultgen, Keigo Takahashi, Steven Q. Le, Rachel Nesbitt, Joshua T. Dearborn, Nicholas Siano, Ana C. Puhl, Patricia I. Dickson, Gerard Thompson, Fraser Murdoch, Paul M. Brennan, Mark Gray, Stephen N. Greenhalgh, Peter Tennant, Rachael Gregson, Eddie Clutton, James Nixon, Chris Proudfoot, Stefano Guido, Simon G. Lillico, C. Bruce A. Whitelaw, Jui-Yun Lu, Sandra L. Hofmann, Sean Ekins, Mark S. Sands, Thomas M. Wishart, and Jonathan D. Cooper
Journal of Clinical Investigation Published August 30, 2022
DOI: https://doi.org/10.1172/JCI163107
Abstract
CLN1 disease is a fatal neurodegenerative lysosomal storage disorder resulting from mutations in the CLN1 gene encoding the soluble lysosomal enzyme, palmitoyl-protein thioesterase-1 (PPT1). Therapies for CLN1 disease have proven challenging because of the aggressive disease course and the need to treat widespread areas of the brain and spinal cord. Indeed, gene therapy has proven less effective for CLN1 disease than for other similar lysosomal enzyme deficiencies. We therefore tested the efficacy of enzyme replacement therapy (ERT) by delivering monthly infusions of recombinant human PPT1 (rhPPT1) in PPT1-deficient mice (Cln1-/-), and CLN1R151X sheep to assess scale up for translation. In Cln1-/- mice, intracerebroventricular rhPPT1 delivery was the most effective route of administration, resulting in therapeutically relevant CNS levels of PPT1 activity. rhPPT1 treated-mice had improved motor function, reduced disease-associated pathology, and diminished neuronal loss. In CLN1R151X sheep, intracerebroventricular infusions resulted in widespread rhPPT1 distribution and positive treatment effects measured by quantitative structural magnetic resonance imaging and neuropathology. These findings demonstrate the feasibility and therapeutic efficacy of intracerebroventricular rhPPT1 enzyme replacement therapy. This represents a key step towards clinical testing of ERT in children with CLN1 disease and highlights the importance of a cross-species approach to developing a successful treatment strategy.