感染防御・自己免疫疾患・白血病の中心的細胞の活性化メカニズム解析
2020-01-06 京都大学
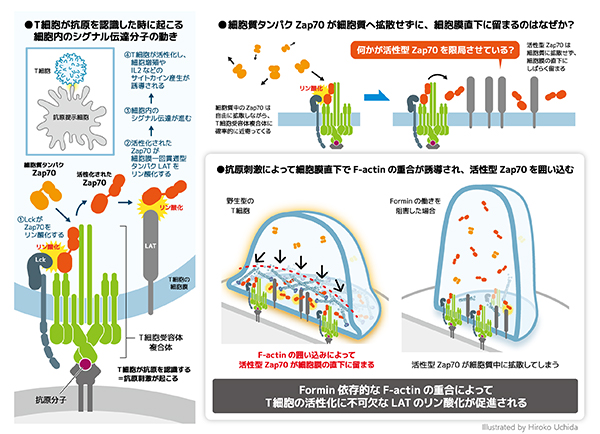
成宮周 名誉教授(医学研究科特任教授)、タムケオ・ディーン 医学研究科特定准教授、桂義親 同博士課程学生らの研究グループは、T細胞受容体刺激によるシグナル伝達において、重要なシグナル分子であるタンパク質Zap70による基質LATへのシグナル伝達に、フォルミン(formin)タンパク質ファミリーによって重合されるアクチンが不可欠であることを発見しました。
高解像度イメージングを用いた解析により、このアクチンはT細胞刺激によってダイナミックに重合・脱重合し、シグナル分子の空間的な配置を制限することで情報伝達を促進することを見出しました。さらにforminファミリーの中でもmDia1とmDia3が特に重要な働きをすることも明らかになりました。
これらの結果は感染症や自己免疫疾患等、T細胞の関連する多くの疾患に対する新たなアプローチでの創薬に繋がる可能性を提示しています。
本研究成果は、2020年1月2日に、国際学術誌「Science Advances」のオンライン版に掲載されました。
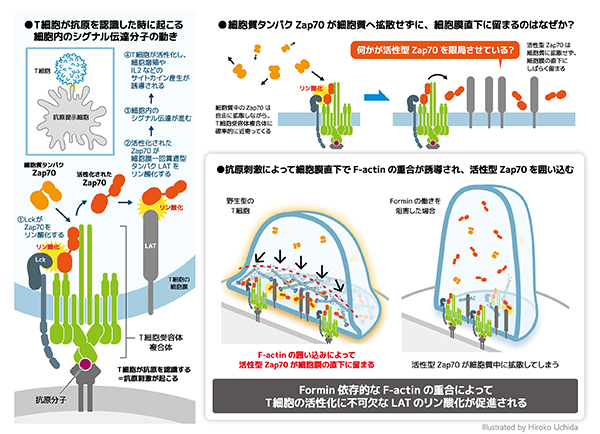
図:本研究の概要図
書誌情報
【DOI】 https://doi.org/10.1126/sciadv.aay2432
【KURENAIアクセスURL】 http://hdl.handle.net/2433/245246
D. Thumkeo, Y. Katsura, Y. Nishimura, P. Kanchanawong, K. Tohyama, T. Ishizaki, S. Kitajima, C. Takahashi, T. Hirata, N. Watanabe, M. F. Krummel and S. Narumiya (2020). mDia1/3-dependent actin polymerization spatiotemporally controls LAT phosphorylation by Zap70 at the immune synapse. Science Advances, 6(1):eaay24
詳しい研究内容について
T 細胞受容体シグナル伝達を細胞骨格アクチンが促進する機能を解明
—感染防御・自己免疫疾患・白血病の中心的細胞の活性化メカニズム解析—
概要
京都大学大学院医学研究科創薬医学講座の成宮周 特任教授、タムケオ・ディーン 同特定准教授、及び桂義親 同博士課程学生らの研究グループは、T 細胞受容体刺激によるシグナル伝達において、重要なシグナル分子であるタンパク質 Zap70 による基質 LAT へのシグナル伝達に、フォルミン(formin)タンパク質ファミリーによって重合されるアクチンが不可欠であることを発見しました。高解像度イメージングを用いた解析により、このアクチンは T 細胞刺激によってダイナミックに重合・ 脱重合し、シグナル分子の空間的な配置を制限することで情報伝達を促進することを見出しました。さらに formin ファミリーの中でも mDia1 と mDia3 が特に重要な働きをすることも明らかになりました。これらの結果は感染症や自己免疫疾患等、T 細胞の関連する多くの疾患に対する新たなアプローチでの創薬に繋がる可能性を提示しています。
本研究成果は、2020 年 1 月 2 日に米国の科学雑誌 Science Advances」のオンライン版に掲載されました。
1.背景
免疫において中心的な役割を持つ T 細胞は、その表面に T 細胞受容体 (TCR) を発現しています。T 細胞が TCR を介して病原体やウイルス等の情報( 抗原)を認識することで、サイトカイン( 細胞から分泌されて生体の様々な生理活動に作用するタンパク質)の産生や細胞増殖といった活性化や分化が引き起こされ、感染細胞の殺傷や抗体の産生など一連の免疫応答の引き金になります。この過程には、TCR の活性化による種々のタンパク質のリン酸化とそれに伴うシグナル複合体形成が非常に重要な働きをしていることが知られています (TCR シグナル伝達) 。その中でも最も重要なタンパク質として Zap70 と、その基質である LAT が存在しています。しかし、Zap70 による LAT のリン酸化がどのように制御されているのかは多くの議論がなされており、未だに明らかになっていません。また、TCR シグナル伝達には細胞骨格であるアクチンが不可欠であるということは分かっていますが、アクチンが具体的にどのような機能によってシグナル伝達に関与しているのは不明でした。そこで我々はアクチンと Zap70 によるシグナル伝達の関係性を明らかにするため、アクチンを核化・重合するタンパク質ファミリーのフォルミン(formin)に着目し、研究を行いました。
2.研究手法・成果
我々ははじめに、マウスから精製した naïve CD8 陽性 T 細胞を用いて、TCR シグナル伝達の過程における formin の関与を検討するため、formin によるアクチン重合活性を阻害する薬剤 SMIFH2 を用いて検討を行いました。その結果、SMIFH2 が存在しない場合は、TCR を刺激しシグナル伝達を誘導することで、刺激後 1.5 分までに Zap70 および LAT のリン酸化が最大になることが確認されました。また、この時のアクチンは無刺激状態に比べて輝度が高くなり、暗い部分と明るい部分の差が大きくなりました。一方、SMIFH2 の存在下で同様の実験を行ったところ、Zap70 のリン酸化に有意な変化はなかったのに対して、LAT のリン酸化が顕著に減弱することを見出しました。さらにこの時のアクチンの輝度は無刺激の細胞のものと有意な差が無く、かつ SMIFH2 非存在下で刺激した細胞よりも顕著に輝度が低いことを発見しました。これらの結果から、T 細胞において formin のアクチン重合が Zap70 による LAT のリン酸化を促進する機能を果たすことが明らかになりました。
次に、より生理的な条件下での検討を行うために、人工的な脂質二重膜に抗原と接着分子を組み込み、T 細胞による抗原認識の際に形成される構造( 免疫シナプス)を模倣しました。免疫シナプスのイメージングの結果、リン酸化された Zap70 および LAT はシナプス面に限定的に存在(局在)し、それらを上側からおさえるようにアクチンが局在していました。ところが SMIFH2 による formin 活性の阻害により、LAT のリン酸化の大幅な減弱とリン酸化 Zap70 の細胞質への拡散が認められました。また、この際アクチンの重合はほとんどなされず無秩序な構造となっていました。この結果から、formin 活性依存的なアクチンが Zap70 の局在を制限することにより、LAT へのリン酸化を促進していることが示唆されました。
最後に、formin ファミリーの中でどのタンパク質が重要であるのかを明らかにするため、T 細胞に発現する formin を解析しました。その結果、formin ファミリーのうち mDia1 と mDia3 が高発現していることを見出しました。そこでその双方を遺伝子欠損させた所、上述の SMIFH2 を用いた実験で確認された現象が再現されました。それに加えて、マウスの胸腺において胸腺細胞の分化に異常をきたしていることも発見しました。胸腺細胞の分化には TCR シグナル伝達が必須であるため、今回発見した機序が成熟した T 細胞の機能のみならず、T 細胞の発生にも関与していることが明らかになりました。
3.波及効果、今後の予定
以上の結果から、T 細胞の抗原に対する刺激応答に formin 依存的なアクチンが不可欠であることが示され、その中でも mDia1/3 が特に重要な働きをしていることが明らかになりました。T 細胞による抗原認識は感染症の防御のみならず、自分の組織を免疫系が破壊してしまう自己免疫疾患においても最初期に関与します。そのため、本研究で得られた知見をもとに自己免疫疾患に対する新たな治療法が開発される可能性があります。また、特定の白血病における T 細胞では mDia を活性化させる RhoA というタンパク質に遺伝子変異があることが報告されています。本来抗原刺激が無ければ増殖できない T 細胞が無秩序に増殖することと、本研究で見出された mDia による TCR シグナル伝達の促進との関連を解析することで、白血病発症のメカニズムの一部を解明できる可能性が期待されます。
4.研究プロジェクトについて
本研究は、京都大学医学研究科(渡邊直樹教授、通山潔研究員)、国⽴シンガポール大学メカノバイオロジー研究所( Pakorn Kanchanawong 准教授、西村有香子研究員)、大分大学薬学研究科( 石崎敏理教授)、金沢大学がん進展研究所(北嶋俊輔助教、高橋智聡教授)、滋賀医科大学(平田多佳子教授)及びカリフォルニア大学サンフランシスコ校(Matthew F. Krummel 教授)による共同研究で、下記の機関により資金的支援を受けて、実施されました。
・ 日本学術振興会日本学術振興会 (JSPS) 基盤研究 S mDia が紡ぐアクチン細胞骨格の個体生理での役割と分子メカニズムの解析」(研究代表者:成宮周)
・ 日本学術振興会日本学術振興会 (JSPS) 若手研究 B T 細胞活性化における mDia の機能とその分子作用機序の解明」(研究代表者:タムケオ ディーン)
・ 日本学術振興会日本学術振興会 (JSPS) 若手研究 B T 細胞受容体シグナルにおける mDia の活性制御機構の解明」(研究代表者:タムケオ ディーン)
・ 小野医学研究財団研究奨励助成金(研究代表者:タムケオ ディーン)
<用語解説>
Zap70 :T 細胞の細胞質に存在するタンパクキナーゼ( リン酸化酵素)。TCR の抗原認識に伴いリン酸化され、LAT など下流のシグナル伝達に関与する様々なタンパク質をリン酸化する。
LAT :T 細胞の細胞膜貫通タンパク質で、Zap70 によるリン酸化を受ける。リン酸化された LAT は下流シグナルタンパクによる複合体形成の足場となる。
<研究者のコメント>
T 細胞という細胞は人間の身体の中でも多種多様な現象に関与しています。しかし、それは T 細胞が関与する疾患が多岐にわたるということと同義です。本研究はいわゆる基礎研究であり、あくまで T 細胞の活性化メカニズムの一端を解明したものです。ですが、このような小さな積み重ねにより T 細胞活性化の全容が明らかになれば、様々な疾患に対する治療法の開発につながる可能性があり、期待したい。
<論文タイトルと著者>
タイトル:mDia1/3-dependent actin polymerization spatiotemporally controls LAT phosphorylation by Zap70 at the immune synapse(mDia1/3 依存的なアクチン重合は免疫シナプスにおいて Zap70 による LAT のリン酸化を時空間的に制御する)
著 者:D. Thumkeo, Y. Katsura, Y. Nishimura, P. Kanchanawong, K. Tohyama, T. Ishizaki, S. Kitajima, C. Takahashi, T. Hirata, N. Watanabe, M. F. Krummel, S. Narumiya
掲 載 誌:Science Advances (2020)
DOI:未定
<参考図>
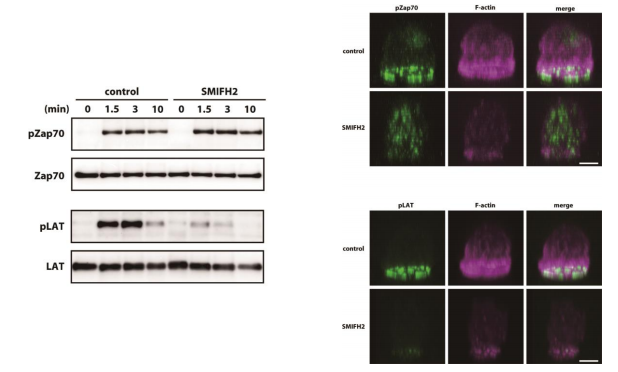
図左:formin 阻害時の Zap70 および LAT のリン酸化図右:免疫シナプスでのリン酸化 Zap70 および LAT の局在