2022-10-12 京都大学iPS細胞研究所
ポイント
- ヒトiPS細胞由来の間葉細胞注1)(iMES)で肺胞オルガノイドを作成した。
- iMESは、ヒト胎児由来の肺線維芽細胞の代わりとして機能し、I型とII型肺胞上皮細胞の両方を含む肺胞オルガノイドを分化誘導できる。
- iMESを用いた肺胞オルガノイドは、肺胞の形成過程や肺疾患の研究に応用できる。
1. 要旨
玉井浩二 (京都大学大学院医学研究科呼吸器内科学 特定研究員)および後藤慎平 (京都大学iPS細胞研究所 教授、前 医学研究科 呼吸器疾患創薬講座 特定准教授)らの研究グループは国立感染症研究所(酒井宏治 主任研究官)、北里大学 (前花祥太郎 講師)、東京農工大学 (竹原一明 教授)、京都大学大学院医学研究科呼吸器内科学(平井豊博教授)、京都大学大学院医学研究科 形態形成機構学(萩原正敏教授)との共同研究として、肺胞オルガノイド(Alveolar organoids、 AOs)を誘導できるiPS細胞由来間葉細胞(iMES)の作製に成功しました。 呼吸によって酸素を取り込み、二酸化炭素を排出しますが、このガス交換を行うのは、肺の中にある肺胞という場所になります。肺胞には実際のガス交換に携わる1型肺胞上皮(AT1)細胞や、肺胞腔が潰れて虚脱することを防止するためのサーファクタント注2)を産生する2型肺胞上皮(AT2)細胞などがあります。生体内に近い形で肺胞の発生を再現するためには上皮細胞と間葉細胞の相互作用が欠かせません。私たちの開発してきた従来の肺胞オルガノイド注3)においても、ヒト胎児肺線維芽細胞(Human fetal lung fibroblasts、 HFLF)との共培養によりAT1細胞とAT2細胞を含む肺胞オルガノイドを作成し(HFLF-AOs)、疾患モデル注4)などに利用されてきました。本研究では、HFLFに代わる、肺上皮細胞注5)の分化に寄与できる間葉細胞を作成することを目的としました。新しく開発したiMESは、 AT1細胞、AT2細胞、肺神経内分泌細胞、線毛細胞を分化誘導可能であり、複数の細胞種を内含する肺胞オルガノイド(iMES-AOs)の作成に成功しました。iMES-AOsの解析により、RSPO2/RSPO3注6)がAT2細胞の分化に関わっていることを見出しました。また、iMES-AOsはインフルエンザウイルスやSARS-CoV-2感染症モデルとしても利用可能であることを示しました。今後、iMES-AOsを用いた肺発生や再生医療の研究、及び、呼吸器疾患モデルとしての応用が期待されます。
この研究成果は2022年9月19日付で「Cell Reports Methods」誌に掲載されました。
2. 研究の背景
オルガノイドは幹細胞が増殖しながら分化することによってできた複数種類の細胞から成り立ち、生体内の細胞機能や細胞間相互作用を模倣しやすいため、生物学研究の強力なツールとして注目されています。これまで私たちは肺胞オルガノイドの安定的な作成のために、HFLFとの共培養を行ってきましたが、異なるゲノム背景の細胞が混在することになり、個人の生体環境を正確に反映できていないのではないかという懸念がありました。そこで、肺胞オルガノイドを分化誘導できる間葉細胞を作製し、肺胞の微小環境注7)や疾患モデルへ応用することを目的としました。
3. 研究結果
1) 肺胞オルガノイドを分化誘導可能なiMESの開発
まず、iPS細胞を中胚葉への分化を促進する培地(Activin A、BMP4、CHIR99021を含む)で培養し、 中胚葉(PDGFRA+/KDR+)へ分化誘導しました。その後、間葉系統の細胞への分化を促進する培地(Activin A、KGF、BMP4、FGF2、FGF10を含む)で培養しました。磁気で標識したビーズを用いて上皮細胞で陽性となるEpCAMが陰性の間葉細胞だけを単離したものを「iPS細胞由来間葉細胞=iMES」と名付けました。また、iPS細胞由来肺前駆細胞とiMESの3次元共培養によって、iMES-AOsを作成することに成功しました (図1)。
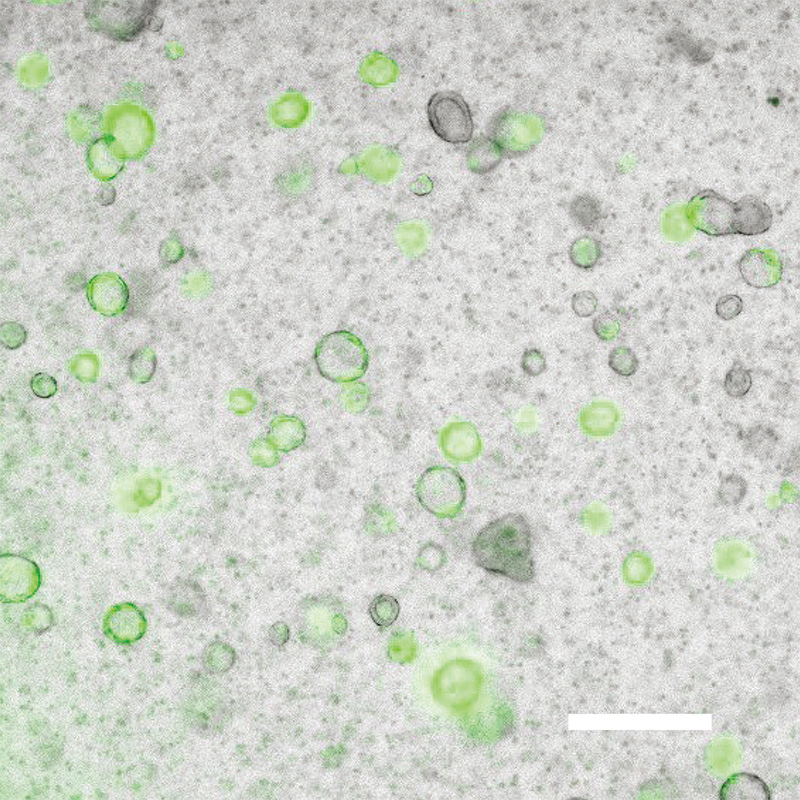
図1 iPS細胞由来の肺前駆細胞とiMESの3次元共培養で作成したiMES-AOsの顕微鏡画像。
緑色はAT2細胞を示す。Scale bar = 500 μm。
2) iMESの遺伝子発現解析とRSPO2/RSPO3の2型肺胞上皮細胞の分化誘導能の確認
iMESは間葉細胞の中でも、線維芽細胞としてのマーカー遺伝子の発現が高く、その他の筋、脂肪、血管内皮、免疫細胞などの遺伝子マーカーは低値でした。また、Gene set enrichment 解析では、皮膚線維芽細胞と比較してiMESでは、肺発生にかかわる遺伝子群が高く発現していることが判明しました。また、3次元培養後のiMESでは、RSPO2/RSPO3が高発現でした。間葉細胞を用いない肺胞オルガノイドの分化誘導系では、従来、古典的Wnt伝達経路を活性化する低分子化合物であるCHIR99021を培地に添加していましたが、それにかえてRSPO2/RSPO3の添加でもAT2細胞を分化誘導することが可能でした (図2)。 これにより、iMES-AOsにおいては、RSPO2/RSPO3がAT2細胞の分化誘導を担うことが示唆されました。
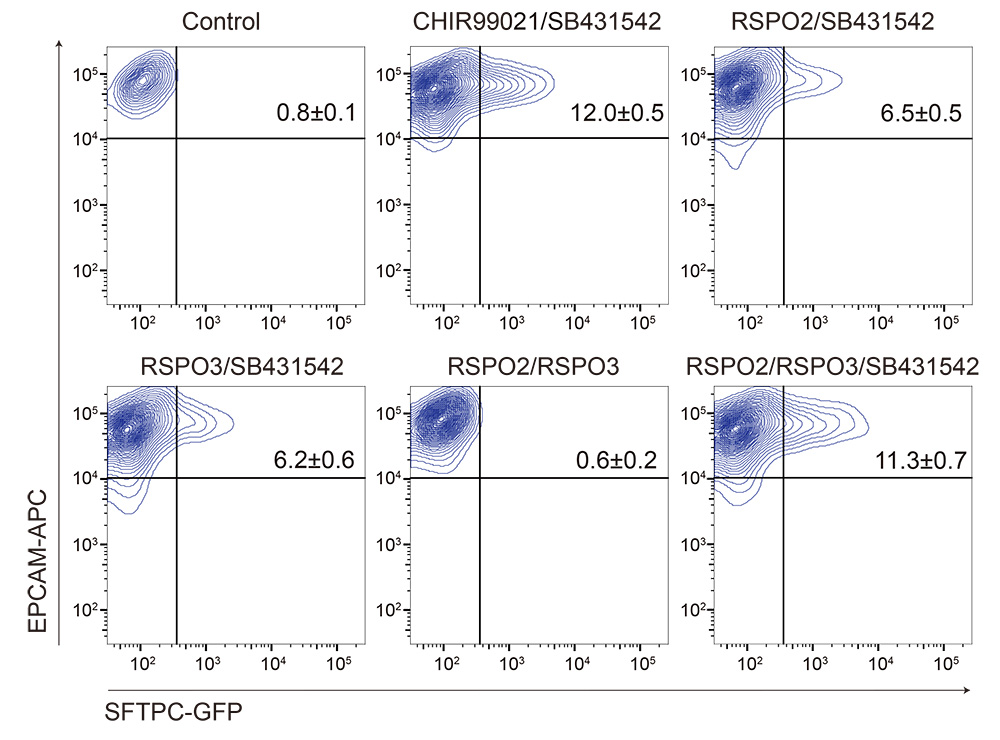
図2 間葉細胞を用いない肺胞オルガノイドにおけるRSPO2/RSPO3の
AT2細胞の分化誘導能の確認。
3) iMES-AOsのシングルセルRNA-seq解析
シングルセルRNA-seq解析を行い、1個ずつの細胞レベルでiMES-AOsとHFLF-AOsを比較しました。両者とも、AT1細胞、AT2細胞、肺神経内分泌細胞が分化誘導されており、加えて、2回継代培養したiMES-AOs (P2)においてのみ、線毛細胞が分化誘導されていることが特徴的でした (図3)。また、AT1、AT2、肺神経内分泌細胞のマーカー遺伝子はHFLF-AOs (P2)よりiMES-AOs (P2)の方で発現が高い傾向がありました。
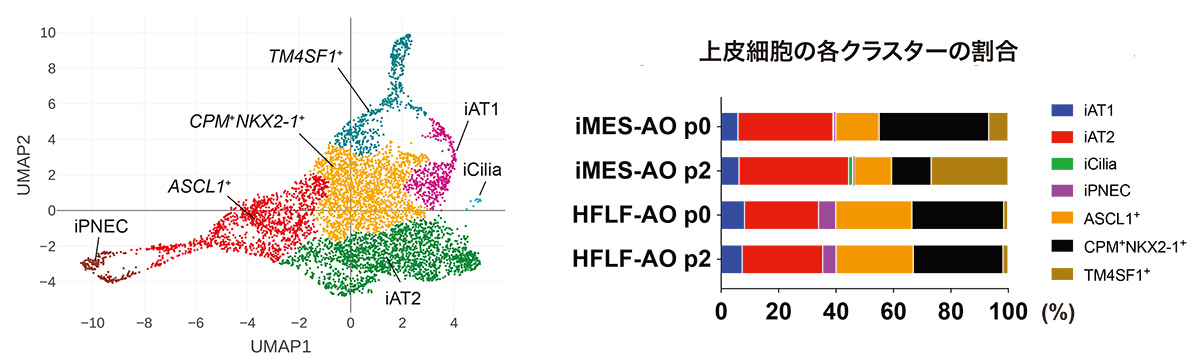
図3 シングルセルRNA-seq解析による肺上皮細胞種の定量化。
4) iMES-AOsによる急性呼吸器ウイルス感染症モデルの確立
最後に、iMES-AOsを用いてインフルエンザウイルスとSARS-CoV-2の感染症モデルを確立しました。インフルエンザウイルスと SARS-CoV-2はそれぞれiMES-AOsで増殖し(NP 赤色)、かつ、インターフェロン応答遺伝子であるMX1(白色)が肺胞上皮細胞(SFTPC-GFP陽性 緑色)で発現していることが、蛍光免疫組織染色で確認できました (図4)。
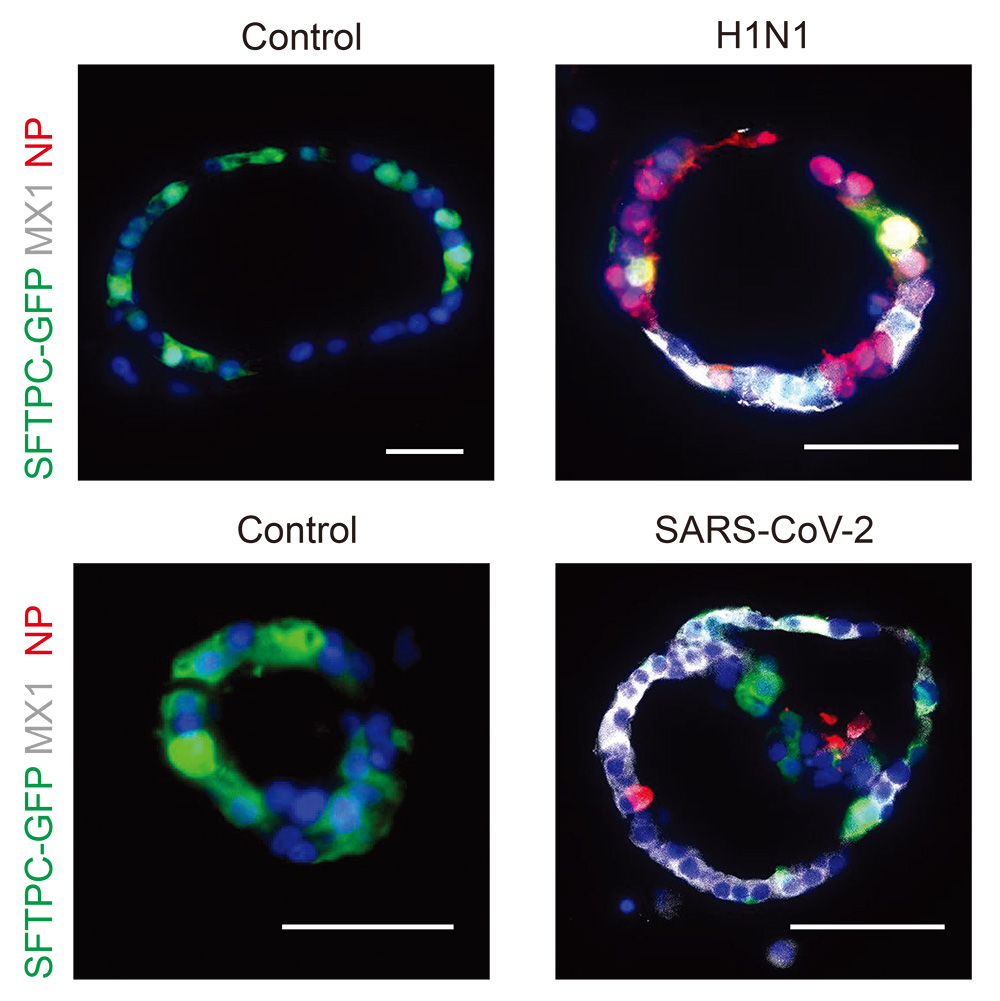
図4 インフルエンザウイルス(H1N1)とSARS-CoV-2の感染症モデル。
4. まとめ
今回の成果として肺胞オルガノイドを誘導できるiMESを開発しました。iMES-AOsは複数の肺上皮細胞種を含み、肺の発生や呼吸器ウイルス感染症などの疾患をモデル化するためのプラットフォームとして利用可能です。今後も、呼吸器疾患モデルや肺の再生研究に役立つ可能性が期待されます。
5. 論文名と著者
- 論文名
iPS cell-derived mesenchymal cells that support alveolar organoid development - ジャーナル名
Cell Reports Methods - 著者
Koji Tamai1*, Kouji Sakai2,3, Haruka Yamaki1, Keita Moriguchi4, Koichi Igura1, Shotaro Maehana5,6,7, Takahiro Suezawa4, Kazuaki Takehara8,9, Masatoshi Hagiwara10, Toyohiro Hirai1, Shimpei Gotoh1,4,11**
*筆頭著者
**責任著者 - 著者の所属機関
- 京都大学大学院医学研究科 呼吸器内科学分野
- 国立感染症研究所獣医科学部
- 国立感染症研究所・ウイルス学第三部
- 京都大学大学院医学研究科呼吸器疾患創薬分野
- 北里大学大学院医療系研究科環境微生物学
- 北里大学医療衛生学部微生物学研究室
- 北里大学医療衛生学部再生医療・細胞デザイン研究施設
- 東京農工大学農学部共同獣医学科獣医衛生学研究室
- 東京農工大学大学院農学研究院動物生命科学部門
- 京都大学大学院医学研究科生体構造医学講座 形態形成機構学研究室
- 京都大学iPS細胞研究所(CiRA)
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 国立研究開発法人 日本医療研究開発機構(AMED)
- 日本学術振興会 特別研究員奨励費 (DC2)、 科学研究費助成事業
- 京都大学iPS細胞研究所 山中伸弥研究室への新型コロナウイルス特別研究助成
- 藤原記念財団
- 国立研究開発法人 科学技術振興機構 CREST
7. 用語説明
注1) 間葉細胞
線維芽細胞、血管内皮細胞、筋細胞、免疫細胞などの非上皮細胞。
注2)サーファクタント
肺胞の空気に接する側に分泌されている界面活性成分。肺胞は内側に縮んで空気を押し出す方向に力がかかっている。サーファクタントはその力を和らげ、空気を肺胞内に取り込みやすくしている。
注3) オルガノイド
生体臓器を試験管内で模倣した、多細胞種からなる3次元構造体。
注4) 疾患モデル
疾患やその病態を試験管内で再現したもの。
注5) 肺上皮細胞
肺を構成する上皮細胞。酸素と二酸化炭素のガス交換を担うAT1細胞、サーファクタントの産生によって肺胞の虚脱を防いだり、幹細胞として再生や恒常性維持も担うAT2細胞に加えて、肺神経内分泌細胞、線毛細胞、クラブ細胞、基底細胞、杯細胞などがある。
注6) RSPO2/RSPO3
R-spondin2とR-spodin3の略称.古典的Wnt伝達経路を活性化するサイトカイン.
注7) 微小環境
細胞がその性質を維持するために必要な環境のことで、周囲の細胞やその細胞の提供するシグナル、細胞外基質、また、酸素や栄養などの要因を含む。