2022-11-04 東京大学先端科学技術研究センター
1.発表者
- 加藤 一希(東京大学先端科学技術研究センター 特任講師)
- 岡崎 早恵(東京大学先端科学技術研究センター 学術専門職員)
- 西増 弘志(東京大学先端科学技術研究センター 教授)
2.発表のポイント
- Cas7-11-Csx29複合体は標的RNAに結合すると活性化しCsx30タンパク質を切断するRNA依存性タンパク質分解酵素であることを発見した。
- クライオ電子顕微鏡解析により、標的RNAの結合によってCsx29タンパク質が構造を変化させ活性化する分子機構を明らかにした。
- Cas7-11-Csx29複合体はRNA検出技術などの新規テクノロジーへの応用が期待される。
3.発表概要
CRISPR-Cas獲得免疫機構(注1)に関与するCas7-11タンパク質はガイドRNAと複合体を形成し、標的となる1本鎖RNAを切断するRNA依存性RNA切断酵素(ヌクレアーゼ)としてはたらきます。Cas7-11はCsx29タンパク質と複合体を形成することが報告されていましたが、Csx29の機能は不明でした。東京大学先端科学技術研究センターの加藤一希特任講師、岡崎早恵学術専門職員、西増弘志教授らは、Massachusetts Institute of TechnologyのJonathan S. Gootenbergフェロー、Omar O. Abudayyehフェローとの共同研究として、Cas7-11-ガイドRNA-Csx29複合体は標的RNAが結合すると活性化し、Csx30タンパク質を切断するRNA依存性タンパク質分解酵素(プロテアーゼ)であることを発見しました。さらに、クライオ電子顕微鏡(注2)を用いて、Cas7-11-ガイドRNA-Csx29複合体およびCas7-11-ガイドRNA-Csx29-標的RNA複合体の立体構造を決定し、標的RNAが結合するとCsx29の構造が変化し活性化することを明らかにしました。また、Cas7-11、Csx29、Csx30を応用することにより、特定のRNAを生細胞内で検出することにも成功しました。本研究により、Cas7-11-ガイドRNA-Csx29複合体は、(1)ガイドRNAと相補的な標的RNAを切断するヌクレアーゼ活性、および、(2)標的RNAと結合すると活性化しCsx30タンパク質を切断するプロテアーゼ活性、という2つの酵素活性をもつRNA依存性ヌクレアーゼ-プロテアーゼであることが明らかとなりました。このような酵素は前例がないため、Cas7-11-Csx29複合体は様々な新規テクノロジーへの応用が期待されます。
本研究成果は、2022年11月3日(米国東部夏時間)に米国科学誌「Science」のオンライン版に掲載されました。
4.発表内容
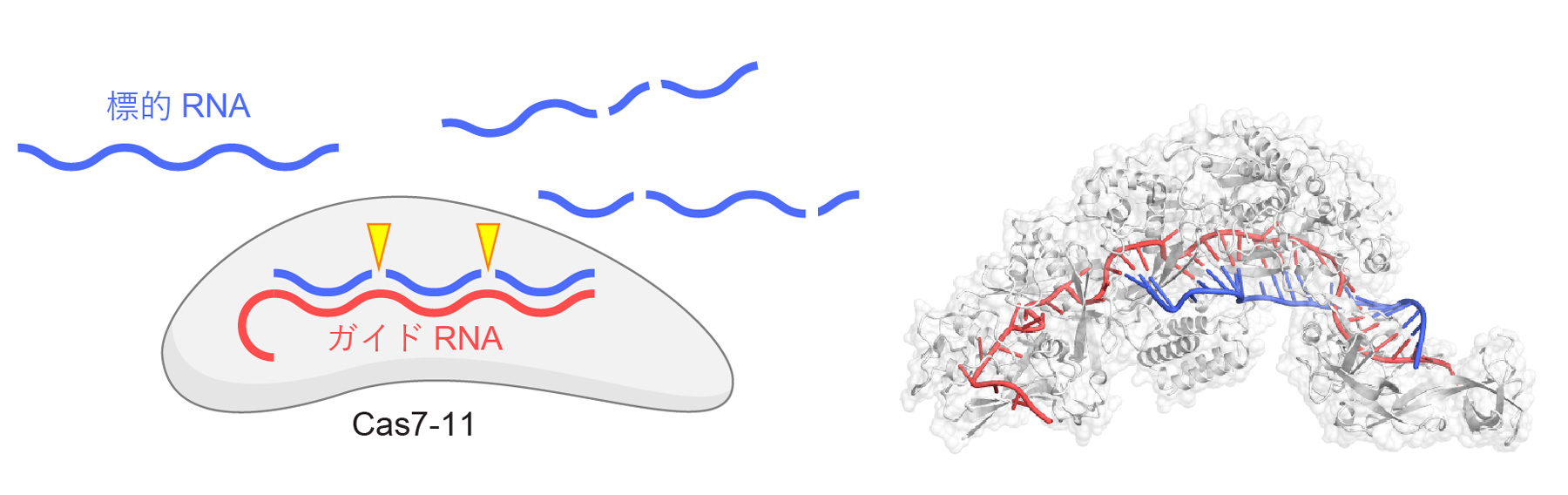
原核生物のもつII型CRISPR-Cas獲得免疫機構に関与するCas9タンパク質はガイドRNAと複合体を形成し、ガイドRNAと相補的な2本鎖DNAを切断するはたらきをもつため、ゲノム編集をはじめとする様々な新規技術に応用されています。Cas9の発見の後もCas12やCas13といった新規のCRISPR-Cas酵素が相次いで発見され、核酸検出などの新規テクノロジーに応用されています。2021年に発見されたIII-E型CRISPR-Cas酵素であるCas7-11は、ガイドRNAと複合体を形成し、ガイドRNAと相補的な1本鎖RNAを2か所で切断するRNA依存性RNA切断酵素(ヌクレアーゼ)としてはたらきます(図1)。2022年5月、本研究チームはCas7-11-ガイドRNA-標的RNA複合体の立体構造を決定し、Cas7-11が標的RNAを切断する分子機構を世界にさきがけて報告しました(図1)(Kato et al. Cell 2022;プレスリリース https://www.rcast.u-tokyo.ac.jp/ja/news/release/20220528.html)。
原核生物のゲノムに存在するIII-E型CRISPR-Cas領域には、Cas7-11に加えて、Csx29、Csx30、Csx31、RpoEといったタンパク質がコードされていることから、これら5種類のタンパク質が協働して抗ウイルス防御を担っている可能性が示唆されていました(図2)。Csx29は既知のタンパク質分解酵素(プロテアーゼ)とアミノ酸配列の類似性をもち、Cas7-11と複合体を形成することが報告されていましたが、実際にCsx29がプロテアーゼ活性をもつかは不明でした。Csx30とCsx31は既知のタンパク質と配列類似性をもたないため、それらの機能は謎に包まれていました。RpoEはシグマ因子として転写制御に関与する可能性が示唆されていましたが、その役割は不明でした。
今回、本研究チームは生化学的解析を行い、(1)Cas7-11はガイドRNAおよびCsx29と複合体を形成すること、および、(2)ガイドRNAと相補的な標的RNAが複合体に結合するとCsx29が活性化しCsx30を2つの断片(N末端断片Csx30-1およびC末端断片Csx30-2)に切断することを発見しました(図3)。これらの結果から、Cas7-11-Csx29複合体は標的RNAの結合によって活性化するRNA依存性プロテアーゼであることが明らかとなりました。さらに、クライオ電子顕微鏡を用いて、Cas7-11-ガイドRNA-Csx29複合体およびCas7-11-ガイドRNA-Csx29-標的RNA複合体の立体構造を決定し、Csx29はTPRドメインとCHATプロテアーゼドメインからなり、Cas7-11と結合していることを明らかにしました(図4)。注目すべきことに、標的RNAが結合していない場合、CHATプロテアーゼドメインの触媒残基はCas7-11によって塞がれているため、Csx29はCsx30を切断できない一方、標的RNAが結合するとCsx29の立体構造が変化しCsx30が結合できる活性化状態になることが示唆されました。したがって、2つの構造の比較から、Cas7-11-Csx29複合体がRNA依存的プロテアーゼとして機能する分子機構が明らかになりました。
次に、本研究チームは、Csx30、Csx30-1、Csx30-2、および、Csx30とCsx31をそれぞれ大腸菌に導入し生育を追跡することにより、Csx30とCsx31の機能を調べました。Csx30やCsx30-1を導入すると大腸菌の増殖が阻害された一方、Csx30-2やCsx31は生育に影響を与えなかったことから、Csx30-1は細胞の増殖を阻害することが示唆されました。また、Csx31はCsx30による生育阻害を抑制することがわかりました。さらに、構造予測の結果、(1)Csx30、Csx31、RpoEは複合体を形成すること、および、(2)Csx30-1はRpoEと相互作用しRpoEの機能を阻害することが示唆されました。実際に、生化学的解析の結果、Csx30、Csx31、RpoEは複合体を形成することが確認されました。これらの結果から、Csx30-1はRpoEと結合し転写を制御することにより、細胞の増殖を阻害することが示唆されました。以上の結果を総合し、III-E型CRISPR-Cas免疫機構において、Cas7-11-Csx29複合体はウイルス由来RNAを切断するとともに、Csx30の切断を介して細胞増殖を停止させることにより、細胞集団をウイルス感染から守るという分子機構が示唆されました(図5)。
さらに、本研究チームは、Cas7-11-Csx29およびCsx30をヒト培養細胞に導入し、ガイドRNAと相補的な標的RNAが存在する場合のみ、Csx29がCsx30を切断することを利用し、標的RNAの存在を蛍光として検出することに成功しました。Cas9やCas13と異なり、Cas7-11-Csx29はRNA依存性ヌクレアーゼ-プロテアーゼとしてはたらくため、今後、様々な新規テクノロジーへの応用が期待されます。
本研究は、稲盛財団InaRISフェローシップ、武田科学振興財団武田報彰医学研究助成、AMED「新興・再興感染症研究基盤創生事業(多分野融合研究領域)(課題番号:JP21wm0325048h0001)」、科研費「挑戦的研究(開拓)(課題番号:20K20579)」、「学術変革領域研究(A)(課題番号:21H05281)」などの支援により実施されました。
5.発表雑誌
- 雑誌名:
- 「Science」(オンライン版:11月3日)
- 論文タイトル:
- RNA-triggered protein cleavage and cell growth arrest by the type III-E CRISPR nuclease-protease
- 著者:
- Kazuki Kato*, Sae Okazaki*, Cian Schmitt-Ulms*, Kaiyi Jiang*, Wenyuan Zhou, Junichiro Ishikawa, Yukari Isayama, Shungo Adachi, Tomohiro Nishizawa, Kira S. Makarova, Eugene V. Koonin, Omar O. Abudayyeh**, Jonathan S. Gootenberg**, Hiroshi Nishimasu**(*筆頭著者、**責任著者)
- DOI:
- 10.1126/science.add7347
6.問い合わせ先
東京大学先端科学技術研究センター 構造生命科学分野 教授 西増 弘志(にします ひろし)
7.用語解説
(注1)CRISPR-Cas獲得免疫機構:
原核生物のもつ生体防御機構のひとつ。原核生物に感染するウイルス由来の核酸(RNAやDNA)の分解を担う。I~VI型に分類される。ウイルス由来核酸の分解にはCas9(II型)、Cas12(V型)、Cas13(VI型)、Cas7-11(III-E型)など様々なCRISPR-Cas酵素が関与する。
(注2)クライオ電子顕微鏡:
液体窒素冷却下でタンパク質などの分子に電子線を照射し、試料の観察を行うための装置。タンパク質や核酸の立体構造の決定に利用されている。
8.添付資料
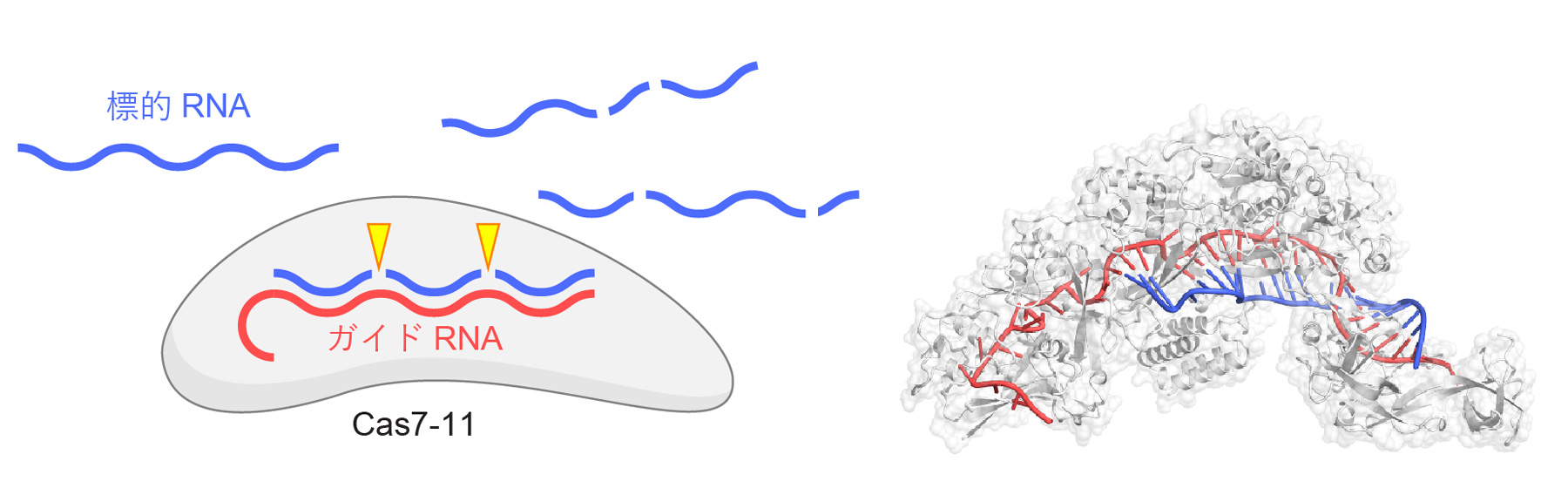
図1 Cas7-11の機能と構造
Cas7-11はガイドRNAと複合体を形成し、ガイドRNAと相補的な1本鎖RNAを2か所(塩基3と4および塩基9と10の間)で特異的に切断する。
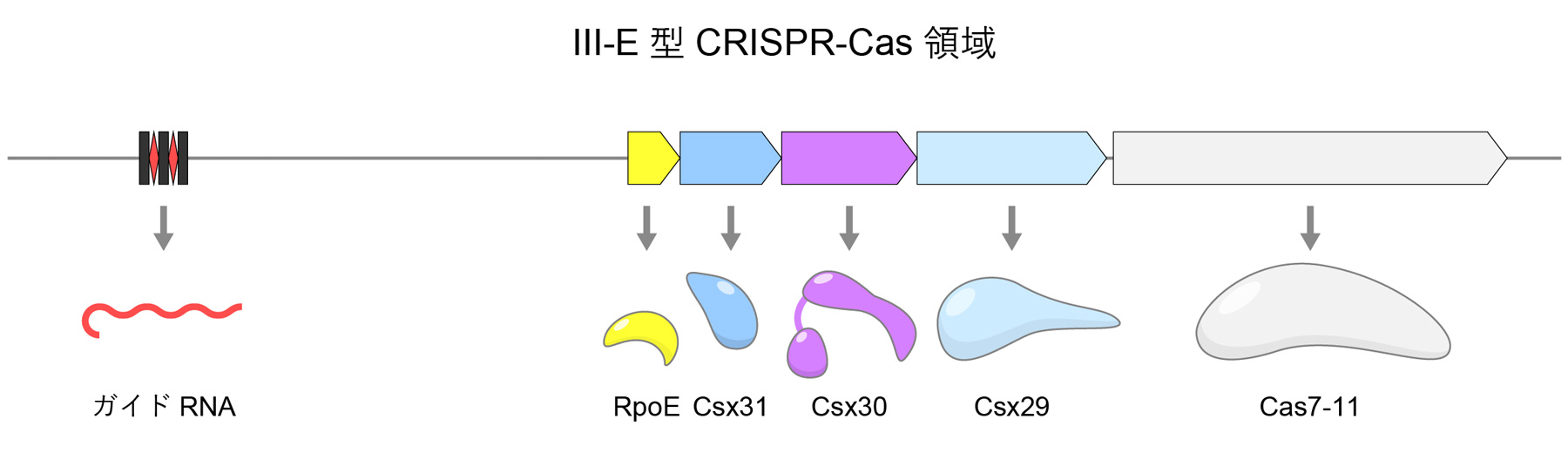
図2 III-E型CRISPR-Cas領域
ある種の原核生物のゲノムに存在するIII-E型CRISPR-Cas領域には、Cas7-11、ガイドRNA(CRISPR RNA)、Csx29、Csx30、Csx31、RpoEがコードされている。
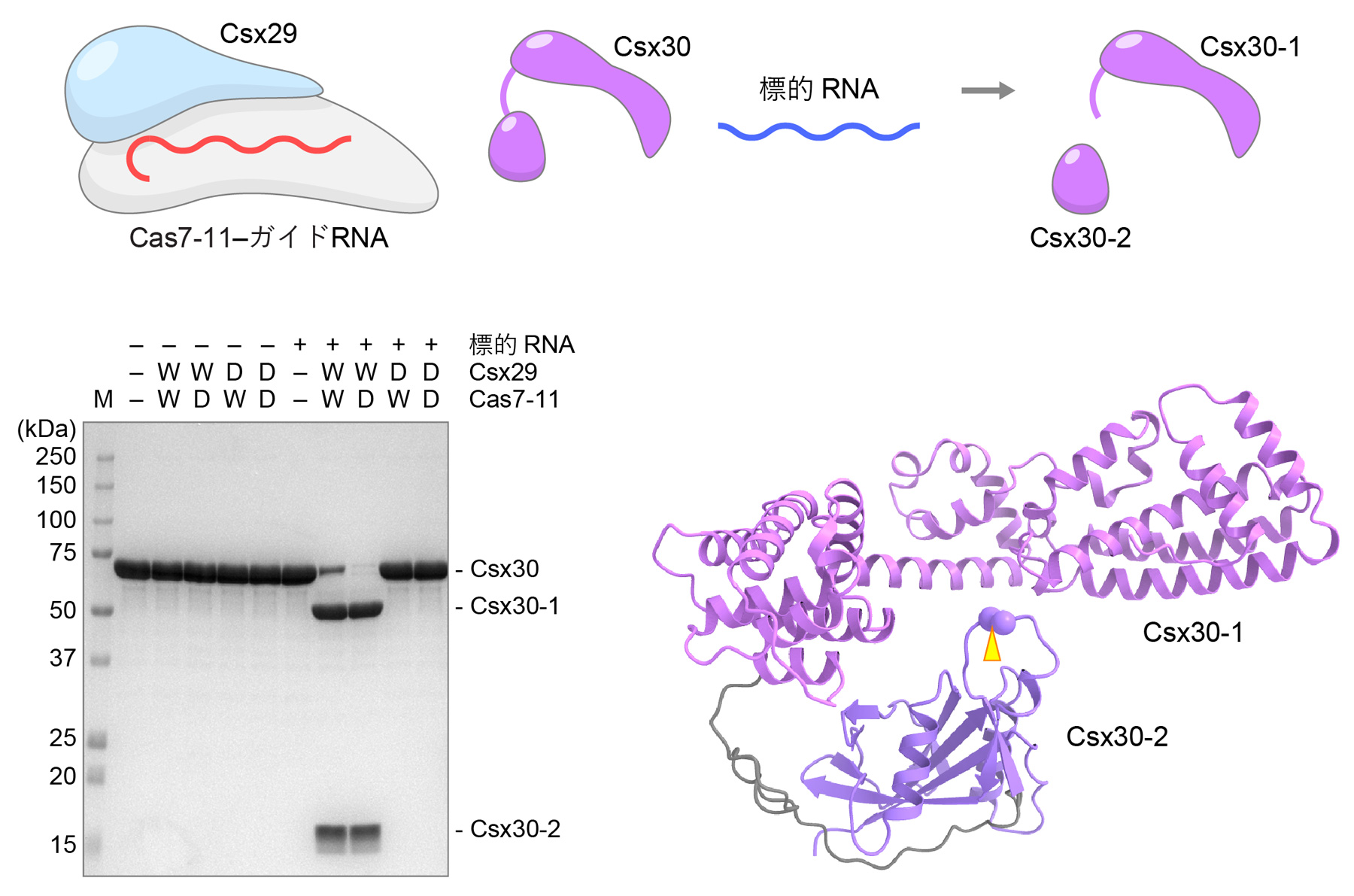
図3 Csx29によるCsx30の切断
標的RNA存在下および非存在下でCas7-11-ガイドRNA-Csx29とCsx30を混合したところ、標的RNA存在下でのみCsx30は2つの断片(Csx30-1とCsx30-2)に切断された。W(Wild-type)は野生型のCas7-11およびCsx29、D(Dead)はヌクレアーゼ不活性型Cas7-11およびプロテアーゼ不活性型Csx29を示す。構造予測プログラムAlphaFold2を用いて予測したCsx30の立体構造に切断部位(M427とK428の間)を三角形で示した。
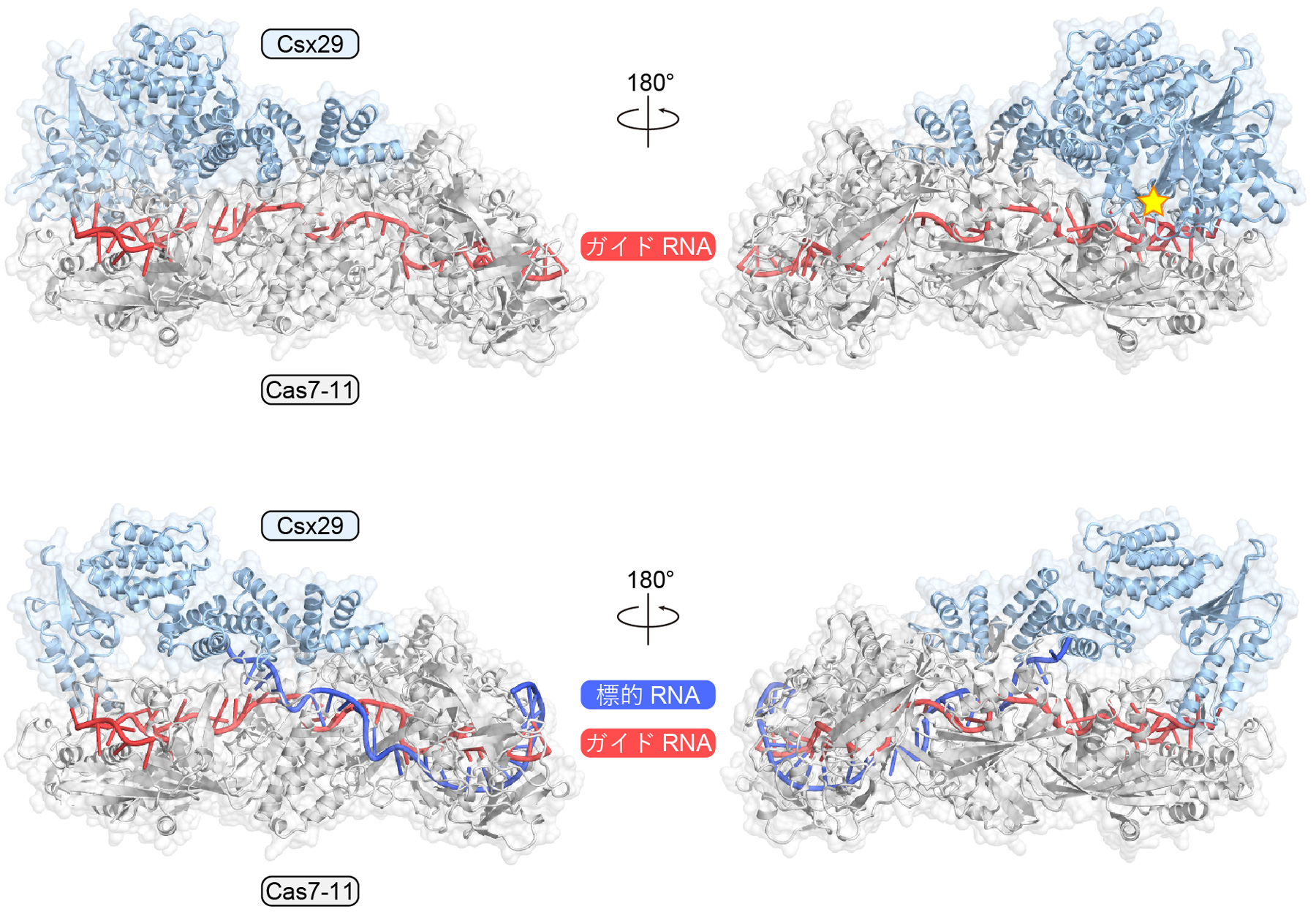
図4 Cas7-11-ガイドRNA-Csx29複合体およびCas7-11-ガイドRNA-Csx29-標的RNA複合体の立体構造
Csx29の活性部位を星印で示した。標的RNAが結合した構造では、活性部位を含む領域の密度が観察されなかったことから、標的RNAが結合するとCsx29の構造が変化しCsx30が結合できる活性化状態になると考えられる。
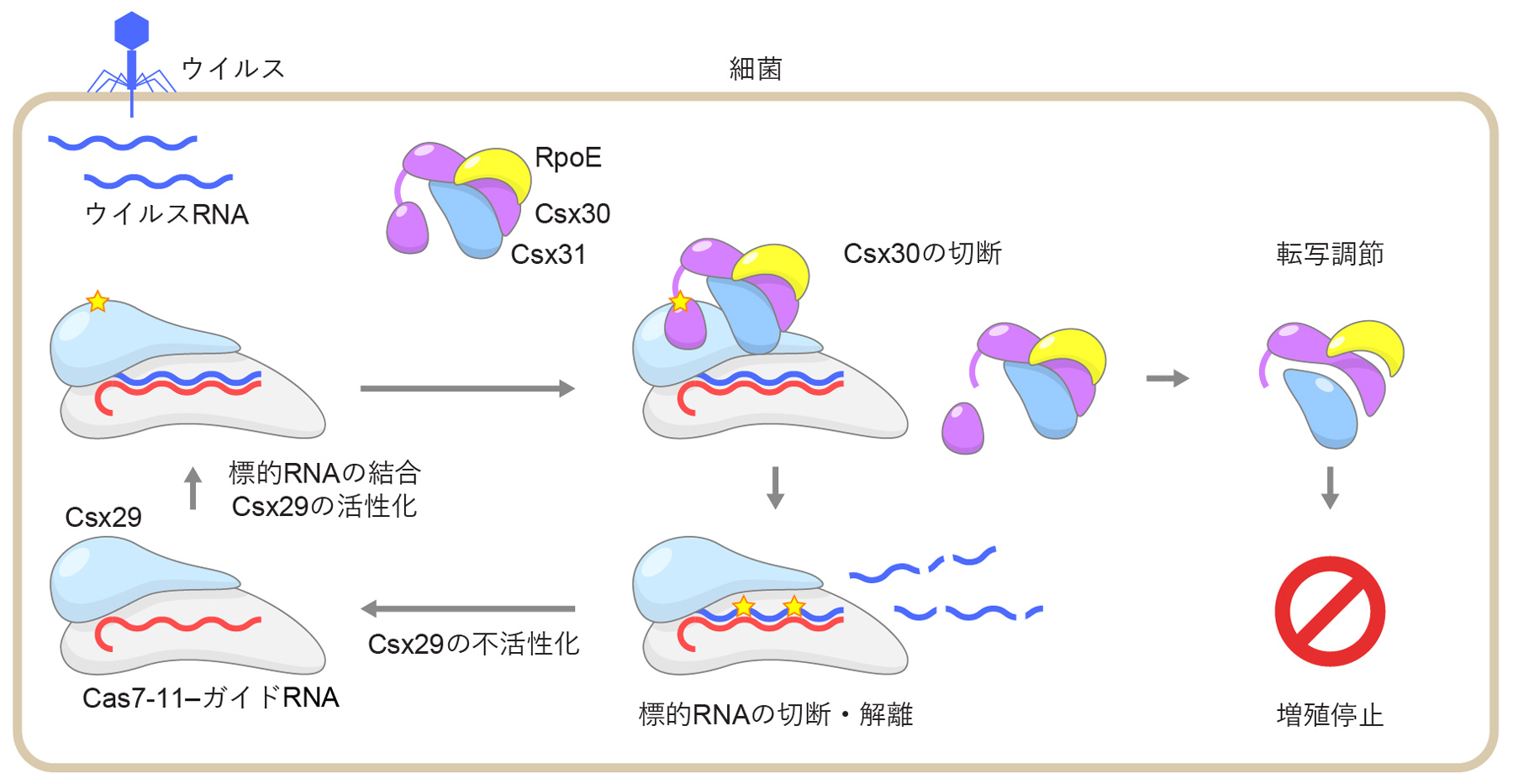
図5 III-E型CRISPR-Cas免疫機構
Cas7-11-ガイドRNA-Csx29複合体にウイルス由来RNAが結合すると、Csx29が活性化しCsx30-Csx31-RpoE複合体中のCsx30を切断する。Csx30のC末端領域(Csx30-2)が切り離されると、Csx30-Csx31-RpoE複合体の細胞内局在が変化し、RpoEのはたらきによりmRNAの合成(転写)が変化する。この結果、細胞の増殖が停止し、ウイルスの感染が抑制されると考えられる。Cas7-11-ガイドRNA-Csx29複合体に結合したウイルス由来RNAはCas7-11によって切断される。切断された標的RNAは複合体から解離し、Csx29は不活化する。Csx30-Csx31-RpoE複合体による転写制御の分子機構の詳細は不明であり、III-E型CRISPR-Cas免疫機構の理解にはさらなる研究が必要である。