2022-11-04 理化学研究所,岩手医科大学
理化学研究所(理研)生命医科学研究センターがんゲノム研究チームの藤田征志上級研究員(研究当時、現客員研究員)、中川英刀チームリーダー、岩手医科大学医歯薬総合研究所医療開発研究部門の西塚哲特任教授らの国際共同研究グループは、プロテオミクス解析[1]により、肝臓がんが三つに分子分類できることを明らかにし、それぞれの肝臓がんに最適となる薬物療法を見つけました。
本研究成果は、肝臓がんに対する免疫療法や分子標的薬の選択、および新しい治療薬の開発に貢献すると期待できます。
今回、国際共同研究グループは、これまで理研において全ゲノムシーケンス解析[2]を行ってきた259例の肝臓がんに対して、RPPA法[3]を用いて機能的タンパク質発現情報を取得し、全ゲノムとRNA発現情報を統合して解析し、肝臓がんの機能的分子分類を行いました。その結果、三つの群(R1、R2、R3)に分類できることが判明し、各群にとって最適である薬物療法を理論的に決定しました。腫瘍免疫活動が強いR1群には免疫チェックポイント阻害剤[4]が、予後が最も悪く増殖能が高いR2群には免疫チェックポイント阻害剤と血管新生阻害剤[5]との複合免疫療法が、腫瘍免疫活動が弱いR3群にはmTOR阻害剤[6]やRTK阻害剤[7]での治療が適切であると考えられます。
本研究は、オンライン科学雑誌『Nature Communications』(10月29日付)に掲載されました。
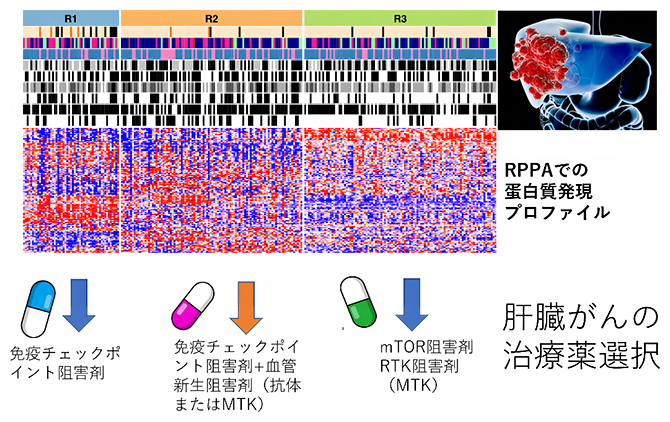
肝臓がんの三つの機能的タンパク質発現に基づく分類(R1、R2、R3)と最適な治療薬
背景
肝臓がんは、日本における部位別がん死亡者数で、男性では4位、女性では6位です。年間約4万人が肝臓がんと診断され、2万7000人以上(2018年)が死亡しています注1)。主な原因は、肝炎ウイルスの持続感染であり、世界中の肝臓がん患者の約75%は、B型肝炎ウイルス(HBV)またはC型肝炎ウイルス(HCV)の感染によるものと推定され、肝炎ウイルスに感染し、慢性肝炎発症から肝硬変を経ると、高い確率で肝臓がんを発症します。
肝臓がんの治療には、現在、さまざまな方法があります。外科的切除、穿刺(せんし)局所療法、肝動脈化学塞栓療法、全身薬物療法、肝移植などが、がんの進行度や肝臓の機能を評価した上で選択されます。高度進行肝臓がんや再発性肝臓がんに対しては薬物療法が推奨されており、さまざまな治療薬が開発されています。分子標的薬としては、新生血管の形成に関与するVEGF/VEGFR2[5]や、がん細胞の増殖に関連するキナーゼ(タンパク質リン酸化酵素)[8]を標的としたマルチキナーゼ阻害剤(MKI)[8]が広く使われており、最近は、免疫チェックポイント阻害剤と血管新生阻害薬との複合免疫療法が高い効果を示すことが実証され、主たる治療法として使われています。
がんは、ゲノム異常が蓄積することによって発症・進行する「ゲノムの病気」です。国際共同研究グループは、これまで肝炎ウイルス関連の肝臓がんを中心に全ゲノムシーケンス解析注2)によるゲノム変異、RNAシーケンス解析により肝臓がんの腫瘍免疫注3)の研究を進めてきました。さまざまなゲノム異常を同定し、ゲノム異常・腫瘍免疫と肝臓がん発症との関わりを解明してきました。
しかし、がんで見つかる多くの変異情報の意義は依然不明であり、肝臓がんの治療方針や新たな治療法の開発に直接つながる例は多くありませんでした。その原因としては、ゲノムは設計図である一方、実際にがんの発生や増殖に機能しているのはタンパク質であり、分子標的治療薬も、キナーゼなどのタンパク質の機能を抑制するものであることが考えられます。そこで、今回はがんにおける治療標的やがんで活性化している機能的タンパク質の発現情報を得ることで、より適切な治療方針と関連づけができるのでないかと考え、研究を進めました。
注1)国立がん研究センターがん情報サービスセンター「最新がん統計」
注2)2016年4月12日プレスリリース「肝臓がん300例の全ゲノムを解読」
注3)2020年2月28日プレスリリース「肝臓がんにおける免疫抑制機構を発見」
研究手法と成果
国際共同研究グループは、これまで理研において全ゲノムシークエンス解析を行ってきた日本人の300例以上の肝臓がんのうち、残存している259例の凍結標本からタンパク質を抽出し、米国MDアンダーソンがんセンターと岩手医科大学の西塚哲特任教授らによって開発された、精度および再現性の高い網羅的タンパク質測定手法であるRPPA法により大規模タンパク質解析を行いました(図1左)。
がんの治療標的となっているシグナル分子やキナーゼ、キナーゼによるリン酸化タンパク質を主体にして、293個の抗体を用いてタンパク質発現プロファイルを作成しました。RPPA法は、これまで米国の大規模がんゲノムデータベースTCGA[9]において採用されてきた解析技術であり、同じプラットフォームを用いた肝臓がんのタンパク質発現データを500例ほど保有し、そのデータも今回の解析で比較検討しました。また、血管新生因子の中心的機能を担うリン酸化VEGFR2の量も測定しました。
これらのデータから、クラスタリング解析を行ったところ、今回の日本人の肝臓がんについて三つの群(R1、R2、R3)に分類することができました(図1右)。TCGAの肝臓がんデータからも同様の3分類が確認されており、再現性も証明されました。
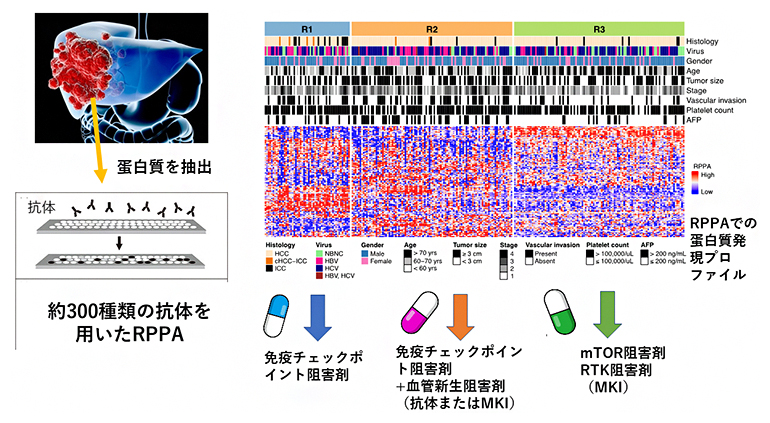
図1 RPPA法による肝臓がんの分子分類と最適治療薬物の選択
約300種類の抗体を用いたRPPA法により、肝臓がんの機能的タンパク質の発現プロファイルを作成し、三つの分子分類(R1、R2、R3)を行った。タンパク質発現プロファイル中の赤色は高発現または活性化、青色は低発現または低活性を示す。右下は、それぞれの群に最適な治療薬物の選択結果。
まず、R1群(53例)は胆管分化型の肝臓がんが多く含まれ、免疫細胞の腫瘍内浸潤も多く、免疫学的にHOTな腫瘍[10]でした(図2)。R2群(100例)は細胞増殖機能が高く、予後不良の肝臓がんが多く含まれ、細胞周期関連および血管新生関連のタンパク質の発現や活性が高い腫瘍でした。がん抑制遺伝子であるTP53遺伝子の変異が多く観察され、免疫学的にもHOTな腫瘍であり、またVGFR2やリン酸化VGFR2の発現も高い傾向にありました(図2)。
そして、R3群(106例)は免疫細胞の腫瘍内浸潤が少ない免疫学的にCOLDな腫瘍[10]が多く含まれ、CTNNB1遺伝子[11]の変異が多く観察されました。興味深いことに、非ウイルス性の肝臓がんがR3群に多く含まれており、RTK/RAS/MAPKシグナル伝達経路[7]やTSC/mTORシグナル[6]伝達経路、およびホルモン関連のタンパク質やリン酸化タンパク質の高発現が観察されました(図2)。
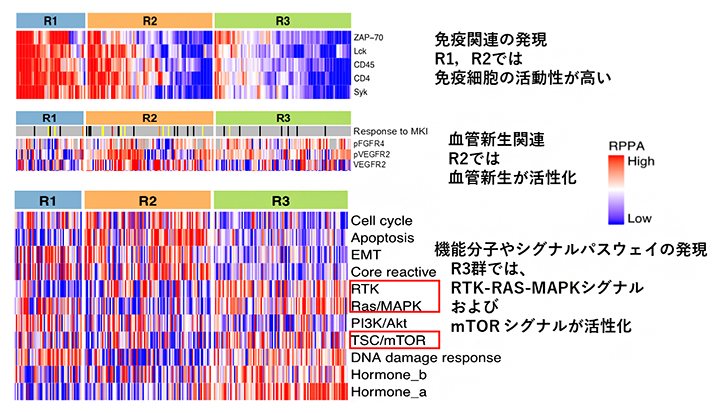
図2 3群での腫瘍内免疫、血管新生関連などの機能的タンパク質の発現と活性
赤色は高発現または活性化、青色は低発現または低活性を示す。
(上段)免疫関連の発現では、R1群とR2群が高発現。
(中段)血管新生では、R2群の活性化が高い。
(下段)機能分子、シグナル別では、R3群にてRTK、RAS/MAPK、TSC/mTORシグナルが活性化している。
次に、これらの三つの分子分類群のそれぞれについて、最適な薬剤治療の選択を試みました。R1群は免疫学的にHOTな腫瘍であることから、免疫チェックポイント阻害剤が第一選択になります。R2群は、免疫チェックポイント阻害剤に加えて、血管新生阻害作用を持つ薬剤、VEGF阻害抗体またはVEGFR2への強い阻害作用を持つMKIでの治療が勧められます。
そして、免疫的にCOLDなR3群は、TSC/mTORおよびRTKやRAS/MAPKシグナル伝達経路が活性化していることから、mTOR阻害剤またはRTK阻害剤、またはそれらへの強い阻害作用を持つMKIが勧められます。
実際に、20種類の肝臓がん細胞株に、同様のRPPA法によるタンパク質発現情報、遺伝子変異情報、そして、さまざまな分子標的の感受性(増殖抑制効果)の情報を収集し、R3群に属する肝臓がん細胞株は、mTOR阻害剤に感受性が高いことを実証しました(図3)。
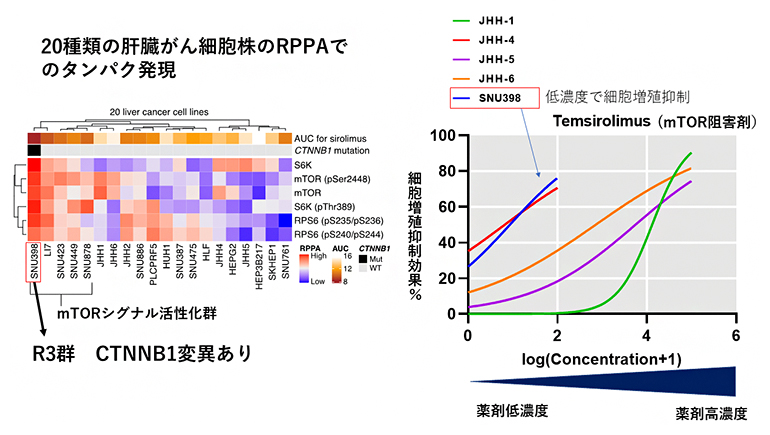
図3 肝臓がん細胞株でのmTOR関連タンパク質の発現とmTOR阻害剤の感受性
(左)20種類の肝臓がん細胞株でのTSC/mTOR関連タンパク質の発現とCTNNB1遺伝子の変異。
(右)mTOR阻害剤の濃度と細胞増殖抑制効果との関連を示すグラフ。R3群に属するSNU398細胞株(青線)は、mTOR阻害剤の感受性が高いことが分かった。
今後の期待
本研究により、肝臓がんの機能的タンパク質に基づく分子分類を行うことができました。高度進行肝臓がんや再発性肝臓がんに対しては、免疫療法や分子標的薬などさまざまな治療薬が開発されていますが、今回の分類によって治療薬を適切に選択できるものと期待できます。
また、これら治療標的となっている機能的タンパク質情報をさらに詳細に解析することで、肝臓がんへの新しい治療薬の開発にも貢献すると期待できます。
補足説明
1.プロテオミクス解析
プロテオミクス解析には、特異抗体との結合性や質量分析法、タンパク質同士の相互作用などを解析する技術などが主として用いられており、それによってタンパク質の構造や発現、機能性・動態などの情報が得られる。こうしたプロテオミクス解析の成果は、分子機能と直接関連するため、新しい医薬品の効率的な開発や疾病のメカニズムの解明などに利用できる。
2.全ゲノムシーケンス解析
次世代シーケンサーを使って、約30億塩基からなる個人の正常細胞やがん細胞の全ゲノム情報を解読し、配列の違いや変化を同定すること。データが大量になるため、スーパーコンピュータを使って情報解析を行うのが一般的である。全ゲノムシーケンス解析の場合、タンパク質をコードする1~2%の範囲のエクソンだけでなく、遺伝子の発現を制御するゲノム領域の変異やさまざまな構造異常(大きなゲノム配列異常)も検出可能で、究極のゲノム解析手法といえる。
3.RPPA法
逆相タンパク質アレイ法とも呼ばれる。組織や細胞抽出液をスライドガラスにマイクロアレイ化(数千スポット/スライド)し、タンパク質やリン酸化特異抗体を用いて、数百~数千の試料における約200~400個のシグナル伝達の鍵となるタンパク質の発現やリン酸化状態を把握できる。RPPA法は、これまで米国最大規模のがんゲノムデータベースTCGAに採用されており、精巧かつ再現性の高いタンパク質発現データを取得できる。RPPAはReverse Phase Protein Arraysの略。
4.免疫チェックポイント阻害剤
免疫反応の抑制に関わるPD-1、PD-L1に対する特異的抗体の投与によって、腫瘍免疫が活性化され、高い抗腫瘍効果を発揮する。PD-1を標的とした抗体薬は、悪性黒色腫や肺がんに対して米国で2014年に承認され、2019年には肝臓がんに対しても日本で承認された。さらに、腎臓がん、胃がん、頭頚部がん、食道がんなどに対しても承認されており、進行、再発肺がんや肝臓がんに対しては、第一選択薬となりつつある。
5.血管新生阻害剤、VEGF/VEGFR2
肝臓がんや腎臓がんは腫瘍内の血流が非常に豊富であり、増殖転移するときに「血管新生」と呼ばれる栄養血管の形成が盛んに起こっている。血管新生阻害剤とは、血管新生に不可欠な因子である血管内皮細胞増殖因子(VEGF)が血管内皮細胞増殖因子受容体(VEGFR2)に結合して活性化することを阻害することで、新生血管の形成を阻害し、腫瘍内血流を正常化する。血管新生阻害剤としては、抗VEGF抗体であるベバシズマブが肝臓がんや大腸がんで使われている。多くのマルチキナーゼ阻害剤(MKI)も、VEGFR2キナーゼの阻害効果を保有しており、血管新生阻害の効果を発揮する。
6.mTOR阻害剤、TSC/mTORシグナル
mTOR(セリン/スレオニンキナーゼ)は複数のタンパク質と結合し、成長因子、栄養、エネルギー代謝、酸化還元状態、オートファジーといったタンパク質の合成・分解などの細胞内外の環境を調節し、細胞の分裂や生存にとって重要な役割を担う。TSCは、mTORシグナルの中心を担うがん抑制遺伝子である。mTORを阻害する薬剤が多数開発されており、免疫抑制や抗腫瘍活性を発揮する。現在、腎臓がんに対してアフィニトールとテロシロリムスが承認されている。
7.RTK阻害剤、RTK/RAS/MAPKシグナル伝達経路
EGFRやHER2などの受容体型チロシンキナーゼ(RTK)からの信号刺激は、RASやRAFなどの多段階プロセスを経てMAPK(マップキナーゼ)の活性化を誘発し、細胞分裂を促進する。このRTK/RAS/MAPKシグナル伝達経路には多くのリン酸化やキナーゼが関連しており、EGFR阻害剤、HER2阻害剤といったRTK阻害剤、およびBRAF阻害剤、MAPK阻害剤など、さまざまな阻害剤ががんの分子標的薬として使われている。
8.キナーゼ(タンパク質リン酸化酵素)、マルチキナーゼ阻害剤(MKI)
キナーゼは、ATPを利用して、タンパク質のセリン残基やスレオニン残基をリン酸化するセリン/スレオニンキナーゼ(STK)と、チロシン残基をリン酸化するチロシンキナーゼ(TK)に大別される。ヒトには500種類以上存在し、シグナル伝達を担っている。がん細胞ではキナーゼの働きが異常な場合が多く、それを阻害することは細胞増殖の抑制につながるため、抗がん剤の標的になっている。マルチキナーゼ阻害剤は、がん細胞の増殖や血管新生に関わる血管新生因子受容体VEGFR、血小板由来増殖因子受容体(PDGFR)、幹細胞因子受容体(KIT)、線維芽細胞増殖因子FDGFR、Rafなどの複数のキナーゼを阻害して、腫瘍細胞の増殖を抑制し、血管新生を阻害することにより効果を示す薬剤。肝臓がんに対しては、レンバチニブ、ソラフェニブ、レゴラフェニブが承認されており、それぞれが阻害するキナーゼが異なる。
9.TCGA
2006年から米国で開始された大型がんゲノムプロジェクト。20種類以上のがん種について、ゲノム・RNA発現、DNAメチル化、タンパク質発現異常の網羅的な解析を行ってきた。これらのデータは広く公開されており、世界のがん研究のための重要なデータ基盤となっている。MDアンダーソンがんセンターはTCGAのタンパク質発現解析のコアラボであり、RPPA法による大規模解析を行っている。TCGAはThe Cancer Genome Atlasの略。
10.免疫学的にHOT/COLDな腫瘍
腫瘍組織内に、T細胞などの腫瘍細胞を認識し攻撃する免疫細胞が多数観察される腫瘍は、免疫学的にHOTと考えられる。この腫瘍では、免疫チェックポイント分子の活動により、免疫細胞の腫瘍への攻撃が抑制されており、免疫チェックポイント阻害によって、腫瘍免疫が活性化して腫瘍が縮小する。反対に免疫学的にCOLDな腫瘍は、腫瘍細胞を攻撃する免疫細胞が腫瘍内にないため、免疫チェックポイント阻害の効果がないとされる。
11.CTNNB1遺伝子
Wnt/β-カテニンシグナル伝達経路の中心的分子であるβカテニンをコードする遺伝子。βカテニンは核に移行して、下流の遺伝子の転写を活性化する。肝臓がんでは、約30%にCTNNB1遺伝子の変異が観察され、この変異によりWnt/β-カテニンシグナルが活性化し、腫瘍免疫抑制効果も発揮する。
国際共同研究グループ
理化学研究所 生命医科学研究センター がんゲノム研究チーム
上級研究員(研究当時、現客員研究員)藤田 征志(フジタ・マサシ)
研究員 笹川 翔太(ササガワ・ショウタ)
チームリーダー 中川 英刀(ナカガワ・ヒデワキ)
岩手医科大学 医歯薬総合研究所 医療開発研究部門
特任教授 西塚 哲(ニシヅカ・サトシ)
広島大学大学院 医歯薬保健学研究院 応用生命科学部門 消化器・代謝内科学
助教 大野 淳(オオノ・アツシ)
教授(研究当時)茶山 一彰(チャヤマ・カズアキ)
広島大学病院 病理診断科
教授 有廣 光司(アリヒロ・コウジ)
和歌山県立医科大学 第2外科
教授(研究当時)山上 裕機(ヤマウエ・ヒロキ)
MDアンダーソンがんセンター(米国)
大学院生 メイユ・メイ・チェン(Mei-Ju May Chen)
上級研究員 ドリス・リエコ・シワク(Doris Rieko Siwak)
教授 ハン・リャン(Han Lian)
研究支援
本研究は、文部科学省科学研究費および日本医療研究開発機構次世代がん医療創生研究事業研究領域E「がんゲノム解析による新規免疫療法および複合免疫療法開発のためのシーズ探索(研究代表者:中川英刀)」による助成を受けて行われました。
原論文情報
Masashi Fujita, Mei-Ju May Chen, Doris Rieko Siwak, Shota Sasagawa, Ayako Oosawa-Tatsuguchi, Koji Arihiro, Atsushi Ono, Ryoichi Miura, Kazuhiro Maejima, Hiroshi Aikata, Masaki Ueno, Shinya Hayami, Hiroki Yamaue, Kazuaki Chayama, Ju-Seog Lee, Yiling Lu, Gordon B. Mills, Han Liang, Satoshi Nishizuka, and Hidewaki Nakagawa, “Proteogenomic Characterization of Virus-associated Liver Cancers Reveals Potential Subtypes and Therapeutic Targets”, Nature Communications, 10.1038/s41467-022-34249-x
発表者
理化学研究所
生命医科学研究センター がんゲノム研究チーム
上級研究員(研究当時、現客員研究員)藤田 征志(フジタ・マサシ)
チームリーダー 中川 英刀(ナカガワ・ヒデワキ)
岩手医科大学 医歯薬総合研究所 医療開発研究部門
特任教授 西塚 哲(ニシヅカ・サトシ)
報道担当
理化学研究所 広報室 報道担当
岩手医科大学 法人事務部 総務課 広報係