2018-06-01 名古屋大学 甲南大学 名古屋大学 大阪大学 金沢大学自然科学研究機構
発表のポイント
- 凝集したタンパク質をほぐして再生する「脱凝集」機能を持つ分子機械※1ClpB の動的な構造変化を、高速原子間力顕微鏡※2 により初めて直接観察することに成功した
- リング状のClpB の構造変化は、ネイティブ質量分析法※3、電子顕微鏡単粒子解析法※4、超遠心分析沈降速度法※5 からも支持された
- ClpΒ が持つ2 つのATP※6 結合部位の化学反応サイクルに応じてリングの構造が大きく変化すること、またこの変化が脱凝集活性に重要であることを明らかにした
- ClpB による脱凝集の仕組みの一端を明らかにしたことで、凝集タンパク質が原因となる疾患の治療や有用タンパク質の品質維持など医療や産業への貢献が期待される
概要
ClpB はリング状の構造を持つタンパク質で、生命にとって有害な凝集タンパク質をほぐして再生する「脱凝集」機能を持ちます。ClpB は脱凝集の際、ATP(アデノシン3 リン酸)のエネルギーを利用して、リング中央の孔にタンパク質を通すことで脱凝集すると考えられていましたが、その具体的な仕組みは分かっていませんでした。
このたび、本研究グループは、高速原子間力顕微鏡(高速AFM)を用い、ClpB リングの構造変化を直接観察することに初めて成功しました。ClpB リングの構造変化は、ネイティブ質量分析法、電子顕微鏡単粒子解析法、超遠心分析沈降速度法からも支持されました。これらの結果より、ClpB のリングはATP の結合・加水分解に応じて、円型・らせん型・ねじれた半らせん型と大きく構造変化することが明らかになりました。また、変異型ClpB を用いた解析により、これらの構造変化が脱凝集を引き起こす原動力となっていること、およびClpB が持つ2 つのATP 結合部位がそれぞれ固有の役割を担っていることを明らかにしました。
1. 研究の背景
タンパク質は多数のアミノ酸がつながった紐状の分子で、複雑な立体構造を形成して働きます。しかし、タンパク質の立体構造は熱などのストレスにより簡単に壊れ、構造が壊れたタンパク質はお互いに絡まって凝集してしまいます。例えば、ゆで卵の白身はタンパク質が凝集した状態の一例です。凝集したタンパク質は機能を失うだけでなく、生体に悪影響を与えます。ClpB は、凝集してしまったタンパク質を脱凝集して再生するという特殊な機能を持つタンパク質分子機械です。
ClpB は、AAA1、AAA2 と呼ばれるATP を結合・加水分解するドメイン※7 と、N ドメイン、M ドメインと呼ばれる補助ドメインからなり、リング状の6 量体※8 を形成して働きます。これまでの研究から、ClpB はATP の化学エネルギーを利用し、リング中央の孔に凝集したタンパク質をほぐしながら通すことで脱凝集するといわれていました。また、細長い棒状のM ドメインはリングの周囲を取り囲み、ClpB の脱凝集活性を制御することが知られています。しかし、ATP の結合・加水分解によって、ClpB の構造がどのように変化し、それがどのように脱凝集につながるのかなど、分子レベルの仕組みは分かっていませんでした。
X 線結晶構造解析※9 や極低温電子顕微鏡像※10 の三次元再構成といった手法により、これまでにClpB や、酵母の類縁分子(ホモログ)であるHsp104※11 の構造解析がなされていました。これらは、タンパク質の立体構造を原子レベルで明らかにする優れた手法ですが、多数の分子の平均構造のスナップショットが得られるだけであり、個々の分子のダイナミックな構造変化の情報を得ることは困難です。脱凝集の仕組みの関係を知るには、個々の分子の構造変化を直接観察して詳細に調べる必要がありました。
2. 研究の成果
本研究では、高速AFM を用いてClpB の構造変化を100 ミリ秒の時間分解能で観察することに成功しました。ATP 存在下で観察したところ、6 量体の「閉じたリング」と、リングの一部が切れた「開いたリング」が観察されました(図1)。ClpB が6 量体を形成することはネイティブ質量分析法でも確認され、閉じたリングと開いたリングの両方が存在することは電子顕微鏡単粒子解析法でも確認されました。閉じたリングと開いたリングは観察中に何度も行き来しており、ATP 濃度が高いほど閉じたリングの割合が増加しました。また、閉じたリングはさらに、高さがほぼ一様な「円型」、らせん階段の様に連続的に高さが変化する「らせん型」、2 つのらせん構造が向かい合った「ねじれ半らせん型」に分類されました(図1)。ねじれ半らせん型は、ClpB が6 量体リングを形成する際の構造単位が3 量体であることを示唆しますが、この点は超遠心分析沈降速度法からも初めて確認されました。円型、らせん型、ねじれ半らせん型構造は相互に行き来しており、ATP 濃度が高いほど変換の頻度が高くなりました。これらの結果から、ClpB はATP の結合によって閉じたリングを形成し、結合したATP の加水分解のサイクルに応じて円型、らせん型、ねじれ半らせん型と構造を変化させることが明らかになりました。
また、ClpB の2 つのATP 結合部位であるAAA1、AAA2 それぞれについて、ATP の結合あるいは加水分解を阻害した変異体の観察も行いました。その結果、ClpB はAAA1 へのATP の結合で多量体化が促進され、AAA2 へのATP の結合によって6 量体が安定化されるとともに、円型、らせん型、ねじれ半らせん型の変換はAAA2 でのATP 加水分解によって起こることが明らかになりました(図2)。
さらに、M ドメインの先端のアミノ酸を置換したClpB の変異体は、ATP 加水分解活性は保持するが脱凝集活性を失うことが知られています。この変異体を観察したところ、閉じたリングが円型に維持され、らせん型やねじれ半らせん型への構造変化はほとんどみられなくなりました。この結果から、今回初めて見いだされた円型、らせん型、ねじれ半らせん型間の構造変化が、脱凝集反応に重要な役割を果たしていることが明らかになりました。
3. 今後の展開
タンパク質の凝集は、ヒトではアルツハイマー病をはじめとするさまざまな疾患と深く関連しています。また、有用なタンパク質を医療や産業に利用する場合、凝集体の形成は品質管理上大きな問題になります。本研究の成果は、こうした疾患の治療や有用タンパク質の品質維持・管理に貢献する可能性を秘めています。
またClpB は、AAA+と呼ばれるタンパク質ファミリーに属しています。このファミリーには、DNA の複製、生体膜の融合、細胞内物質輸送、概日時計の維持など、生命の重要な機能を担うタンパク質が多数含まれており、ClpB とよく似た構造を持っています。本研究の成果は、これらのAAA+ファミリータンパク質に共通な仕組みの解明にもつながると期待できます。
用語解説
※1:分子機械
ATP加水分解などの化学エネルギーを機械的な動きに変換し、その動きによって機能を発揮するするタンパク質やタンパク質複合体。
※2:高速原子間力顕微鏡法(高速AFM)
非常に微細な先端を持つ探針で試料表面を高速に走査し、高さの変化として個々のタンパク質の構造変化を実時間で観察する手法。
※3:ネイティブ質量分析法
水素結合や疎水性相互作用のような弱い相互作用を保ったまま質量を調べる方法。タンパク質複合体を構成するサブユニットの種類と数が分かる。
※4:電子顕微鏡単粒子解析法
ランダムな向きに分散させた単一粒子試料の像を電子顕微鏡で多数撮影し、個々の粒子像を計算機上で抽出して分類・平均化することにより粒子の高分解能投影像を得る。そして、これを元に単一粒子の三次元構造を再構築する手法。
※5:超遠心分析沈降速度法
溶液に大きな遠心力をかけた際の分子の沈降の様子を超遠心分析装置により観測し、得られた沈降パターンから分子量分布を求める手法。
※6:ATP(アデノシン3リン酸)
二つの高エネルギーリン酸結合を持ち、これを切断することで、タンパク質などの他の分子に、機能を発揮させるためのエネルギーを供給する物質。生体内でのエネルギーの貯蔵や輸送に用いられるため、「エネルギーの通貨」に例えられる。
※7:ドメイン
タンパク質の構造の一部分。多くのタンパク質がいくつかのドメインの組み合わせで構成されている。タンパク質ドメインはそれぞれ固有の機能と構造を持つ。
※8:6 量体
分子が物理的な弱い力でまとまった単位は多量体と呼ばれる。6 量体は分子が6 個集まって一つの構造機能単位になっている。
※9:X 線結晶構造解析
タンパク質の3 次元結晶を調製し、その結晶に対しX線を照射することで、立体構造を決定する手法。
※10:極低温電子顕微鏡
タンパク質などの生体分子を薄い氷に包埋して、液体窒素温度(-196℃)の冷却下で観察する電子顕微鏡。水溶液中の生理的な環境に近い状態の分子の構造を高解像に解析できる。
※11:Hsp104
酵母の持つ熱ショックタンパク質であり、ClpB と共通の祖先に由来する(ホモログ)。熱ショックタンパク質は、細胞が熱などのストレスに応答して生産する一群のタンパク質で、タンパク質をストレスから守る機能などを持つ。
論文情報
掲載誌:Nature Communications
論文タイトル(和訳):
Dynamic Structural States of ClpB Involved in Its Disaggregation Function
(ClpB の脱凝集機能に関与する動的構造状態)
著者(全員):
Takayuki Uchihashi†, Yo-hei Watanabe†*, Yosuke Nakazaki, Takashi Yamasaki,
Hiroki Watanabe, Takahiro Maruno, Kentaro Ishii, Susumu Uchiyama, Chihong Song, Kazuyoshi Murata, Ryota Iino*, Toshio Ando* (†共同筆頭著者、*責任著者)
掲載予定日:2018 年6 月1 日18 時(日本時間)
DOI: 10.1038/s41467-018-04587-w
研究グループ
名古屋大学、甲南大学、大阪大学、自然科学研究機構生命創成探究センター、生理学研究所、分子科学研究所、金沢大学の共同研究
発表者
内橋貴之(名古屋大学理学研究科物質理学専攻(物理系) 教授)
渡辺洋平(甲南大学理工学部生物学科・統合ニューロバイオロジー研究所 教授)
中崎洋介(甲南大学理工学部生物学科・統合ニューロバイオロジー研究所 当時:研究員)
山崎孝(甲南大学理工学部生物学科・統合ニューロバイオロジー研究所 当時:研究員)
渡辺大輝(名古屋大学理学研究科物質理学専攻(物理系) 客員研究員)
丸野孝浩(大阪大学大学大学院工学研究科生命先端工学専攻 研究員)
石井健太郎(自然科学研究機構 生命創成探究センター 研究員)
内山進(大阪大学大学院工学研究科生命先端工学専攻 教授、自然科学研究機構生命創成
探究センター 客員教授)
ソンチホン(自然科学研究機構生理学研究所 特任助教)
村田和義(自然科学研究機構生理学研究所 准教授)
飯野亮太(自然科学研究機構分子科学研究所 教授)
安藤敏夫(金沢大学ナノ生命科学研究所 特任教授)
研究サポート
科学研究費補助金 JP15H03540, JP16H00830, JP16H00758 (内橋貴之)
科学研究費補助金 JP26440085(渡辺洋平)
科学研究費補助金 JP16H00770, JP17H03975(内山進)
科学研究費補助金 JP15H04366, JP16H00789, JP16H00858, JP17K19213 (飯野亮太)
科学研究費補助金 JP24227005, JP26119003(安藤敏夫)
自然科学研究機構岡崎統合バイオサイエンスセンターBIONEXT project(内山進)
JST/CREST, JPMJCR13M1(安藤敏夫)
研究に関するお問い合わせ先
名古屋大学理学研究科物質理学専攻(物理系)
教授 内橋 貴之(うちはし たかゆき)
甲南大学理工学部生物学科・統合ニューロバイオロジー研究所
教授 渡辺 洋平(わたなべ ようへい)
大阪大学大学院工学研究科生命先端工学専攻
教授 内山 進(うちやま すすむ)
自然科学研究機構分子科学研究所
教授 飯野 亮太(いいの りょうた)
金沢大学ナノ生命科学研究所
特任教授 安藤 敏夫(あんどう としお)
報道担当
名古屋大学 総務部総務課 課長補佐・広報室長
甲南学園 広報部
自然科学研究機構 生命創成探究センター 広報担当
大阪大学 工学研究科 総務課 評価・広報係
自然科学研究機構 分子科学研究所 研究力強化戦略室 広報担当
金沢大学 総務部広報室 広報係
添付資料
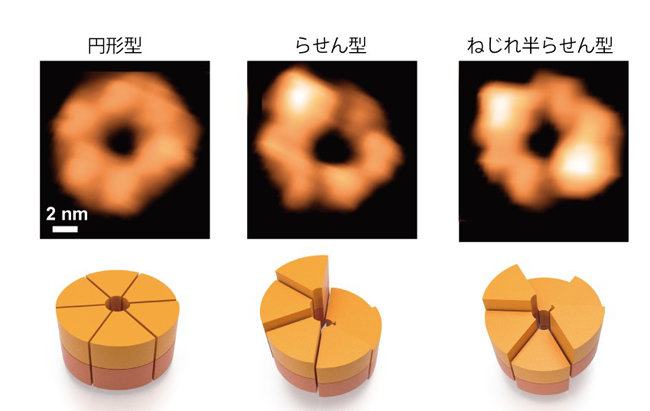
図1:高速AFM によるClpB リングの観察像(上)と模式図(下)。円型、らせん型、ね
じれ半らせん型が観察された。上段のスケールバー(白線)は2 nm。
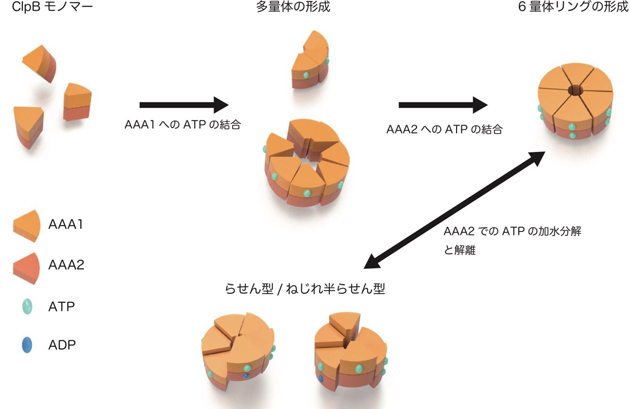
図2:ClpB の動的な構造変化の模式図