2022-11-14 理化学研究所,京都大学
理化学研究所(理研)生命機能科学研究センター 個体パターニング研究チームの升本 英利 上級研究員(臨床橋渡しプログラム[1]・升本研究室 研究リーダー、京都大学医学部附属病院 心臓血管外科 特定助教)、老化分子生物学研究チームの砂川 玄志郎 上級研究員(研究当時、現 冬眠生物学研究チーム チームリーダー)、京都大学大学院 医学研究科 心臓血管外科の許 敞一 博士課程学生らの共同研究グループは、心臓血管手術に伴う腎臓障害モデルマウスに冬眠[2]様状態を誘導する実験により、疾患状態の動物を人工的に冬眠させることで臓器の障害が軽減される可能性を示しました。
本研究成果から、心臓血管手術時の超低体温法[3]に代わる臓器保護法として、将来的に冬眠様状態の誘導が腎臓保護の新しい戦略になると期待できます。
大動脈手術など循環停止[4]を必要とする心臓血管手術においては、手術中の虚血[5]による術後の臓器機能不全が問題となっています。特に、急性腎障害(AKI)[6]は術後の主要な合併症であり、死亡率の上昇と関連します。循環停止中の臓器保護法として、20℃以下の超低体温による低代謝誘導が用いられていますが、低体温は術後の出血や感染症のリスクを高める可能性があります。
今回、共同研究グループは、砂川 上級研究員らが2020年に報告した非冬眠動物への冬眠様状態(低代謝状態)の誘導(QIH[7])が、循環停止時の腎臓保護効果を示すか検討しました。その結果、QIHを誘導した腎臓虚血モデルマウスでは、低体温にしなくても腎機能障害を部分的に予防できることを明らかにしました。
本研究は、科学雑誌『JTCVS Open』オンライン版(11月7日付)に掲載されました。
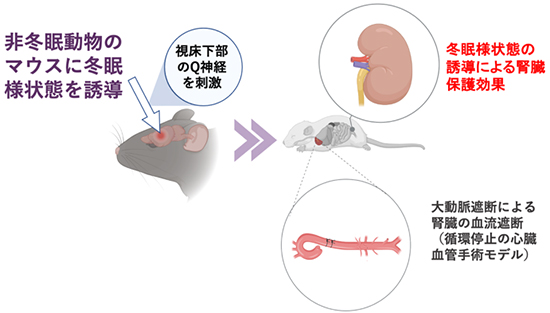
冬眠様状態の誘導による心臓血管手術時の腎臓保護効果
背景
動脈硬化に起因する循環器疾患は増加の一途をたどっており、世界的に見ても主要な死因の一つとなっています注1)。循環器疾患の外科治療である心臓血管手術の件数も近年増加傾向にありますが、大動脈手術など循環停止を必要とする手術においては、術中臓器虚血による術後臓器の機能不全が問題となっています。今後、循環器以外に合併症を持つ高齢患者が増加する可能性を考慮すると、心臓血管手術後の多臓器合併症へのさらなる対処が課題となります。
特に、急性腎障害(AKI)は術後の主要な合併症であり、短期および長期の死亡率の上昇と関連しています。循環停止を伴う大動脈手術後のAKI発症率は5~50%と高く、循環停止とそれに伴う腎臓の虚血がAKIの原因であることを示しています。
虚血により臓器が低酸素状態に陥ると、組織に回復不可能な障害をもたらす場合があります。一方、体温を強制的に低下させると組織が低代謝状態となり、酸素消費量は減少します。酸素消費量が減少した臓器は低酸素状態に耐性を持つと考えられ、1950年代から心肺停止や脳死などの蘇生医療において体温を下げることの利点が数多く報告されています。循環停止を必要とする心臓血管外科の分野では、1970年代から20℃以下の超低体温による低代謝の誘導が、循環停止中の臓器保護に広く応用されています。しかし、低体温を介した術後の凝固障害や血小板機能障害により、術後の出血の危険性や輸血の必要性が高まるとされています。さらに、超低体温法は手術時間の延長の原因となり、術後の感染性合併症のリスクを高める可能性があります。
リスなどの一部の哺乳類は、冬眠または休眠[2]と呼ばれる、低体温と低代謝に伴う生理的活動の低下状態になることがよく知られています。冬眠動物は、食物摂取量やエネルギー生産量が極端に減少し、体温や代謝が低い状態で生存できます。マウスは通常の状態では冬眠しない非冬眠動物として認識されていますが、発表者の砂川 上級研究員らは、脳の視床下部にある特定の神経細胞(Q神経[7])を刺激すると、マウスを冬眠様状態にできること(Q神経誘導性低代謝:QIH)を2020年に明らかにしました注2)。この発見は、非冬眠動物であるヒトも冬眠様状態に入ることができる可能性を示しています。
循環停止を必要とする心臓血管手術において、超低体温法に代わる冬眠様状態(代謝低下状態)の誘導は、将来的に腎臓保護のための全く新しい戦略になると期待されます。そこで本研究では、Q神経の活性化により代謝低下を誘導する遺伝子改変マウス(QIHマウス)を用いて、QIHによる循環停止時の腎臓保護効果を検討しました。
注1)2019年の全世界死因1位はIschaemic heart disease(虚血性心疾患)で、約890万人が亡くなっている。
WHO「The top 10 causes of death(9 December 2020)」
注2)2020年6月12日プレスリリース「冬眠様状態を誘導する新規神経回路の発見」
研究手法と成果
共同研究グループは、循環停止を伴う大動脈手術を模した非臨床研究として、QIHマウスおよび対照マウス(QIHを誘導しないこと以外は同じ条件のマウス)の胸部下行大動脈を遮断してマウス下半身に虚血を誘導する処置を行いました。また体温と腎臓障害の関係を調べるため、ヒーターおよびクーラーの使用により体周囲の温度を制御することで正常体温群(35.0±1.3℃)と低体温群(21.5±1.3℃)に分け、虚血誘導後に血液および腎臓を採取して腎臓障害の程度を評価しました(図1)。
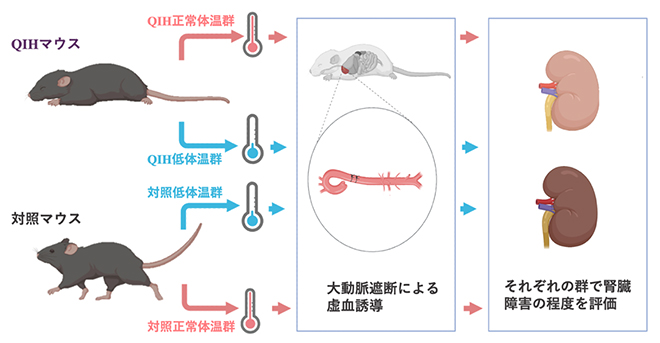
図1 QIHによる腎臓保護効果を検証する実験デザイン
Q神経の活性化により代謝低下を誘導するマウス(QIHマウス)と対照マウスそれぞれに正常体温群と低体温群を設定し、大動脈遮断による腎虚血を誘導した後、腎臓障害の程度を評価した。
まず、組織学的解析により腎尿細管[8]障害の程度を調べたところ、対照マウスの正常体温群では重度の腎尿細管損傷が観察されました。腎尿細管損傷の半定量的評価では、QIHマウスと対照マウスはともに、正常体温群では低体温群に比べて腎尿細管損傷スコアがそれぞれ有意に上昇しました(図2A)。一方、QIHマウスと対照マウスの正常体温群同士を比較すると、両群で統計的有意差はありませんでした(図2A)。これらの結果は、QIHの有無にかかわらず、低体温が腎臓を亜致死的[9]な腎尿細管障害から保護することを示しています。一方で、正常体温におけるQIHの腎臓保護効果をさらに検討するためには、腎臓の病理組織学的な変化が出現するより早期に腎臓障害を検出しうるマーカーによる検討が必要と考えられました。
そこで、採取した血液を用いてAKI診断マーカー[10]による評価を行いました。タンパク質NGAL[10]は尿または血漿で測定され、構造的腎臓障害の高感度バイオマーカーとして知られています。QIHマウスと対照マウスの正常体温群を比較すると、QIHマウスは対照マウスに対して有意に低いNGAL値を示しました。一方、QIHマウスの正常体温群と低体温群の間には有意差はありませんでした(図2B)。また、血清タンパク質であるシスタチンC[10]は、早期腎機能障害の非常に特異的なバイオマーカーとして知られています。シスタチンCもNGALと同様に、正常体温群においてQIHマウスでは対照マウスよりも有意に低い値を示し、QIHマウス同士では正常体温群と低体温群の間には有意差はありませんでした(図2C)。
これらの結果からQIHは、正常体温下の虚血による機能不全から、腎臓を部分的に保護することが示されました。
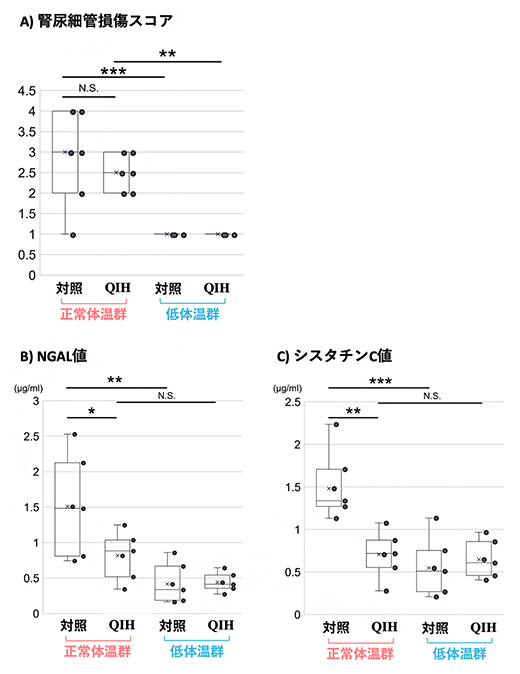
図2 組織学的解析と急性腎障害マーカーによる腎臓障害の評価
対照マウスとQIHマウスの正常体温群・低体温群それぞれから腎臓および血液を採取し、腎虚血を誘導した後に生じた腎臓障害の程度を評価した。それぞれのグラフで、黒丸は観察した個々のマウス個体を示す。
A)組織学的解析による腎臓障害の評価。尿細管上皮の刷子縁(長さや太さが不ぞろいの微絨毛が密に形成されている領域)の消失、扁平化、核の消失で示される重度の腎尿細管損傷をスコアで示した半定量的評価のグラフ。低体温群は正常体温群に比べて腎尿細管損傷のスコア値が有意に低い。一方、正常体温群の腎尿細管損傷の高いスコア値は、対照マウスとQIHマウスの間で統計的有意差はない。
B)構造的腎臓障害の高感度バイオマーカーであるNGAL値のグラフ。正常体温群のQIHマウスと、低体温群のQIHマウスおよび対照マウスは、正常体温群の対照マウスと比べていずれも有意に低いNGAL値を示した。
C)早期腎機能障害特異的バイオマーカーであるシスタチンC値のグラフ。正常体温群のQIHマウスと、低体温群のQIHマウスおよび対照マウスは、正常体温群の対照マウスと比べていずれも有意に低いシスタチンC値を示した。
今後の期待
本研究では、マウス虚血モデルにおいて、低体温が腎臓の構造的な障害からの保護に有効であることを示すとともに、QIHにより正常体温下でもAKIが一部改善されることを見いだしました。今後、ヒトにQIHを誘導する手法が開発できれば、将来的には循環停止を伴う心血管手術において、低体温で循環停止させることなく、十分な腎臓保護を実現するための有望なアプローチとなる可能性があります。
補足説明
1.臨床橋渡しプログラム
理研生命機能科学研究センター独自の研究プログラム。臨床医としての知識・経験を有する研究リーダーが、同センターでの最先端研究と臨床現場でのニーズの融合から、疾病の理解や再生医療への実用化を目指す。
2.冬眠、休眠
哺乳類は、代謝制御によって37℃前後の体温を保つ恒常性維持の仕組みを持つが、一部の種は、冬季・飢餓などの危機的状況において自らの代謝を下げ、代謝が正常な状態では組織・臓器の障害が生じるはずの低温にまで体温を低下させることができる。この制御された低代謝を休眠と呼び、24時間以内の休眠を日内休眠、季節性の休眠を冬眠と呼ぶ。
3.超低体温法
1950年代より心臓血管手術において用いられている臓器保護法。人工心肺装置を用いて全身の血液を体外で循環させる(心臓に帰ってくる全ての血液をチューブを通して体外に出して、ポンプと人工肺で圧力と酸素を与えた後にチューブを通して体に戻す)際に、温度調整器で徐々に全身を循環する血液の温度を下げ、最終的に20℃以下にすることで、一定時間の臓器虚血に対する保護効果が得られる。一方、血液の凝固機能や血小板の機能が損なわれ、術後出血や多量輸血のリスクが生じる。
4.循環停止
一般的な心臓血管外科手術では、心臓を停止させて手術操作を行う際も人工心肺装置で全身の血液を循環させるが、胸部大動脈瘤に対する手術などの場合は、手術操作の一部を行う際に、人工心肺も停止させて全身の血流を完全に止める必要がある。この全身に血液が循環されない状態のことを循環停止という。
5.虚血
血栓や出血などにより血液の循環が滞り、臓器への血液供給が途絶える状態。
6.急性腎障害(AKI)
腎臓の機能が数時間から数日で急激に低下し、重篤な腎不全や慢性腎臓病に移行する危険性のある状態。AKIはAcute Kidney Injuryの略。
7.QIH、Q神経
2020年に砂川上級研究員らは、脳(視床下部)の一部に存在する特定の神経細胞(Quiescence-inducing neurons:休眠誘導神経またはQ神経)を刺激することで、環境温度や絶食条件なしでもマウスやラットを24時間以上の休眠状態(冬眠様状態)にできることを報告した。このQ神経を刺激することにより生じる低代謝状態をQIH(Q neuron-induced hypometabolism)と呼ぶ。
8.腎尿細管
腎臓に存在し、糸球体で生成された尿中の水分や電解質など身体に必要な成分を再吸収したり、不要な成分を尿へ排出させたりする器官。
9.亜致死的
直ちに個体を死に至らしめる障害ではないが、回復しないまま蓄積すると致死的になると考えられる状態。
10.AKI診断マーカー、NGAL、シスタチンC
AKI診断マーカーは、AKIの有無や進行度を把握するために用いられる生体指標(バイオマーカー)のこと。現在、尿蛋白や血清クレアチニン(Cr)よりも早期にAKIを診断できるマーカーの探索が進められており、NGAL(neutrophil gelatinase-associated lipocalin)やシスタチンCは臨床応用されている早期AKI診断マーカーの例である。
共同研究グループ
理化学研究所 生命機能科学研究センター
個体パターニング研究チーム
上級研究員 升本 英利(マスモト・ヒデトシ)
(臨床橋渡しプログラム・升本研究室 研究リーダー、京都大学医学部附属病院 心臓血管外科 特定助教)
客員研究員 村田 梢(ムラタ・コズエ)
老化分子生物学研究チーム
上級研究員(研究当時)砂川 玄志郎(スナガワ・ゲンシロウ)
(現 冬眠生物学研究チーム チームリーダー)
京都大学大学院 医学研究科 心臓血管外科
博士課程学生 許 敞一(キョ・ショウイチ)
助教 川東 正英(カワトウ・マサヒデ)
教授 湊谷 謙司(ミナトヤ・ケンジ)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究センタープロジェクト「休眠プロジェクト(研究代表者:砂川玄志郎)」)、日本学術振興会(JSPS)科学研究費助成事業基盤研究(C)「低体温循環停止における「人工冬眠」併用による効率的な臓器保護法の開発(研究代表者:川東正英)」、挑戦的研究(開拓)「冬眠による急性疾患の進行抑制・予後改善への挑戦(研究代表者:砂川玄志郎)」、科学技術振興機構(JST)創発的研究支援事業「休眠が惹起する低代謝適応のメカニズムの解明とヒト組織への実装化(研究代表者:砂川玄志郎)」による支援を受けて行われました。
原論文情報
Shoichi Kyo, Kozue Murata, Masahide Kawatou, Kenji Minatoya, Genshiro A. Sunagawa*, Hidetoshi Masumoto*(*責任著者), “Q neurons-induced hypometabolism ameliorates acute kidney injury in a mouse model mimicking cardiovascular surgery requiring circulatory arrest”, JTCVS Open, 10.1016/j.xjon.2022.11.001
発表者
理化学研究所
生命機能科学研究センター 個体パターニング研究チーム
上級研究員 升本 英利(マスモト・ヒデトシ)
(臨床橋渡しプログラム・升本研究室 研究リーダー、京都大学医学部附属病院 心臓血管外科 特定助教)
老化分子生物学研究チーム
上級研究員(研究当時)砂川 玄志郎(スナガワ・ゲンシロウ)
(現 冬眠生物学研究チーム チームリーダー)
京都大学大学院 医学研究科 心臓血管外科
博士課程学生 許 敞一(キョ・ショウイチ)
報道担当
理化学研究所 広報室 報道担当
京都大学 総務部 広報課 国際広報室