2022-12-09 カリフォルニア大学バークレー校(UCB)
この研究では、SARS-CoV-2の「スパイク」タンパク質の一部が、肺などの臓器内の血管の内側を覆う細胞バリアを損傷し、血管漏出と呼ばれる症状を引き起こすことが明らかにされました。このタンパク質の活性を阻害することで、急性呼吸窮迫症候群(ARDS)の原因となる肺水腫など、COVID-19の致命的な症状の一部を防ぐことができるかもしれません」と述べています。
多くのワクチン懐疑論者が、COVID-19 mRNAワクチンの標的である、SARS-CoV-2スパイクタンパク質の潜在的危険性について恐怖を煽っていますが、研究者達は、スパイクタンパク質が、ウイルス感染がなくても症状を引き起こすことができるという証拠は、彼らの研究が示していないと述べています。むしろ、スパイクタンパク質は、ウイルスや体内の免疫反応と連動して、生命を脅かす症状を引き起こす可能性があることを示唆している。
さらに、ワクチン接種後に体内を循環するスパイクタンパク質の量は、重症のCOVID-19患者で観察され、研究に用いられた量よりもはるかに少ない濃度であることがわかりました。
・スパイクタンパク質が血管漏出の引き金になる仕組み
血管漏出は、血管や毛細血管を覆っている細胞が破壊され、血漿やその他の液体が血液の外に漏れ出すことによって起こる。血管漏れは、重症のCOVID-19で観察される肺や心臓の損傷を引き起こすだけでなく、デング熱による主な死因である低ボレムショックを引き起こす可能性があります。
スパイクタンパク質は、SARS-CoV-2の外表面をコーティングし、ウイルスにノビのある外観を与えています。スパイクタンパク質は、ウイルスが宿主に感染するのを助けるという重要な役割を担っている。スパイクタンパク質は、ヒトやその他の哺乳類細胞のACE2と呼ばれる受容体に結合し、鍵を回すように、ウイルスを細胞内に侵入させ、細胞機能をハイジャックする。SARS-CoV-2ウイルスは、細胞に感染すると、受容体結合ドメイン(RBD)を含むスパイクタンパク質の大部分を排出する。
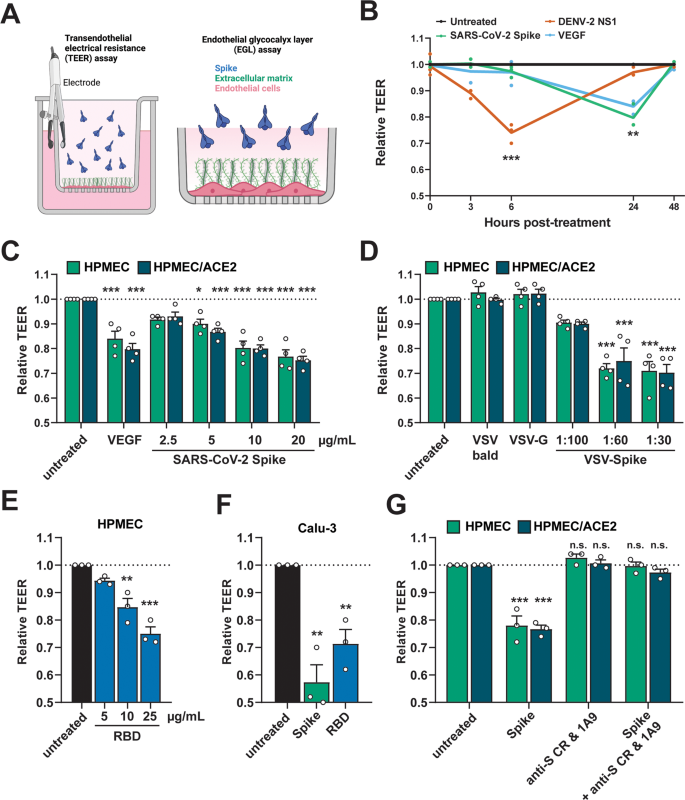
現在、科学者達は、重度のCOVID-19に関連した心臓と肺の損傷を、サイトカインストームと呼ばれる過剰な免疫反応に起因するものと考えています。ビアング教授と他の研究チームは、スパイク蛋白質も関与しているという仮説を検証するために、体内の血管の裏地を模したヒト内皮細胞や上皮細胞の薄層を使った実験を行った。その結果、これらの細胞層をスパイクタンパク質にさらすと、血管漏れの特徴である透過性が高まることが判明した。
研究チームは、CRISPR-Cas9遺伝子編集技術を用いて、この透過性亢進はACE2受容体を発現していない細胞でも起こることを示し、ウイルス感染とは無関係に起こる可能性があることを示した。さらに、マウスはヒトのACE2受容体を発現しておらず、SARS-CoV-2に感染できないにもかかわらず、スパイクタンパク質を投与されたマウスにも血管漏出が起こることを見いだした。
さらに、RNA配列解析の結果、スパイクタンパクは、糖鎖、インテグリン、トランスフォーミング成長因子β(TGF-β)が関与する分子シグナル伝達経路を介して血管漏出を引き起こすことが判明した。そして、インテグリンの活性を阻害することにより、マウスの血管漏出を回復させることに成功した。
インテグリンの活性をブロックすることは、重症のCOVID-19を治療するための有望なターゲットかもしれませんが、ハリスは、病気の進行におけるこの経路の正確な役割を理解するために、より多くの研究が必要だと述べています。血管透過性の増大は感染を促進し、内出血を引き起こす可能性がある一方で、免疫機構が感染細胞へのアクセスをよくすることによって、身体がウイルスを撃退するのを助ける可能性もある。
研究チームは、血管漏れを引き起こす分子メカニズムの研究を続けており、また、ヒトに重篤な疾患を引き起こす他のウイルスに含まれる可能性のあるウイルス毒素の調査も行っています。
<関連情報>
- https://news.berkeley.edu/2022/12/09/how-a-viral-toxin-may-exacerbate-severe-covid-19/
- https://www.nature.com/articles/s41467-022-34910-5
SARS-CoV-2 スパイクはインテグリンとTGF-βシグナルを介してバリア機能障害と血管漏出を誘発する SARS-CoV-2 Spike triggers barrier dysfunction and vascular leak via integrins and TGF-β signaling
Scott B. Biering,Francielle Tramontini Gomes de Sousa,Laurentia V. Tjang,Felix Pahmeier,Chi Zhu,Richard Ruan,Sophie F. Blanc,Trishna S. Patel,Caroline M. Worthington,Dustin R. Glasner,Bryan Castillo-Rojas,Venice Servellita,Nicholas T. N. Lo,Marcus P. Wong,Colin M. Warnes,Daniel R. Sandoval,Thomas Mandel Clausen,Yale A. Santos,Douglas M. Fox,Victoria Ortega,Anders M. Näär,Ralph S. Baric,Sarah A. Stanley,Hector C. Aguilar,Jeffrey D. Esko,Charles Y. Chiu,John E. Pak,P. Robert Beatty & Eva Harris
Nature Communications Published:09 December 2022
DOI:https://doi.org/10.1038/s41467-022-34910-5
Abstract
Severe COVID-19 is associated with epithelial and endothelial barrier dysfunction within the lung as well as in distal organs. While it is appreciated that an exaggerated inflammatory response is associated with barrier dysfunction, the triggers of vascular leak are unclear. Here, we report that cell-intrinsic interactions between the Spike (S) glycoprotein of SARS-CoV-2 and epithelial/endothelial cells are sufficient to induce barrier dysfunction in vitro and vascular leak in vivo, independently of viral replication and the ACE2 receptor. We identify an S-triggered transcriptional response associated with extracellular matrix reorganization and TGF-β signaling. Using genetic knockouts and specific inhibitors, we demonstrate that glycosaminoglycans, integrins, and the TGF-β signaling axis are required for S-mediated barrier dysfunction. Notably, we show that SARS-CoV-2 infection caused leak in vivo, which was reduced by inhibiting integrins. Our findings offer mechanistic insight into SARS-CoV-2-triggered vascular leak, providing a starting point for development of therapies targeting COVID-19.