神経難病ALSの発症機序解明に期待
2019-12-26 分子科学研究所
慶應義塾大学理工学部の古川良明准教授、徳田栄一助教(研究当時。現・日本大学薬学部専任講師)、大学院理工学研究科の安齋樹(2019年博士後期課程修了)らは、慶應義塾大学薬学部の三澤日出巳教授、自然科学研究機構分子科学研究所の秋山修志教授らとの共同研究で、筋萎縮性側索硬化症(ALS)*1)の発症に関わる銅・亜鉛イオン結合タンパク質SOD1*2)について、その立体構造が異常化する新たなメカニズムを提唱しました。SOD1をコードする遺伝子に変異が生じると、異常な立体構造をしたSOD1が運動ニューロンに蓄積し、ALSを発症させることが提案されています。SOD1の構造がどのようなきっかけで異常化するかはまだ明確ではありませんが、酸化されたSOD1から銅・亜鉛イオンが解離すると、毒性を有した異常構造に変化することを見出しました。多くのALS患者では酸化ストレス*3)の増大と金属イオン動態*4)の異常化が報告されていることからも、本研究における提案は、SOD1が関与するALSの発症メカニズムを考える上で重要です。
これらの研究成果は文部科学省科学研究費助成事業 新学術領域研究「生命金属科学」および慶應義塾基軸プロジェクト推進プログラム塾内助成などの支援のもとに得られたもので、国際科学誌Free Radical Biology and Medicineに、2019年12月19日にオンライン版で発表されました。
本研究のポイント
- 筋萎縮性側索硬化症(ALS)の発症に関わるタンパク質SOD1が、毒性を有した異常な立体構造に変化する新たなメカニズムを明らかにしました。
- SOD1は銅イオンと亜鉛イオンを結合して機能する金属酵素ですが、酸化的な修飾を受けたSOD1から金属イオンが解離すると、異常な立体構造に変化することを見出しました。
- 異常な構造を有したSOD1は高い細胞毒性を発揮することから、生体内での酸化ストレスと金属イオン動態がALSの発症機序を理解する上で重要であると考えられます。
研究背景
銅・亜鉛スーパーオキシドディスムターゼ(SOD1)は、銅・亜鉛イオンを結合する金属タンパク質で、反応性の高い活性酸素であるスーパーオキシドを酸素分子と過酸化水素に変換する重要な役割を担っています。神経難病である筋萎縮性側索硬化症(ALS)の患者の一部では、SOD1をコードする遺伝子に変異が認められ、異常な立体構造を持つ(ミスフォールド*5)した)SOD1が脊髄の運動神経に蓄積することが知られています。また、SOD1をコードする遺伝子に変異が認められない原因不明の孤発性ALS患者においても、毒性の高いミスフォールドしたSOD1が脳脊髄液から検出されることを、私たちの研究グループから報告しています。つまり、SOD1の構造異常化(ミスフォールディング)はALSの発症に関与している可能性が考えられますが、その引き金となる要因は明らかとなっていません。
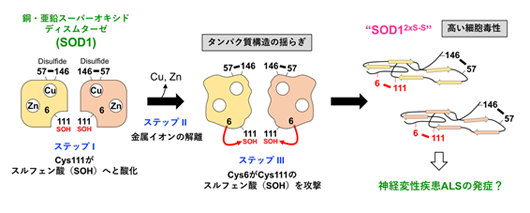
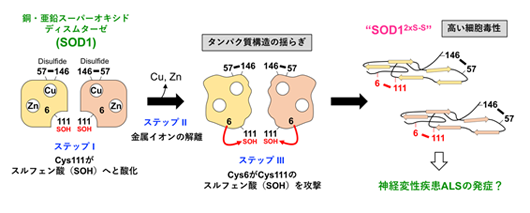
図1 本研究で提案するSOD1の新たなミスフォールディングメカニズム
正常なSOD1は銅イオンと亜鉛イオンを結合し、分子内ジスルフィド(S-S)結合を形成した二量体として存在している(左)。過酸化水素との反応によって、Cys111がスルフェン酸(SOH)に酸化され(ステップI)、銅イオン・亜鉛イオンがさらに解離すると、タンパク質構造の揺らぎが大きくなり(ステップII)、Cys6がCys111のスルフェン酸を攻撃して(ステップIII)、分子内に2つのS-S結合を持った異常なSOD1(SOD12xS-S)が形成する。SOD12xS-Sは高い細胞毒性を発揮することから、神経変性疾患ALSの発症に関与している可能性が考えられる。
研究内容・成果
そこで、ALS患者の脊髄やそれを取り巻く脳脊髄液では、酸化ストレスを示すマーカーの値が非常に高く、様々な生体分子が酸化されやすい状況にあることに着目しました。特に、SOD1が産生する過酸化水素は酸化剤として機能することから、SOD1は酸化されることでミスフォールドするのではないかと考えました。
タンパク質を構成するアミノ酸の中で、システインは最も酸化されやすいことが知られています。SOD1には4つのシステインがありますが、正常なSOD1では、そのうちの2つ(Cys57とCys146)が酸化されて「ジスルフィド(S-S)結合」を形成し、立体構造の安定化に寄与しています。残りの2つのシステイン(Cys6とCys111)は酸化されずに存在するのが普通ですが、SOD1が産生する過酸化水素によって、Cys111はスルフェン酸と呼ばれる状態に酸化されることがわかりました(図1)。さらに、結合していた銅イオン・亜鉛イオンが解離すると、タンパク質構造が大きく揺らぎ、通常は遠く離れた位置にあるCys6がCys111のスルフェン酸を攻撃して、Cys6とCys111の間でS-S結合が形成しました(図1)。つまり、酸化ストレスの増大と銅・亜鉛イオンの解離によって、2つのS-S結合を持った異常なSOD1(SOD12xS-S)が形成することを見出しました。このSOD12xS-Sは、凝集して不溶性の沈殿になりやすく、運動ニューロン様の培養細胞であるNSC-34*6)に添加すると毒性を示すことから、正常なSOD1にはない性質を有することがわかりました。
今後の展開
今回の研究では、酸化ストレスの増大と金属イオンの解離によって、SOD1タンパク質は分子内に新たなS-S結合を形成したSOD12xS-Sへとミスフォールドする新たなメカニズムを提案することができました。SOD12xS-Sは高い細胞毒性を発揮することから、ALSの発症に関与する可能性が考えられますが、ALS患者から実際に検出されるのかを今後さらに検証する必要があります。運動ニューロンの変性に関わるSOD1のミスフォールド構造やその形成メカニズムについて知見を得ることで、ALSの治療・予防薬開発に対して基礎科学的な面からの貢献が期待されます。
原論文情報
タイトル “Oxidative misfolding of Cu/Zn-superoxide dismutase triggered by non-canonical intramolecular disulfide formation”
著者:Itsuki Anzai1, Eiichi Tokuda1, Sumika Handa1, Hidemi Misawa2, Shuji Akiyama3, and Yoshiaki Furukawa1
掲載誌:Free Radical Biology and Medicine
doi: 10.1016/j.freeradbiomed.2019.12.017
1慶應義塾大学理工学部、2慶應義塾大学薬学部、3分子科学研究所
用語説明
*1) 筋萎縮性側索硬化症(ALS)
脳や脊髄の運動ニューロンが選択的に変性する神経変性疾患です。日本国内にはおよそ1万人の患者がいると報告されています。運動ニューロンは手足や舌の動き、ならびに、呼吸運動を司る神経であるため、それらが変性するALSでは、筋力低下や筋萎縮、嚥下障害、呼吸不全といった症状が現れます。発症後3〜5年ほどで呼吸困難となるため、人工呼吸器による補助が必要になります。認可されているALS治療薬はリルゾールとエダラボンという2種類の薬剤しかなく、その効果も限定的であることから、ALSの病理解明と根本的な治療法の早期開発が求められています。
*2) SOD1(銅・亜鉛スーパーオキシドディスムターゼ)
体内に発生する活性酸素の一種であるスーパーオキシドを消去するタンパク質です。SOD1タンパク質をコードするSOD1遺伝子に変異が生じると遺伝性ALSを発症することが1993年に報告されて以来、100種類以上の変異がSOD1遺伝子に確認されています。正常なSOD1タンパク質は非常に安定な構造を保持していますが、変異に伴ってアミノ酸が置換されると、タンパク質の安定性が低下して、異常な構造をとることが知られています。
*3) 酸化ストレス
私たちは呼吸によって酸素分子を体内に取り込んでいますが、その一部は活性酸素と呼ばれる反応性の高い酸素(例えば、過酸化水素やスーパーオキシドなど)に変わり、タンパク質やDNAなどの様々な生体分子を酸化して傷害を加えることが知られています。私たちの体には、活性酸素から身を守る抗酸化機構が備わっていますが、活性酸素の産生と抗酸化機構のバランスが崩れてしまい、活性酸素の産生が過剰となった状態を酸化ストレスと呼びます。
*4) 金属イオン動態
多くのタンパク質は、その生理機能を発揮するためにはSOD1のように金属イオンを結合する必要があります。一方で、金属イオンは活性酸素の発生源になるなどの毒性を発揮することも知られています。つまり、生体や細胞内における金属イオンの種類や濃度は適切に維持される必要があり、金属イオンの取り込み・運搬・活用・排出(金属イオン動態)といった働きが生体・細胞レベルにおいて制御されています。
*5) ミスフォールド
アミノ酸がつながった高分子であるタンパク質は、それぞれに固有の立体構造をとることで機能を発揮します。機能を発揮する構造のことを「天然構造」と呼び、タンパク質が天然構造を形成することを「フォールドする」と言います。一方で、アミノ酸の置換や環境の変化によって、タンパク質は天然構造と異なる立体構造に「ミス」フォールドすることがあります。ALSだけでなく、アルツハイマー病やパーキンソン病といった様々な神経変性疾患において、ミスフォールドしたタンパク質が脳や脊髄に蓄積していることから、神経を変性させる原因物質ではないかと考えられています。
*6) NSC-34
マウスの脊髄から単離した運動ニューロンを神経芽腫細胞と融合させた細胞です。NSC-34は運動ニューロンに近い性質を保ちつつ、神経芽腫細胞の持つ無限増殖能をも備えた、運動ニューロン様の不死化細胞です。NSC-34は運動ニューロンのモデル細胞として世界中で広く使用されています。
・研究内容についてのお問い合わせ先
慶應義塾大学 理工学部 化学科
准教授 古川良明(ふるかわ よしあき)
・本リリースの配信元
慶應義塾広報室
自然科学研究機構 分子科学研究所
研究力強化戦略室 広報担当