2023-03-14 理化学研究所,東京医科歯科大学,国立がん研究センター
理化学研究所(理研)生命機能科学研究センター 分子標的化学研究チームの丹羽 節 副チームリーダー(研究当時、現 客員研究員、東京医科歯科大学 生体材料工学研究所 生命有機化学分野 准教授)、細谷 孝充 チームリーダー(東京医科歯科大学 生体材料工学研究所 生命有機化学分野 教授)、生命機能動態イメージング研究チームの田原 強 研究員(研究当時、現 客員研究員)、崔 翼龍 チームリーダー、国立がん研究センター 研究所 がん幹細胞研究分野の増富 健吉 分野長らの共同研究グループは、これまでに化学合成された医薬品の中で極めて複雑な化学構造を持つ抗がん剤エリブリン[1]に対する陽電子放射核種[2]炭素11(11C)[2]による標識と、体内動態[3]の解析に成功しました。
本研究成果は、がん治療薬の開発推進に寄与するとともに、寿命の短い陽電子放射核種による分子の標識法に新たな戦略を与えるものであり、分子イメージング[3]を駆使した医学・生命科学の発展につながると期待できます。
エリブリンは現在、乳がん及び悪性軟部腫瘍[4]の治療薬として用いられています。また近年行われた医師主導治験[5]では、悪性度の高い脳腫瘍についても有効性が示唆されています。しかし、体内に投与したエリブリンが脳にどの程度集積するかについては、まだよく分かっていません。
今回、共同研究グループは、極めて複雑な化学構造のエリブリンに寿命の短い11Cを導入する手法を確立しました。本手法で標識されたエリブリンを脳腫瘍モデルマウスに投与し、PETイメージング[3]を行ったところ、エリブリンが脳のがん組織に集積する様子を可視化することに成功しました。
本研究は、科学雑誌『Bulletin of the Chemical Society of Japan(BCSJ)』オンライン版(3月14日付:日本時間3月14日)に掲載されました。また、同誌に掲載された論文の中で、その号における最も優れた論文に与えられるBCSJ賞に選出されました。
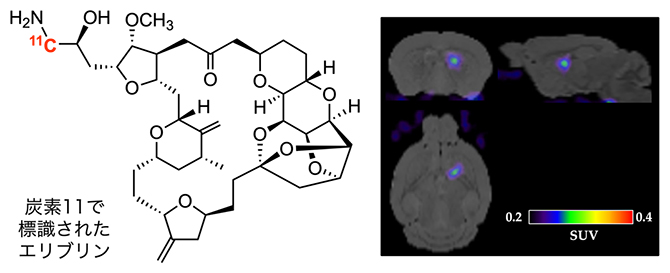
11Cで標識された抗がん剤エリブリンとPETイメージングによるマウス脳腫瘍細胞での局在(画像は掲載論文より。日本化学会の許可を得て転載)
背景
エリブリン(商品名ハラヴェン®)は、エーザイ株式会社とハーバード大学の岸義人教授らの共同研究で創出された乳がんの治療薬です。この分子は、1986年に名古屋大学の平田義正教授と上村大輔博士によって単離されたハリコンドリンB[1]という天然の化合物をもとに開発されました(図1)。それでもエリブリンは19個の不斉炭素[6]を持つ非常に複雑な化学構造を持ち、その合成には60以上の工程が必要です。まさに、これまでに開発された中で極めて化学合成の難易度が高い医薬分子であるといえます。
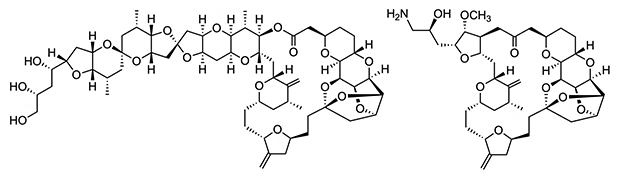
図1 天然物ハリコンドリンB(左)と抗がん剤エリブリン(右)の化学構造
ハリコンドリンBは海綿の一種であるクロイソカイメンに含まれる天然の化合物。乳がんの治療薬エリブリンは、ハリコンドリンBを簡略化して開発された。
近年、エリブリンが、乳がんや悪性軟部腫瘍以外にも、悪性度の高い脳のがん(膠芽腫[7])に有効であることを示唆する結果が報告されました注1)。実際に、マウスを用いた動物実験では、エリブリンを投与することで、脳に移植されたがん組織の縮小が観察されました。また、エリブリンががん組織に特異的に浸透しており、周囲にある正常な脳組織にはほとんど集積しないことも、質量分析イメージング[8]を用いた実験により明らかにされました。さらに、悪性度の高い脳腫瘍の患者にエリブリンを投与する医師主導治験においても、その有効性が示唆されています。
薬剤投与による新たな治療法を確立するためには、ヒトに医薬品を投与した際にどの程度の量が患部に到達するのかを知り、治療時における適切な投与量を検討することが有効です。PETイメージングは、陽電子放射核種を持つ分子(PETプローブ)の集積を定量的に可視化できる、臨床使用可能な分子イメージング技術の一つです。侵襲性が低くヒトにも適用できることから、もしエリブリンを陽電子放射核種で標識できれば、エリブリン投与時のがん組織での濃度を概算できるようになります。
そこで本研究では、極めて複雑な化学構造を持つエリブリンへの、非常に寿命の短い陽電子放射核種である炭素11(11C、半減期:20.4分)の導入に挑戦しました。エリブリンを構成する炭素原子の一つを11Cに置き換えることができれば、エリブリンの化学構造を全く変えることなく、エリブリンをPETプローブ化できるからです。
注1)Masamichi Takahashi et al. Eribulin penetrates brain tumor tissue and prolongs survival of mice harboring intracerebral glioblastoma xenografts. Cancer Sci. 2019, 110, 2247-2257
研究手法と成果
共同研究グループはまず、エリブリンの構造のどこに11Cを導入するかについて検討しました。寿命の短い11Cは合成反応中にも次々と崩壊していくため、合成の最終段階に導入する必要があります。これまでに報告された11C導入法を背景に検討を進めた結果、エリブリンが持つアミノ基(-NH2)の隣の位置への11Cの導入を立案しました(図2)。戦略としては、まず、エリブリンの中心骨格を持つアルデヒド(-CHO)に対し、11Cを持つニトロメタン([11C]CH3NO2)を用いたニトロアルドール反応[9]を起こすことで、ニトロ基(-NO2)と11Cを持つ中間体とを合成します。続いて還元剤を作用させ、ニトロ基をアミノ基に変換し、11Cを持つエリブリンを得ることを考えました。ここで出発原料として用いるアルデヒドも複雑な化学構造を持つ分子ですが、これは元のエリブリンの合成中間体の変換により入手可能でした。
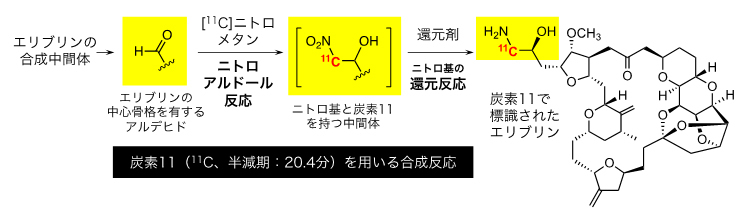
図2 炭素11(11C)で標識されたエリブリンの合成戦略
エリブリンの合成中間体から誘導できるアルデヒドを起点として、11Cを用いた2段階の化学変換により、アミノ基の隣接位に11Cを導入する合成法を立案した。アルデヒドを用いる反応からは寿命の短い11Cを用いるため、最終生成物の精製までの全てを、自動合成装置を用いて迅速に行う必要がある。
この計画に基づき、実際の合成に取り組みました。全ての実験は、11Cから発生する放射線による被曝を防ぐため、鉛でできたホットセル[10]内に設置された自動合成装置[10]を用いて行いました。ニトロアルドール反応、還元反応における試薬や量などの反応条件、さらに標的とする11Cを持つエリブリンを迅速に精製する条件などを詳細に検討しました。最終的に、全ての合成時間を40分以内とし、250メガベクレル[11](MBq、1MBqは100万ベクレル)程度の放射能を持つエリブリンを得る、再現性の高い手法の確立に成功しました(図3)。これは、PETプローブとして用いるために十分な放射能です。
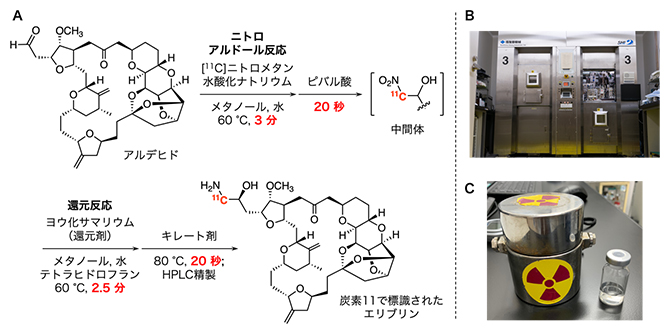
図3 11Cで標識されたエリブリンの化学合成
A)最終的に採用した合成法。各工程にかかる時間を限りなく短縮することで、精製を含む総合成時間を40分以内に抑えることができた。
B)11Cを用いた合成の際に使用するホットセル。鉛の壁で覆われており、11Cから放出される放射線の漏洩をほぼ完全に防ぐ。この中に自動合成装置が設置されている。右側の扉が開いているが、実際の合成時にはこれを閉じ、コンピュータを用いた遠隔操作で合成を行う。
C)合成した11Cを持つエリブリンは生理食塩水の溶液として、写真右側のようなガラス製の滅菌バイアルに回収する。この溶液からも放射線が放出されるため、写真左側の鉛容器に入れて移送する。
次に、11Cで標識したエリブリン(以下、エリブリンPETプローブ)が脳のがんに到達するかどうかを明らかにするため、動物を用いたPETイメージングを行いました。右脳にがん組織を移植した脳腫瘍モデルマウスにエリブリンPETプローブを投与し、PETスキャナーでその局在を観察しました。その結果、エリブリンPETプローブが右脳のがん組織に特異的に集積し、左脳など脳の正常な組織にエリブリンは観察されませんでした(図4)。これは、質量分析イメージングを用いた先行研究の報告と矛盾のない結果です。これらの結果から、今回開発したエリブリンPETプローブが、エリブリンの体内動態の解析に有効であることが示されました。
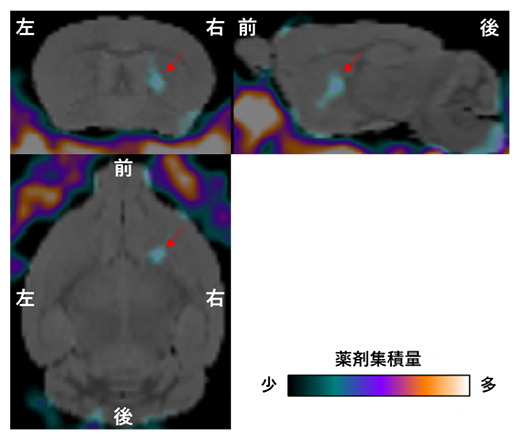
図4 11Cで標識されたエリブリンを用いた脳腫瘍の検出
11Cで標識されたエリブリン(エリブリンPETプローブ)を右脳にがん組織を移植した脳腫瘍モデルマウスの尾静脈より投与し、投与直後から90分間にわたりPETスキャナーを用いて撮像した。これらの画像は、投与後30分から90分までを加算して作成した。赤矢印で示している部位に、がんの一種であるヒト膠芽腫U87細胞を移植しており、その付近に薬剤(エリブリン)の集積が観察できた。カラーバーは薬剤の集積量を示す。
今後の期待
今回共同研究グループは、極めて複雑な化学構造を持つ医薬品であるエリブリンの11Cでの標識法を確立しました。これをPETプローブとして用いるPETイメージング実験により、エリブリンが脳のがん組織に特異的に集積することを明らかにしました。
開発したエリブリンPETプローブは、ヒトへのエリブリン投与時に、適切な投与量を推定することに役立つと期待できます。また、乳がんなどの転移が起こった場合に、その場所を可視化するPETプローブとしての利用も可能です。さらに、脳のがん組織の大きさを推定できることから、今後新たな抗がん剤を開発する際に、その効果の推量にも応用できると期待できます。
エリブリンPETプローブの医療応用への展開に向けた課題は、病院が保有する自動合成装置で今回の合成法を実施できるようにすること、また一度の合成で得られる放射能量をさらに増加させることが求められます。今後、11Cを導入する手法をさらに高度化し、これらの課題を克服することで、新たな医療の提供につながると期待できます。
補足説明
1.エリブリン、ハリコンドリンB
エリブリンは、海綿の一種であるクロイソカイメンに含まれる天然の化合物ハリコンドリンBをもとに開発された抗がん剤。ハリコンドリンBを単離した平田教授と上村博士らは、この化合物が非常に強い抗がん活性を示すことを報告し、その後、アメリカ国立がん研究所で重点的に研究され、その抗がん活性のメカニズムが明らかにされた。分子量1,110を超える巨大かつ極めて複雑な化合物だが、1992年に岸教授らによってその化学合成が達成され、抗がん剤エリブリンの創出につながった。
2.陽電子放射核種、炭素11(11C)
放射性核種の一種で、崩壊の際に陽電子を放出する原子核を陽電子放射核種と呼ぶ。11Cはその一つであり、陽電子を放出して安定なホウ素11(11B)になる。安定同位体である炭素12(12C)の原子核が6個の陽子と6個の中性子から成るのに対し、11Cは6個の陽子と5個の中性子から成る。半減期は20.4分。
3.体内動態、分子イメージング、PETイメージング
薬物などの分子が体内に取り込まれてから排泄されるまでの動きを体内動態と呼ぶ。分子イメージングは、生体内での分子プロセスの可視化や、それによる観察を用いた基礎・臨床研究、手法の開発などを指す。PETイメージングは非侵襲的な分子イメージングの一つで、陽電子放射核種で標識した分子(PETプローブ)を体内に投与し、その集積を3次元画像化し定量する。PETはPositron Emission Tomographyの略。
4.悪性軟部腫瘍
筋肉、脂肪、神経などの軟部組織に発生する悪性度の高い腫瘍。軟部肉腫とも呼ばれる。
5.医師主導治験
ヒトを対象とした試験(臨床試験)の中でも、新薬について国の承認を得るため行われる臨床試験を「治験」と呼ぶ。医師主導治験は、医師自らが企画し、準備・管理を行う治験を指す。
6.不斉炭素
炭素原子の中で、結合している四つの置換基が全て異なるものを指す。これらは鏡に映すと互いに重なり合わない異性体(鏡像異性体)を与える。不斉炭素を含む分子の化学合成は、これらの異性体を作り分ける必要があるため、難易度が高い。なお、エリブリンは19の不斉炭素を持つため、計算上219通り(52万通り以上)の鏡像異性体が存在することになる。
7.膠芽腫
こうがしゅと読む。脳の神経細胞を支える神経膠細胞(グリア細胞)が、がん化することで形成される悪性度の高い脳腫瘍。標準治療は、開頭手術によって腫瘍を切除した後、放射線治療や抗がん剤を用いた化学療法を行うこととされている。
8.質量分析イメージング
生体組織の切片上で質量分析を行うことで、分子の局在を可視化する分析技術の一つ。
9.ニトロアルドール反応
ニトロ基(-NO2)を持つ脂肪族化合物とアルデヒド(-CHO)をつなげる化学反応。報告者の名前を取ってヘンリー反応とも呼ばれる。反応の進行には、一般に塩基性条件を必要とする。
10.ホットセル、自動合成装置
放射線を扱う研究分野では、放射性核種を用いる実験を「ホット」、用いない実験を「コールド」と呼ぶことがある。ホットセルは、放射性核種を用いる合成実験において、放射線が外部に漏れないように設計された部屋(箱)のこと。放射性核種を用いた標識合成実験では、ホットセル内に設置した合成装置をコンピュータでホットセル外から遠隔操作する。合成反応の主要な工程はプログラムにより制御されているため、このシステムを自動合成装置と呼んでいる。
11.ベクレル
ベクレル(Bq)は放射能の強度を表す単位で、単位時間(1秒間)内に崩壊する原子核の数を表す。歴史的には「キュリー」(Ci)がこの目的で使用されてきたが、放射線のSI単位系として、1989年より「ベクレル」(Bq)が適用されている。
共同研究グループ
理化学研究所 生命機能科学研究センター
分子標的化学研究チーム
チームリーダー 細谷 孝充(ホソヤ・タカミツ)
(東京医科歯科大学 生体材料工学研究所 生命有機化学分野 教授)
副チームリーダー(研究当時、現客員研究員)丹羽 節(ニワ タカシ)
(東京医科歯科大学 生体材料工学研究所 生命有機化学分野 准教授)
生体機能動態イメージング研究チーム
チームリーダー 崔 翼龍(サイ・ヨクリュウ)
研究員(研究当時、現 客員研究員)田原 強(タハラ ツヨシ)
(徳島大学 先端研究推進センター バイオイメージング研究部門 准教授)
健康・病態科学研究チーム
チームリーダー 渡辺 恭良(ワタナベ ヤスヨシ)
副チームリーダー 和田 康弘(ワダ ヤスヒロ)
研究員(研究当時、現客員研究員)中岡 貴義(ナカオカ タカヨシ)
テクニカルスタッフⅠ(研究当時)入江 さつき(イリエ サツキ)
(比較コネクトミクス研究チーム テクニカルスタッフⅠ)
専門技術員 林中 恵美(ハヤシナカ エミ)
分子送達・イメージング技術研究チーム
チームリーダー 向井 英史(ムカイ ヒデフミ)
エーザイ・インク
研究員(研究当時)チャールズ・チェイス(Charles E. Chase)
研究員(研究当時)フランシス・ファン(Francis G. Fang)
国立がん研究センター 研究所 がん幹細胞研究分野
分野長 増富 健吉(マストミ ケンキチ)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、日本医療研究開発機構(AMED)次世代がん医療創生研究事業(P-CREATE)「次世代がん医療創生研究における先進技術支援(研究代表者:野田哲生)」、同研究領域B「イメージング活用創薬の視点からの異分野技術融合によるシームレスな薬効評価システムの構築と実施(研究代表者:渡辺恭良)」、同研究領域A「TERT-RdRP阻害剤によるがん治療法の開発(研究代表者:増富健吉)」、同次世代がん研究シーズ戦略的育成プログラム(P-DIRECT)「効率的がん治療薬の薬物動態・DDS開発支援プラットフォーム(研究代表者:向井英史)」、同創薬等ライフサイエンス研究支援基盤事業「ヒット化合物の迅速プローブ化技術の高度化による創薬・生命科学研究支援(研究代表者:細谷孝充)」、同創薬等先端技術支援基盤プラットフォーム(BINDS)「ヒット化合物の迅速高機能化技術の高度化による生命科学・創薬研究支援(研究代表者:細谷孝充)」、RIKEN Pioneering Project “Chemical Probe”による助成を受けて行われました。
原論文情報
Takashi Niwa, Tsuyoshi Tahara, Charles E. Chase, Francis G. Fang, Takayoshi Nakaoka, Satsuki Irie, Emi Hayashinaka, Yasuhiro Wada, Hidefumi Mukai, Kenkichi Masutomi, Yasuyoshi Watanabe, Yilong Cui, Takamitsu Hosoya, “Synthesis of 11C-Radiolabeled Eribulin as a Companion Diagnostics PET Tracer for Brain Glioblastoma”, Bulletin of the Chemical Society of Japan, 10.1246/bcsj.20220335
発表者
理化学研究所
生命機能科学研究センター 分子標的化学研究チーム
チームリーダー 細谷 孝充(ホソヤ・タカミツ)
(東京医科歯科大学 生体材料工学研究所 生命有機化学分野 教授)
副チームリーダー(研究当時、現客員研究員)丹羽 節(ニワ・タカシ)
(東京医科歯科大学 生体材料工学研究所 生命有機化学分野 准教授)
生体機能動態イメージング研究チーム
チームリーダー 崔 翼龍(サイ・ヨクリュウ)
研究員(研究当時、現 客員研究員)田原 強(タハラ・ツヨシ)
国立がん研究センター 研究所 がん幹細胞研究分野
分野長 増富 健吉(マストミ・ケンキチ)
報道担当
理化学研究所 広報室 報道担当
国立がん研究センター 企画戦略局 広報企画室
東京医科歯科大学 総務部 総務秘書課 広報係