2023-03-24 理化学研究所
この動画にはナレーションはありません
理化学研究所(理研)開拓研究本部 萩原生体模倣システム理研白眉研究チームのイサベル・コウ特別研究員、萩原 将也 理研白眉研究チームリーダーの研究チームは、ミニ臓器(オルガノイド)[1]に対し、背腹、尾頭、左右といった体の向き(体軸方向)を与える技術を開発しました。
本研究成果は、オルガノイドをより高次形態に成長させることを可能にし、創薬や再生医療に貢献すると期待できます。
従来、オルガノイドは全方位均一な条件下で培養して作製されることから、球状あるいはランダム方向の分岐を持つものがほとんどであり、体内の形態とはかけ離れているという問題がありました。
今回、研究チームはCUBE型の培養器内でオルガノイドに特定因子の濃度勾配を与える「Gradient-in-CUBEシステム」を開発しました。本システムを用いて、iPS細胞[2]塊から、恣意的な方向に神経外胚葉[3]と中胚葉[4]の分子マーカーが局在するオルガノイドを作製しました。作製したオルガノイドは、与えた濃度勾配の方向を見失うことなく解析が可能であり、オルガノイド培養から体軸方向付与・解析までシームレスな実験ワークフローを確立しました。
本研究は、オンライン科学雑誌『Communications Biology』(3月21日付)に掲載されました。
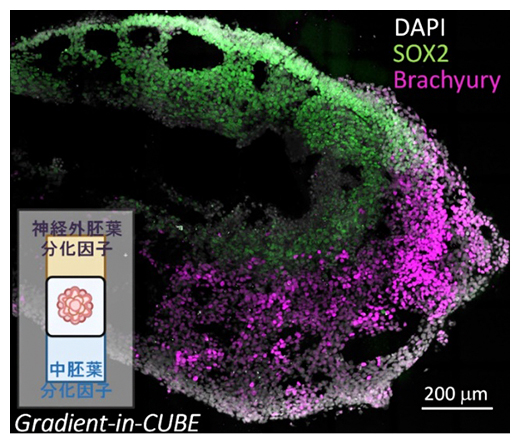
Gradient-in-CUBEシステムによるiPS細胞塊の分化局在誘導
背景
近年、動物実験に対する規制や、医薬品の評価方法の見直しが世界中で進んでいます。そのような中、ヒトの遺伝子を持つ幹細胞からミニ臓器(オルガノイド)を作製し、体外で臓器機能を再構成する技術の開発が進められています。しかし、現行のオルガノイドは、個々に解離されて位置情報を失った細胞の集合体を単一の条件(培地成分、細胞外マトリックス[5]、細胞塊)で培養することで、細胞の自律形成に依存して作られるため、形は球状で、実際の臓器の形態とはかけ離れています。従って、この方法では臓器本来のマクロな構造を作ることは至難であり、病態の再現や移植は細胞レベルが限界だと考えられています。
臓器の発生において、細胞は周囲環境から特定因子の濃度勾配を位置情報として受け取り、背腹、尾頭、左右といった体軸を形成していきます。そのため、因子の濃度勾配を体外での培養実験系に与えることは、オルガノイドを高次形態に成長させるために重要です。
そこで、細胞培養の場をコントロールする技術として、マイクロ流体チップ[6]や3Dバイオプリンター[7]などの工学技術が開発されています。しかし、これらの技術には高い専門性と専用の機器が必要であることが、応用の幅を制限していました。また、培養後には、ミリメートルサイズのオルガノイドを解析に送る過程で、濃度勾配の方向を見失うなどの問題が生じていました。
そこで、本研究では、従来の工学技術のように電源を必要としない、より簡便な方法で、細胞に因子濃度勾配を与えて体軸形成を行い、濃度勾配情報を失うことなく解析可能なオルガノイド作製ワークフローの開発に取り組みました。
研究手法と成果
研究チームはオルガノイドの培養・体軸形成・解析の操作を容易にするために、これまでに独自に開発した「CUBE型培養器注1)」を採用しました(図1)。まず、アクリルまたはポリカーボネート製の立方体フレームに、培地の浸透が必要な面にはアガロース[8]の壁を、それ以外の面にはPDMS(ポリジメチルシロキサン)[9]やアクリルの壁をそれぞれ作ります。その中に、細胞が足場として生存できるよう、マトリゲル[10]やコラーゲンといった細胞外マトリックス(基質)を内包します。アガロースの壁は栄養成分を容易に透過させる一方で、十分な硬さを持つため、培養中のオルガノイドを細胞外マトリックスごとピンセットでつまんで別の容器に移すなどの操作が可能です。

図1 CUBE型培養器の全体像
アクリル・ポリカーボネート製のフレームの周りに、PDMSあるいはアガロースで壁を作り、内側に細胞外マトリックスとオルガノイドを配置。あとで流体チップに統合した際に溶液が漏れないよう、ゴム製のO-ringでシーリングをする。
この操作性の良さを生かして、CUBEをオルガノイドのキャリアとして用います。CUBE内のオルガノイドが成熟した段階で、PDMS製の流体チップの中にオルガノイドをCUBEごと内包し、CUBEを挟んだ対向のチャンバーにそれぞれ成長因子が入った培地を入れると、CUBE内に因子の濃度勾配ができる「Gradient-in-CUBEシステム」を構築しました(図2)。CUBE内の細胞外マトリックスが因子の拡散を抑えるため、各チャンバーに必要な因子を入れるだけで、CUBE内で因子濃度勾配が発生します。CUBEを長時間培地に浸していると濃度勾配は消失しますが、24時間ごとに培地をリン酸緩衝生理食塩水に入れ替えてCUBE内を洗浄すると、数日経っても濃度勾配を保ったまま、流体チップの中でオルガノイドを培養することができます(図2)。

図2 Gradient-in-CUBEシステムによる因子濃度勾配の制御
分子量40,000のデキストラン(多糖類の一種)に蛍光物質のFITCおよびTRITCを付けた物質を、それぞれCUBEを挟んだ対向のチャンバーに入れ、5日間蛍光観察した。CUBE内でそれぞれの因子の安定した濃度勾配が確認された。スケールバーは1㎜。
一方、本手法では、CUBE内のどこにオルガノイドが配置されるかによって因子の濃度が異なるため、再現性の高い実験のためには、常にCUBE内の同じ位置にオルガノイドを配置することが必要不可欠です。そこで、CUBE内に細胞外マトリックスを入れる前に、3Dプリンターで作製した突起の付いたキャップをCUBEの上面に配置し、細胞外マトリックスが固まった後にそのキャップを外すことで、突起と同じ長さの空隙を作りました。この空隙にオルガノイドを入れると、常にCUBE内の同じ位置にオルガノイドを配置でき(図3)、CUBE内で細胞が受け取る因子の濃度のばらつきが抑えられました。
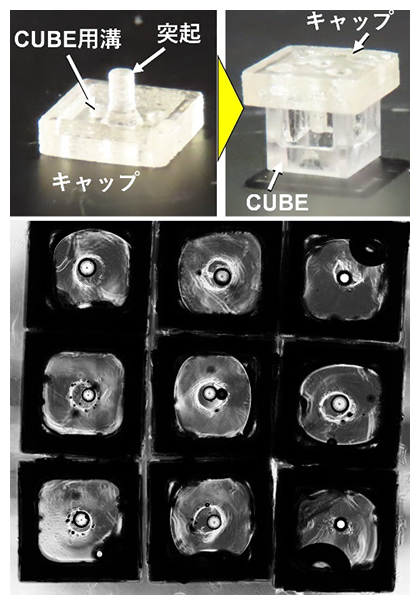
図3 CUBE内でのオルガノドの位置制御
上:3Dプリンターで作製した突起のついたキャップをCUBE上面に配置し、中の細胞外マトリックスが固まった後にキャップを引き抜くと、設計位置に空隙を作製できる。その空隙にオルガノイドを落とし込むことで、CUBE内の特定の位置に正確にオルガノイドを配置できる。
下:1㎜のポリスチレンビーズをオルガノイドに見立てて配置した例。すべてのビーズがCUBEの中心に配置された。
因子濃度勾配を与えて、体軸形成を行ったオルガノイドの解析には、イメージングやRNA-seq[11]が一般的に行われます。オルガノイドのようなサイズの大きなサンプルは、凍結切片やパラフィン切片を作製し、薄膜にすることが多いですが、この際にオルガノイドが回転して空間情報が失われてしまっては、解析結果の妥当性に疑いが生じます。そこで、切片を作製する際に、サンプルを刃でCUBEのフレームごと切ることで、切られたフレーム位置を勾配を与えた方向のマーカーとして、方向性を見失うことなく解析できるようにしました。
以上の通り、CUBEをオルガノイドのキャリアとして用いることで、凝集塊の培養から、体軸付与、切片作製、解析とシームレスなワークフローを達成することができました。実際に、数日間培養したiPS細胞塊をCUBE中心に入れ、神経外胚葉と中胚葉の分化因子を流体チップ内のそれぞれのチャンバーに滴下して5日間培養し、切片作製後にイメージングした結果、一つの細胞塊に神経外胚葉、中胚葉それぞれの分化マーカーであるBrachyuryおよびSOX2がはっきりと局在していることが分かりました(図4)。

図4 CUBEを用いたオルガノイド培養・体軸付与・切片作製・解析のワークフロー
CUBE内にオルガノイドを配置し、成熟するまでCUBEごとウェルプレートに入れて培養(左)。オルガノイドがある程度成熟してから、CUBEごと流体チップに入れ、それぞれ異なる因子を含む培地をチャンバーに滴下することで、オルガノイドに対して異なる栄養成分の濃度勾配を付与(左から2番目)。培養が完了したら、流体チップからオルガノイドをCUBEごと取り出し、フレームごと切片を作製することで、濃度勾配方向を見失うことなく切片を作製できる(左から3番目)。その切片をRNA-seqイメージングすることで、空間情報を維持したまま解析できる(右)。
注1)Hagiwara, M., Kawahara, T. and Nobata, R. (2016), Tissue in Cube: In Vitro 3D Culturing Platform with Hybrid Gel Cubes for Multidirectional Observations. Adv. Healthcare Mater., 5: 1566-1571.
今後の期待
今回開発したGradient-in-CUBEシステムは、オルガノイドに体軸方向を付与し、より高次な臓器へ成長させるための基盤技術になることが期待できます。また、CUBEを用いた実験から解析までのワークフローによって、従来より簡便な方法で、オルガノイドに対して体軸形成に必要な位置情報を与えて解析できるため、オルガノイド培養の新たなプラットフォームとして幅広い応用が期待できます。
因子濃度勾配以外にも、細胞に位置情報を与える要因には細胞外マトリックスの局在や細胞集団の形状などがありますが、研究チームの別の研究によって、これらの要因を再現する技術は既に達成済みです注2)。今回の技術を加えることで、細胞から臓器への形作りをより自在に設計できるようになり、生体内システムをより高度に生体外で表現できるようになると期待できます。現在、本技術を含めたCUBEプラットフォームによる生体模倣システムの事業化に向けて開発を進めています。
注1)2023年1月31日プレスリリース「培養ゲルを適材適所に」
補足説明
1.ミニ臓器(オルガノイド)
人工的に作られる、生体内の組織または臓器に似た細胞組織体。
2.iPS細胞
ヒトを含む哺乳類の体細胞にごく少数の因子を導入し、培養すると、その細胞はさまざまな組織や臓器の細胞に分化する能力とほぼ無限に増殖する能力を持つ多能性幹細胞に変化する。この細胞をiPS細胞(induced pluripotent stem cells:人工多能性幹細胞)と呼ぶ。
3.神経外胚葉
初期の胚の一部である外胚葉の中でも、神経系に分化する細胞群。中枢神経系および抹消神経系の神経細胞やグリア細胞に分化していく。
4.中胚葉
初期胚を構成する三つの胚葉の一つ。心臓や血管、軟骨などに分化していく。
5.細胞外マトリックス
コラーゲンなど細胞の外側に存在し、3次元的に細胞が存在するための足場となる物質。細胞に直接働き掛ける役割もある。
6.マイクロ流体チップ
半導体製造技術を用いて、微細な流路を樹脂やガラスなどの基盤に成型することで、液体もしくは液体中を流れる微粒子などの分離、濃縮、反応、解析といった操作をマイクロスケールで行うための小型集積装置。
7.3Dバイオプリンター
ゲルや細胞をノズルから打ち出し、一般的な3Dプリンターのように立体構造を作製するプリンター。
8.アガロース
海藻から得られる寒天をさらに精製し、品質を高めたもの。透明性が高く、さまざまなバイオ実験に用いられる。加熱すると溶解し、冷却するとゲル化する。
9.PDMS(ポリジメチルシロキサン)
シリコン系の熱硬化性樹脂。
10.マトリゲル
Corning社が開発した細胞外マトリックスの一種。
11.RNA-seq
次世代シークエンサーを用いて、RNAの配列断片データを網羅的に取得する方法。
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業基盤研究(B)「三次元培養環境場の計測・制御プラットフォームによる組織形成ダイナミクス解析(研究代表者:萩原将也)」、同若手研究「モジュール化オルガノイドの血管形成制御による多臓器相互作用モデルの構築(研究代表者:Koh Isabel)」による助成を受けて行われました。
原論文情報
Isabel Koh, Masaya Hagiwara, “Gradient to Sectioning CUBE Workflow for the Generation and Imaging of Organoids with Localized Differentiation”, Communications Biology, 10.1038/s42003-023-04694-5
発表者
理化学研究所
開拓研究本部 萩原生体模倣システム理研白眉研究チーム
特別研究員 イサベル・コウ(Isabel Koh)
理研白眉研究チームリーダー 萩原 将也(ハギワラ・マサヤ)
報道担当
理化学研究所 広報室 報道担当