2024-01-12 東京農工大学
国立大学法人東京農工大学大学院工学研究院先端機械システム工学部門の木村笑講師、公益財団法人がん研究会がん研究所細胞老化研究部の田中陽子博士、国立大学法人九州大学大学院工学研究院機械工学部門の山西陽子教授、公益財団法人がん研究会がん研究所細胞老化研究部の高橋暁子部長、国立大学法人九州大学大学院工学研究院機械工学部門の佐久間臣耶准教授のグループは、マイクロ流体チップ(注1)を用いて、細胞外小胞(注2)と類似した脂質ナノ粒子(注3)を、サイズ・流動性・かたさ、といった物理特性を制御して作り分ける手法を構築し、脂質ナノ粒子の物理特性が、臓器選択的な粒子輸送と、臓器に存在するマクロファージ(注4)の1細胞ごとの粒子取り込み量へ影響を与えることを見出しました。本研究成果は、新たなナノ医薬品設計への貢献や、細胞外小胞が介在する複雑な生物学的機能の解明につながり得る基礎的知見の創出において貢献すると期待されます。
本研究成果は、American Chemical Societyが発行するACS Nano(1月2日付)に掲載されました。
論文タイトル:Nanoparticles based on natural-lipids reveal extent of impacts of designed physical characteristics on biological functions
URL:https://pubs.acs.org/doi/full/10.1021/acsnano.3c07461
背景
近年、直径が200ナノメールよりも小さな脂質ナノ粒子が、私たちの日常生活において身近な存在になりつつあります。例えば、遺伝子治療薬やワクチンなどの「人工の脂質ナノ粒子」が医薬品として用いられていたり、私たちの体内では常時、細胞が細胞外小胞と呼ばれる「天然の脂質ナノ粒子」を分泌していたりします。近年のナノ粒子に関するさまざまな研究報告から、ナノ粒子の、大きさ、表面の流動性、かたさ等の物理特性が、細胞が内部へナノ粒子を取り込む過程において重要な輸送制御因子であることが分かってきています。そのため、人工および、天然の脂質ナノ粒子の物理特性の生物学的機能への影響に関する知見は、次世代のナノメートルサイズの医薬品開発や、未解明の複雑な生体内機能解明に繋がり得る鍵として注目されています。
天然の脂質ナノ粒子である細胞外小胞は、天然の脂質分子を主成分とした粒子膜をもち、核酸分子などを内包した粒子構造をしています。細胞外小胞は、細胞間のコミュニケーションやがんの転移など、複雑な生物学的機能を解明するための鍵となり得るナノメートルサイズの情報媒体として、生物学や医薬学等の分野で研究されています。従来、細胞外小胞は、細胞の培養液から超遠心法などによって回収して使用していました。しかし、細胞の長期的な培養に伴う分泌挙動の変化や、回収工程の違い、大量生産の難しさなどから、安定的に均質な細胞外小胞を回収し続けることは大きな課題となっています。
このような課題に対し、マイクロ流体チップを用いて作製する、人工の脂質ナノ粒子の幅広いデザイン性と均質性が注目されています。これまでに、さまざまなマイクロ流体チップを用いた脂質ナノ粒子の作製とその物理特性制御に関する研究が行われていますが、細胞外小胞と同様に粒子内部に核酸分子を含む脂質ナノ粒子を作製するためには、人工合成した特殊な脂質分子を用いる必要がありました。そのため、細胞外小胞のように、天然の脂質分子だけを用いて粒子内部に核酸分子を含む脂質ナノ粒子を、物理特性を制御して作り分けることは困難でした。
そこで本研究では、マイクロフルイディクスを駆使することで、細胞外小胞と同様の天然脂質で構成された粒子膜をもち、内部に核酸分子を含んだ脂質ナノ粒子(N-LNP)を作り分ける手法を構築し、あらかじめ設計したN-LNPの物理特性が「どのくらい、どのように、生体内における粒子の輸送動態へ影響を与えているのか?」を明らかにしました。
研究体制
本研究は、東京農工大学大学院工学研究院先端機械システム工学部門の木村笑講師、公益財団法人がん研究会がん研究所細胞老化研究部の田中陽子博士、九州大学大学院工学研究院機械工学部門の山西陽子教授、公益財団法人がん研究会がん研究所細胞老化研究部の高橋暁子部長、九州大学大学院工学研究院機械工学部門の佐久間臣耶准教授らによって実施されました。本研究の一部は、JST【ムーンショット型研究開発事業】【JPMJMS2217-3-2、JPMJMS2217-4-1、JPMJMS2217-5-2】、JSPS科研費研究活動スタート支援(JP21K20504)、基盤(C)(22K07222)、基盤(A)(22H00198)、一般財団法人材料科学技術振興財団研究助成、武田薬品工業株式会社(COCKPI-T® Funding 2021)の助成を受けたものです。
研究成果
本研究で提案する粒子作製手法では、脂質を分散させたエタノール溶液とDNAなどの核酸分子を含む緩衝液を、図1に示すような2種類のマイクロ流体チップへ導入し、導入時の流速と溶液の順番を調節することで、人工合成脂質を用いずに、さまざまな細胞由来の細胞外小胞と類似した脂質ナノ粒子を作り分けることができます。本手法によって、3種類のがん細胞由来の細胞外小胞をモデルに設計、作製した12種類のN-LNP(サイズ:2種類、流動性:3種類、かたさ:2種類)を用い、4種類の培養細胞のN-LNPの細胞内への取り込みにおける、物理特性に対する嗜好性を可視化することに成功しました(図2)。
さらに、N-LNPの物理特性の生体内粒子輸送動態への影響力を明らかにするため、骨肉腫および膵臓がん細胞由来の細胞外小胞をモデルに4種類のN-LNPを作製しました。マウスへ投与後のN-LNPの体内動態を、図3に示すように、「臓器」、「臓器を構成する複数種類の生細胞」、「臓器由来の1種類の細胞(マクロファージ)」と、巨視的な動態から微視的な動態まで段階的に追跡することで、N-LNPのサイズおよび流動性の違いが、臓器選択的な粒子蓄積と、肝臓および脾臓由来マクロファージの1細胞ごとの粒子取り込み量へ影響を与えることを見出しました。本結果は、細胞外小胞が介在するがん転移などにおける臓器選択的な粒子輸送動態において、細胞外小胞表面に存在するさまざまな生体分子だけではなく、より単純に、細胞外小胞の「粒子」としての物理特性も、体内の細胞外小胞の輸送動態を左右する制御因子と成り得ることを示唆しています。
今後の展開
本研究では、これまで制御、作製が困難であった細胞外小胞と類似の物理特性を有する脂質ナノ粒子の作製手法を構築しました。また、作製した粒子を用いることで、これまでベールに包まれていた細胞の脂質ナノ粒子の物理特性に対する嗜好性を明らかにでき、生体内での脂質ナノ粒子輸送動態における物理特性の影響範囲を追跡できることを示しました。今後は、N-LNPによって明らかにした細胞の嗜好性や生体内輸送動態をもとに、細胞ごとに脂質ナノ粒子をテーラーメイド設計、作製、利活用することで新たなナノ医薬品設計への貢献や、複雑な生体内機構の解明につながるような基礎的知見の創出において貢献できると考えています。
用語解説
注1)マイクロ流体チップ
微量な溶液や生体試料の混合、反応、分離、精製、検出などさまざまな操作をマイクロメートルスケールの微小空間で行うことができるような、半導体製造技術を用いて作製したデバイスのこと。
注2)細胞外小胞
細胞が分泌する脂質を主成分とした微粒子のこと。
注3)脂質ナノ粒子
脂質を主成分とするナノメートルスケールの粒子のこと。
注4)マクロファージ
全身に広く存在する免疫細胞の1種。
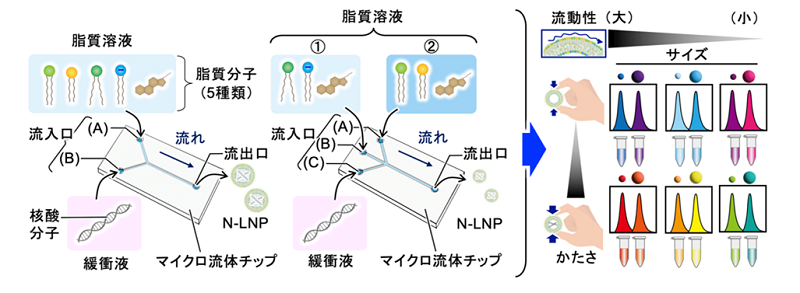 図1:マイクロ流体チップによるN-LNPの作製。流入口の個数が異なるマイクロ流体チップを使い分けることで、12種類の物理特性が異なるN-LNPを作り分けることに成功。
図1:マイクロ流体チップによるN-LNPの作製。流入口の個数が異なるマイクロ流体チップを使い分けることで、12種類の物理特性が異なるN-LNPを作り分けることに成功。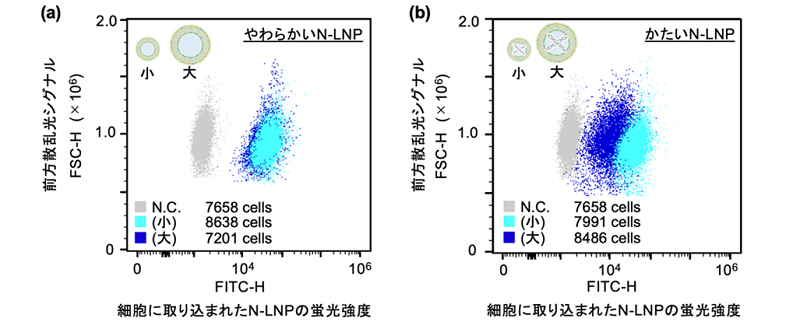 図2:培養細胞(子宮頸がん細胞)のN-LNPの取り込みにおける物理特性の嗜好性の例。やわらかいN-LNPにおいて、細胞はN-LNPのサイズに対する好みの差は確認できなかったが、かたいN-LNPにおいては、小さなN-LNPをより好むという嗜好性を示した。尚、図中の「N.C.」、「(小)」、「(大)」は、それぞれ、「N-LNPを与えていない細胞」、「サイズの小さなN-LNPを与えた細胞」、「サイズの大きなN-LNPを与えた細胞」を意味する。また、グラフ縦軸の「前方散乱シグナル」は、本測定で使用したフローサイトメーターによる測定での、細胞の大きさ指標の一つである。
図2:培養細胞(子宮頸がん細胞)のN-LNPの取り込みにおける物理特性の嗜好性の例。やわらかいN-LNPにおいて、細胞はN-LNPのサイズに対する好みの差は確認できなかったが、かたいN-LNPにおいては、小さなN-LNPをより好むという嗜好性を示した。尚、図中の「N.C.」、「(小)」、「(大)」は、それぞれ、「N-LNPを与えていない細胞」、「サイズの小さなN-LNPを与えた細胞」、「サイズの大きなN-LNPを与えた細胞」を意味する。また、グラフ縦軸の「前方散乱シグナル」は、本測定で使用したフローサイトメーターによる測定での、細胞の大きさ指標の一つである。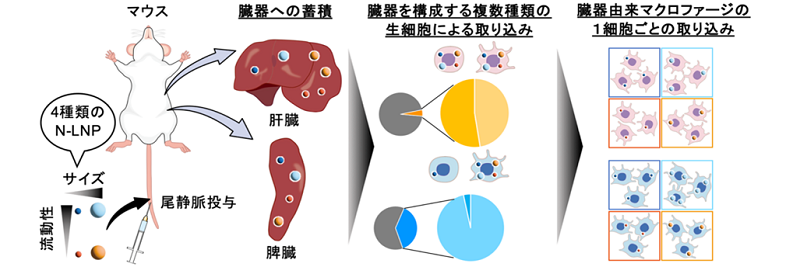 図3:N-LNPの体内動態の巨視的・微視的な段階的追跡。
図3:N-LNPの体内動態の巨視的・微視的な段階的追跡。
◆研究に関する問い合わせ◆
東京農工大学大学院工学研究院
先端機械システム工学部門 講師
木村 笑(きむら にこ)
◆報道に関する問い合わせ◆
東京農工大学 総務課広報室
公益財団法人がん研究会 広報課
九州大学 広報課
プレスリリース(PDF:507.6KB)