2023-03-30 基礎生物学研究所,生命創成探究センター,理化学研究所,富山大学
ストレスの多い状況下でも不快な経験を記憶する能力は、ストレスフルな環境で生きる動物にとって危険回避などの生存戦略に重要だと考えられます。基礎生物学研究所/生命創成探究センターの山下映大学院生(総合研究大学院大学)と椎名伸之准教授の研究グループは、理化学研究所の岩崎信太郎主任研究員と七野悠一研究員、富山大学の高雄啓三教授と藤井一希助教、北海道大学の中川真一教授らの研究グループと共同で、マウスの不快記憶形成をストレス状況下でも可能にするためには、NFAR2タンパク質のプリオン様ドメインが重要であることを明らかにしました。
プリオン様ドメインは、プリオン病の原因タンパク質であるプリオンと似た凝集化しやすい性質を持ち、加齢に伴う様々な神経変性疾患を引き起こすリスクがあります。ヒトでは約240種類のタンパク質に見つかっていますが、リスクを負ったこのドメインをタンパク質の部品として利用することの生物学的意義はほとんど知られていませんでした。研究グループは、ストレス応答性の遺伝子発現調節に関与するNFAR2タンパク質に存在するプリオン様ドメインに注目し、このドメインを欠損したNFAR2を持つマウスを用いて、プリオン様ドメインの有無による影響を調べました。その結果、プリオン様ドメインを欠損したNFAR2を持つマウスでは、脳の扁桃体細胞における遺伝子発現が普段からあたかもストレス下にあるようなパターンを示し、実際のストレス下で起こる正常な遺伝子発現調節ができなくなることがわかりました。さらにこのマウスでは、不快記憶の形成能力が、ストレス負荷により顕著に低下することがわかりました。NFAR2にプリオン様ドメインが挿入されていることにより、ストレス環境への適応機能が付与されたと考えられます。
本研究成果は、国際学術誌「iScience」2023年3月17日号に掲載されました。
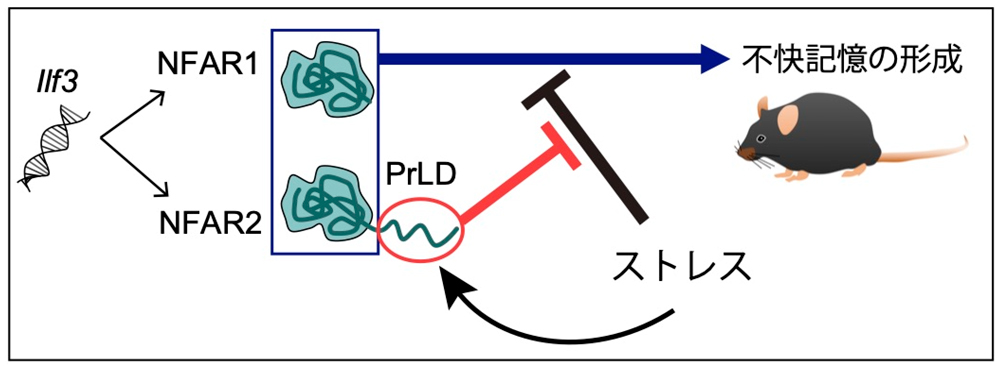 図1 本研究成果のまとめ:NFAR2のプリオン様ドメインはストレスによる不快記憶形成の低下を防ぐ
図1 本研究成果のまとめ:NFAR2のプリオン様ドメインはストレスによる不快記憶形成の低下を防ぐ
Ilf3遺伝子から選択的スプライシングによって、プリオン様ドメイン(PrLD)を持たないNFAR1と持つNFAR2の2種類のタンパク質が合成される。NFAR1とNFAR2はPrLDの有無に関わらず不快記憶の形成に働く。マウスのストレスは不快記憶形成を低下させるが、NFAR2のPrLDがあることでその低下が抑えられる。
【研究の背景】
プリオン様ドメイン(PrLD)は凝集化しやすい性質を持ち、神経変性疾患との関わりが注目されてきました。しかし、そのようなリスクのためだけにこのドメインが多くのタンパク質の部品として使われているのでしょうか。
本研究では、PrLDを持つタンパク質として、ストレス応答性の遺伝子発現調節に関わるタンパク質NFAR2に着目しました。NFAR2はIlf3遺伝子から合成されますが、その遺伝子からは選択的スプライシングによってPrLDを持たないNFAR1と、PrLDを持つNFAR2がつくられます(図1)。NFAR2はDZFファミリータンパク質に属し、その中で200アミノ酸を越えるほどの長いPrLDが付加されているのはNFAR2だけです(図2)。今回、PrLDを欠損したNFAR2を持つ変異マウスを作製し、PrLDが進化の過程でこのタンパク質に挿入されたことの生理的意義を調べました。
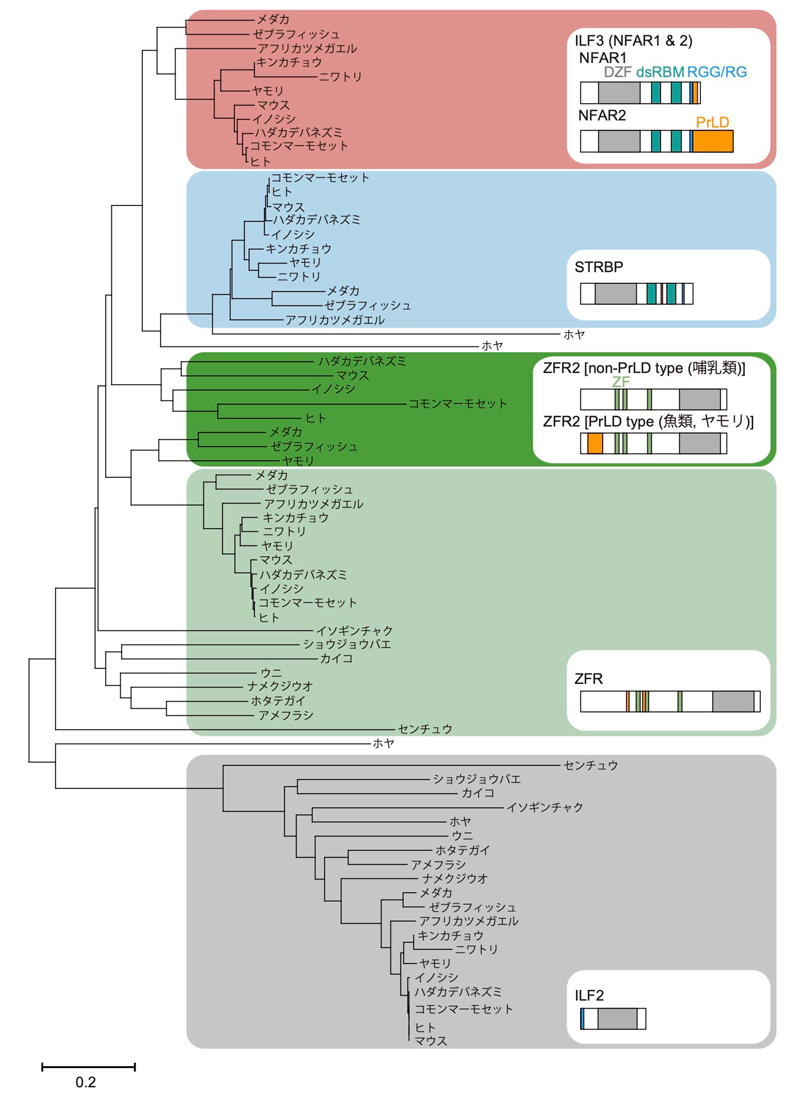 図2:DZFファミリータンパク質の分子系統樹
図2:DZFファミリータンパク質の分子系統樹
DZFファミリータンパク質であるILF3(NFAR1とNFAR2)、STRBP、ZFR2、ZFR、ILF2のドメイン構造を示す。この中で、200アミノ酸を越えるほどの長いPrLD(オレンジ色)を持つのはNFAR2だけである。100-200アミノ酸程度のPrLDは魚類と爬虫類のZFR2にも存在するが、哺乳類ではその領域はPrLDではない。このように、PrLDが種特異的・タンパク質特異的に挿入されている。スケールバーは座位あたりのアミノ酸置換数を示す。
【研究の成果】
NFAR2は脳での発現が高く、ストレス時に重要な働きをすることが先行研究で示されていました。そこで本研究では、脳細胞の酸化ストレスを亢進させるストレスをマウスに負荷しました。そして、ストレスの影響を受けやすい脳の扁桃体に着目しました。
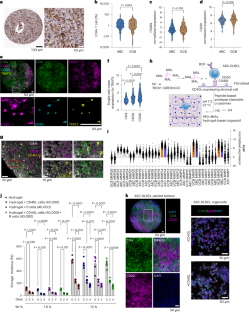
1. NFAR2のPrLDはストレスに応答して扁桃体におけるmRNAの発現・翻訳変化を制御する
正常なマウスでは、ストレスは扁桃体細胞におけるゲノム全体のmRNAの発現と翻訳にストレス応答性の変化をもたらしました。この変化パターンは、PrLD欠損変異マウスがストレスにさらされた場合には、別のパターンに変化することがわかりました(図3)。正常なマウスで見られるストレス応答性のmRNA発現と翻訳の変化パターンは、PrLD欠損変異マウスではストレス負荷のない普段の状態で既に起こっていることがわかりました(図3)。これらの結果から、NFAR2のPrLDを欠損すると、扁桃体細胞において普段からストレスに似た遺伝子発現変化が生じ、さらに実際にストレスにさらされても、それに応じた正常な遺伝子発現調節ができなくなることがわかりました。
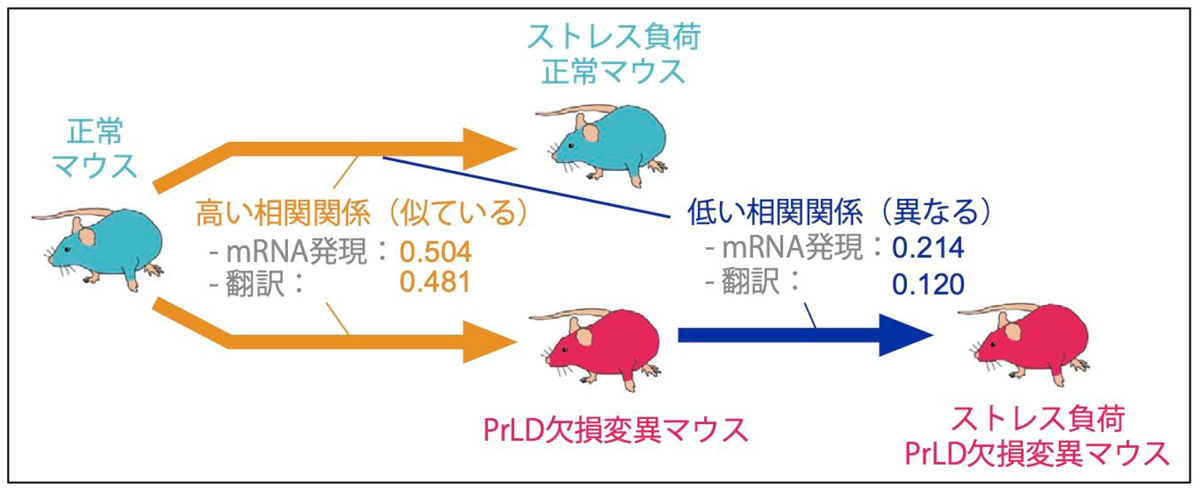 図3:PrLD欠損およびストレスによる遺伝子発現変化の比較
図3:PrLD欠損およびストレスによる遺伝子発現変化の比較
PrLDの欠損およびストレスによって誘発される扁桃体細胞のmRNAの発現・翻訳変化を比較した。図中の数字は、RNA-seqおよびリボソームプロファイリングから得られたmRNA発現変化および翻訳変化を比較することによって得られたピアソン相関係数。
2. NFAR2のPrLDはマウスの不快記憶形成をストレス下でも可能にする
次に、扁桃体が関与する不快記憶を評価するテストを行いました。マウスを明るい部屋と暗い部屋を自由に行き来できる装置に入れ、マウスが暗い部屋にいるときに電流を流して不快な経験を学習させました。正常マウスは学習後に暗い部屋を避けるようになり、その行動は1週間後も維持されます。一方で、変異マウスは徐々に暗い部屋に出入りするようになりました(図4A)。このような不快記憶の低下はNFAR1およびNFAR2の発現レベルが低下したマウス(ヘテロマウス)でも生じましたが(図4B)、PrLD欠損変異マウスに特有の特徴は、不快記憶の形成・保持がストレスによってさらに悪化することでした(図4A)。これらの結果から、NFAR1とNFAR2がPrLDの有無に関係なく不快記憶形成に重要である一方で、ストレス下でも普段と変わらずに不快経験を記憶するためには、NFAR2のPrLDが必要であることがわかりました。なお、扁桃体が関与しない空間記憶を評価するための迷路を用いたテストでは、変異マウスはストレスの有無に関係なく、正常マウスと同様に課題を遂行しました。
今回の研究で得られた結果は、NFAR2のPrLDがストレスの有無に応答した扁桃体における遺伝子発現調節に重要であり、ストレス下でも不快記憶を形成するために必要であることを示しました。
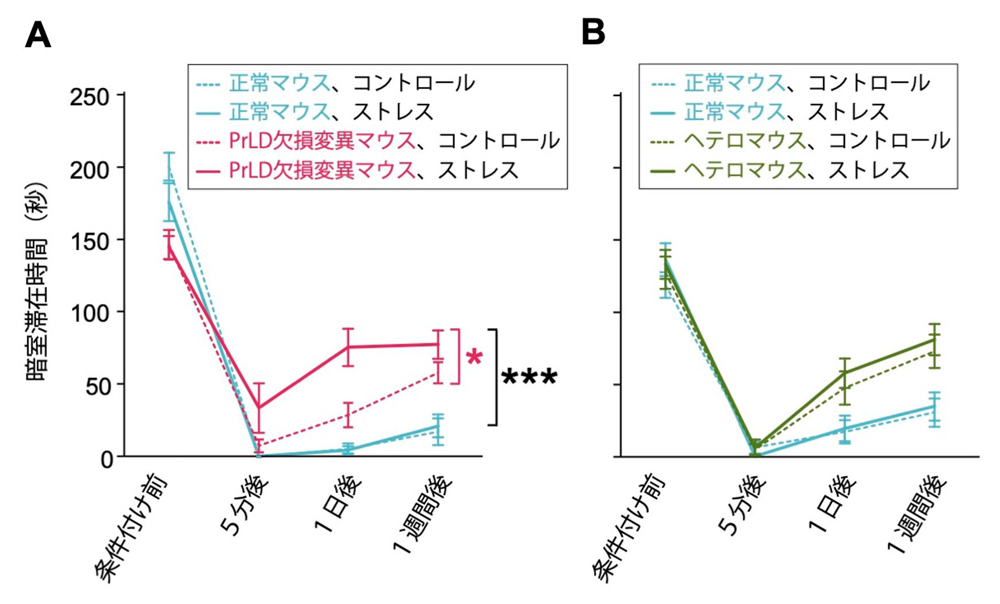 図4:PrLD欠損変異マウスはストレスにより不快記憶の形成と保持がさらに悪化する
図4:PrLD欠損変異マウスはストレスにより不快記憶の形成と保持がさらに悪化する
不快な経験の学習および記憶を評価するテストの結果。条件付け(不快経験)前、5分後、1日後、1週間後におけるマウスの暗室滞在時間を示す。
【本研究の意義と今後の展望】
本研究の結果は、NFAR2にPrLDが挿入されていることによって、ストレス環境に適応するための機能が付与されたことを示唆しています。一般的に、PrLDの有無や長さの違いによって凝集体形成や他分子との相互作用に違いが生じることが知られており、こうした違いがアイソフォーム、オルソログ、パラログなどのタンパク質機能の多様化の基盤になると考えられます。NFAR2の場合、PrLDの有無が核内分子との相互作用の有無を調節し、それが遺伝子発現調節ひいては不快記憶に影響を与える可能性があります。今後、多様性と進化におけるPrLDの長所と短所、およびそれらのトレードオフについての理解が深まることが期待されます。
また、今回の研究により、マウスのストレス状況下での不快記憶形成メカニズムの一端が明らかになりました。ヒトにおいてもストレスや不快記憶は、心的外傷後ストレス障害(PTSD)などに関わる重要な問題です。本研究の知見がそのような問題のメカニズム解明や病態改善に役立つことが期待されます。
【発表雑誌】
雑誌名:iScience
掲載日:2023年3月17日号にて出版(オンライン公開2023年2月19日)
論文タイトル: ILF3 prion-like domain regulates gene expression and fear memory under chronic stress
著者:Akira Yamashita, Yuichi Shichino, Kazuki Fujii, Yumie Koshidaka, Mayumi Adachi, Eri Sasagawa, Mari Mito, Shinichi Nakagawa, Shintaro Iwasaki, Keizo Takao, and Nobuyuki Shiina
DOI:https://doi.org/10.1016/j.isci.2023.106229
【研究グループ】
本研究は、基礎生物学研究所/生命創成探究センターの山下映大学院生と椎名伸之准教授を中心として、理化学研究所の岩崎信太郎主任研究員と七野悠一研究員、富山大学の高雄啓三教授と藤井一希助教、北海道大学の中川真一教授らとの共同研究グループによって実施されました。
【研究サポート】
本研究は、科学研究費助成事業(JP21K15023、JP21H05734、JP19H02959、JP20H05784、19H03161、22H02552、16H06276(AdAMS))、RIKEN Pioneering Projects、日本科学協会笹川科学研究助成、リカケンホールディングス生命科学研究助成、および武田科学振興財団生命科学研究助成による支援を受けて遂行されました。本研究は、自然科学研究機構の動物委員会の承諾のもとに行われました(22A005)。
【本研究に関するお問い合わせ先】
自然科学研究機構 基礎生物学研究所 神経細胞生物学研究室
自然科学研究機構 生命創成探究センター 神経分子動態生物学研究グループ
准教授 椎名伸之
【報道担当】
自然科学研究機構 基礎生物学研究所 広報室
自然科学研究機構 生命創成探究センター 研究戦略室
富山大学 総務部総務課 広報・基金室
理化学研究所 広報室 報道担当