2323-03-20 理化学研究所,愛知県がんセンター,岡山大学 東京大学,微生物化学研究所,国立がん研究センター,佐々木研究所附属杏雲堂病院
理化学研究所(理研)生命医科学研究センター 基盤技術開発研究チームの碓井 喜明 特別研究員、桃沢 幸秀 チームリーダー、愛知県がんセンター研究所 がん予防研究分野の松尾 恵太郎 分野長らの国際共同研究グループは、日本の11,000人以上の胃がん患者群と44,000人以上の非がん対照群を用いた世界最大規模の症例対照研究[1]を行い、胃がんのリスクに関連する遺伝子の存在とその特徴を示し、それらの遺伝子の病的バリアント[2]がヘリコバクターピロリ(ピロリ菌)[3]感染による胃がんのリスクへの影響を増強させていることを明らかにしました。
本研究成果は、胃がんのゲノム医療に貢献すると期待できます。
今回国際共同研究グループは理研で独自に開発したゲノム解析手法を用いて、バイオバンク・ジャパン(BBJ)[4]および愛知県がんセンター病院疫学研究(HERPACC)[5]により収集された胃がん患者群と非がん対照群のDNAについて、27個の遺伝性腫瘍に関連する遺伝子を解析しました。BBJデータの解析により、9個の遺伝子の病的バリアントが胃がんのリスクに関連することが示され、遺伝子ごとの臨床的な特徴が明らかになりました。これらの遺伝子の病的バリアントと、胃がんのリスク因子として知られるピロリ菌感染情報を組み合わせてHERPACCデータを解析した結果、BRCA1・BRCA2遺伝子など相同組換え修復機能[6]に関わる遺伝子群の病的バリアント保持者は、非保持者と比較してピロリ菌感染による胃がんリスクへの影響がより強くなることが明らかになりました。病的バリアント保持者では、ピロリ菌感染の検査や除菌による胃がんのリスクの低減を検討する重要性がより一層高いと考えられます。
本研究は、総合医学雑誌『The New England Journal of Medicine』オンライン版(3月29日付:日本時間3月30日)に掲載されました。
遺伝要因とピロリ菌感染による胃がんリスク
背景
ヘリコバクターピロリ(ピロリ菌)感染は、胃がんのリスク因子として広く知られており、ピロリ菌感染を基盤とする胃がんは東アジアで特に多くなっています注1)。胃がんのリスク因子としては、ピロリ菌感染という環境要因のほかに、遺伝要因も知られています。例えば、CDH1遺伝子の病的バリアント保持者は胃がんのリスクが上昇することから、遺伝カウンセリングや予防的胃切除などの対応が検討されるようになってきています注2)。また、当国際共同研究グループは、乳がんや卵巣がんなどのリスクと関連することが知られているBRCA1・BRCA2遺伝子の病的バリアントが胃がんのリスクと関連することも報告してきました注3)。
しかし、大規模な症例対照研究を通じた解析が不足していたこともあり、多くの遺伝子において、臨床でどのような対応が実際に必要かは明らかになっていません注4)。また、胃がんの発症には遺伝要因と環境要因の双方が影響していますが、病的バリアントと環境要因を大規模に統合した胃がんのリスク評価はこれまで行われてきていませんでした。
そこで本研究では、日本の胃がん患者群と非がん対照群における大規模な検体を使用した症例対照研究を通じて、病的バリアントと胃がんのリスクとの関連や病的バリアント保持者の特徴を明らかにし、ピロリ菌感染と組み合わせた胃がんのリスクを評価しました。
注1)de Martel C. et al. Global burden of cancer attributable to infections in 2018: a worldwide incidence analysis. Lancet Glob Health 2020;8(2):e180-e190.
注2)Blair VR. et al. Hereditary diffuse gastric cancer: updated clinical practice guidelines. Lancet Oncol 2020;21(8):e386-e397.
注3)2022年4月15日プレスリリース「10万人以上を対象としたBRCA1/2遺伝子の14がん種を横断的解析」
注4)National Comprehensive Cancer Network. Gastric Cancer(外部サイト)
研究手法と成果
国際共同研究グループはまず、理研で独自に開発したゲノム解析手法注5)を用いて、バイオバンク・ジャパン(BBJ)により収集された胃がん患者群10,426人、非がん対照群38,153人、愛知県がんセンター病院疫学研究(HERPACC)により収集された胃がん患者群1,433人、非がん対照群5,997人(合計で胃がん患者群11,859人、非がん対照群44,150人)のDNAを解析しました。乳がん、前立腺がん、膵がんなどのリスクに関連する27個の遺伝性腫瘍関連遺伝子を評価した結果、BBJの検体では459個、HERPACCの検体では104個の病的バリアントを同定しました。
BBJの検体から同定された病的バリアントと胃がんのリスクとの関連解析を実施したところ、BRCA1・BRCA2を含む合計9個の遺伝子(APC、ATM、BRCA1、BRCA2、CDH1、MLH1、MSH2、MSH6、PALB2)が胃がんのリスクに関連していました。表1に、胃がん患者における病的バリアント保持者の割合と、病的バリアント保持者の診断時の年齢を、それぞれの遺伝子別に示しました。遺伝性胃がんの原因遺伝子として知られるCDH1(0.06%)と比較して、他の8個の遺伝子は同等かそれ以上の頻度(0.06~1.00%)で病的バリアントの保持者が存在していました。
病的バリアント非保持者の診断年齢の中央値は67.0歳(四分位範囲[7]59.0~73.0歳)であり、6個の遺伝子(ATM、BRCA1、BRCA2、MSH2、MSH6、PALB2)の病的バリアント保持者の診断年齢の中央値は62.0~68.5歳と、非保持者と大きくは変わりませんでした。一方、若くして発症することが知られているCDH1に加えて、APCやMLH1の病的バリアント保持者においては、胃がんの診断年齢の中央値は46.5~55.5歳で、10歳近くもしくは10歳以上若い結果となりました。これらの結果から、9個の遺伝子の病的バリアントは胃がんのリスクに関連し、遺伝子ごとに病的バリアント保持者の割合や診断年齢に違いがあることが明らかになりました。
| 胃がん患者における病的バリアント保持者の割合 | 病的バリアント保持者の診断年齢の中央値 (四分位範囲) |
|||
|---|---|---|---|---|
| APC | 0.06% | 49.0歳(49.0~51.0) | P = 0.003 | |
| ATM | 0.73% | 62.0歳(56.5~71.0) | P = 0.008 | |
| BRCA1 | 0.31% | 65.0歳(54.0~73.0) | P = 0.18 | |
| BRCA2 | 1.00% | 66.0歳(60.0~71.0) | P = 0.53 | |
| CDH1 | 0.06% | 46.5歳(33.0~51.0) | P < 0.001 | |
| MLH1 | 0.13% | 55.5歳(49.0~69.0) | P = 0.02 | |
| MSH2 | 0.11% | 68.5歳(65.0~73.0) | P = 0.42 | |
| MSH6 | 0.18% | 67.0歳(59.0~77.0) | P = 0.47 | |
| PALB2 | 0.15% | 62.0歳(58.0~75.0) | P = 0.75 | |
表1 BBJ胃がん患者の胃がん関連遺伝子別の病的バリアント保持者の割合と診断時の年齢
診断年齢については、胃がん患者群の病的バリアント保持者と病的バリアント非保持者とを比較している非保持者は9個の胃がん関連遺伝子のいずれにも病的バリアントを持っていない人と定義した。非保持者の診断年齢の中央値と四分位範囲は67.0歳(59.0~73.0)。P値は統計学的有意差を示す指標であり、P値が低いほど偶然そのようなことは起こり得ない(ここでは保持者と非保持者との診断年齢には差がある)ことを示す。
がんの診療においてがんの家族歴も大切な情報です。胃がん以外のがんの家族歴と病的バリアント保持に関連があるかを示すため、図1にBBJの胃がん患者の病的バリアント非保持者と病的バリアント保持者における、各がんの家族歴を有する割合を示しました。今回の研究で明らかになった9遺伝子いずれかに病的バリアントを有している人は、胃がん以外にも乳がんや大腸がんといった他のがんの家族歴を多く有している傾向がありました。さらに、遺伝子ごとに注目すると、相同組換え修復機能に関わる遺伝子群(ATM、BRCA1、BRCA2、PALB2)の病的バリアント保持者は乳がんの家族歴を、ミスマッチ修復機能[8]に関わる遺伝子群(MLH1、MSH2、MSH6)の病的バリアント保持者は大腸がんの家族歴を有する割合が高いなど、遺伝子ごとに有している家族歴にも違いがあることが明らかになりました。
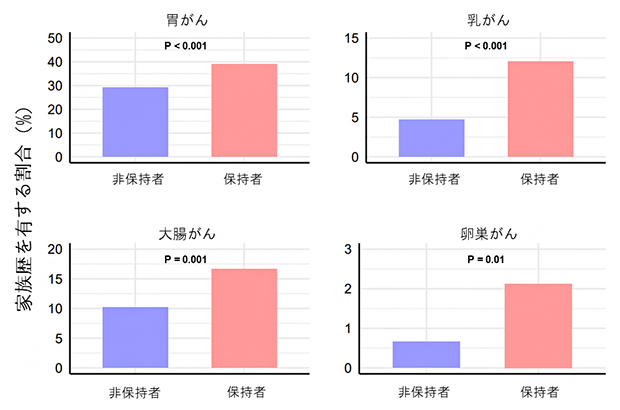
図1 BBJ胃がん患者における各がんの家族歴を有する割合
BBJの胃がん患者における各がんの家族歴を有する割合を示す。9個の胃がん関連遺伝子の病的バリアント保持者と非保持者を比較している(非保持者は9個の胃がん関連遺伝子のいずれにも病的バリアントを有していない人と定義した)。P値は統計学的有意差を示す指標であり、P値が低いほど偶然そのようなことは起こり得ない(ここでは保持者と非保持者との間には家族歴を有する割合に差がある)ことを示す。病的バリアント保持者は、胃がん以外にも乳がんや大腸がんといった他のがんの家族歴を多く有している傾向があることを示している。
これらのことから、病的バリアント保持者の割合、診断年齢、有する家族歴など、遺伝要因を伴っている胃がん患者においても、遺伝子ごとに特徴が異なっているため、遺伝子ごとに病的バリアント保持者に対して考慮する情報を変える必要があると考えられます。
胃がんの発症には遺伝要因とピロリ菌感染の両方が影響するため、実際のリスクを評価するためには両者を組み合わせることが重要です。次に、HERPACCの胃がん患者群と非がん対照群において、BBJの関連解析で明らかになった9個の胃がん関連遺伝子の病的バリアントとピロリ菌感染情報を組み合わせ、胃がんのリスクについて評価しました。その結果、相同組換え修復機能に関わる遺伝子群(ATM、BRCA1、BRCA2、PALB2)の病的バリアントとピロリ菌感染は、胃がんのリスクに対して交互作用[9]を伴っていることが明らかになりました(表2)。病的バリアントとピロリ菌感染の両方が組み合わさった場合には、それぞれ単独でのリスクを足し合わせた場合より胃がんのリスクが高くなることを示しています。ピロリ菌が持つCagAというタンパク質は胃がんの発症母地となる胃の上皮細胞内に注入された後、DNA二本鎖切断や、相同組換えによる精緻なゲノム修復機構の破綻を引き起こし、胃がん発症につながる遺伝子変異の蓄積を誘発することが知られています注6、7)。遺伝要因として相同組換え修復機能に関わる病的バリアントが既に存在する場合、ピロリ菌CagAのゲノム傷害活性がより強くなり、胃がんリスクがより高くなることが本研究結果の背景をなすメカニズムとして推察されます。
| 病的バリアント非保持 | 病的バリアント保持 | |
|---|---|---|
| ピロリ菌陰性 | 1.00:基準 | 1.68 (0.59 – 4.83) |
| ピロリ菌陽性 | 5.76 (4.88 – 6.80) |
22.45 (12.09 – 41.70) |
()内は95%信頼区間
表2 病的バリアントとピロリ菌感染情報を組み合わせて算出した胃がんのオッズ比
相同組換え修復機能に関わる遺伝子群の病的バリアントとピロリ菌感染情報を組み合わせて、HERPACCのデータで算出した胃がんのオッズ比を示す。保持者は4個の相同組換え修復機能に関わる遺伝子群のいずれかに病的バリアントを保持している人、非保持者は9個の胃がん関連遺伝子のいずれにも病的バリアントを有していない人と定義した。オッズ比は、ある事象の起こりやすさについて示す統計学的尺度の一つで、ここでは病的バリアント非保持かつピロリ菌陰性と比較して、それぞれリスクが何倍高まるかを表し、年齢と性別の違いを調整して算出している。病的バリアント保持者のみ、ピロリ菌感染のみの場合と比較して、両者が組み合わさった場合に交互作用により胃がんのリスクがより高くなっている(P=0.02)。相同組換え修復機能に関わる遺伝子群;ATM、BRCA1、BRCA2、PALB2
最後に、HERPACCにおける相同組換え修復機能に関わる遺伝子群の病的バリアントとピロリ菌感染情報を組み合わせて、85歳時点までの胃がんの累積リスク[10]を算出しました(図2)。その結果、ピロリ菌陰性の人は病的バリアントの有無にかかわらず、85歳時点での累積リスクは5%未満と高くはなかった一方、ピロリ菌陽性の人は、病的バリアント非保持者では14.4%、病的バリアント保持者では45.5%と大きな違いを認めました。当国際共同研究グループが過去に報告したBRCA1・BRCA2遺伝子の病的バリアント保持者の85歳時点までの胃がんの累積リスクは20%程度でしたが注3)、今回の研究で、ピロリ菌感染の有無を考慮することでこれらのリスクをより詳細に分けることが可能になりました。相同組換え修復機能に関わる病的バリアント保持者では、ピロリ菌感染の検査や除菌治療を通して、病的バリアント非保持者と比較して胃がんリスクをより顕著に低減できる可能性が示されました。
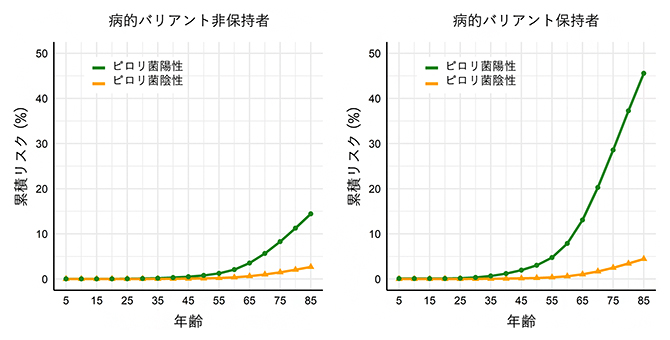
図2 病的バリアントとピロリ菌感染情報を組み合わせた、85歳までの胃がんの累積リスク
HERPACCにおける相同組換え修復機能に関わる遺伝子群の病的バリアントとピロリ菌感染情報を組み合わせて算出した、85歳までの胃がんの累積リスクを示す。保持者は4個の相同組換え修復機能に関わる遺伝子群いずれかに病的バリアントを有している人、非保持者は9個の胃がん関連遺伝子のいずれにも病的バリアントを有していない人と定義した。ピロリ菌陰性の対象者(オレンジ線)は、病的バリアントの有無にかかわらず85歳時点での累積リスクは5%未満と高くなかった一方、ピロリ菌陽性の対象者(緑線)は病的バリアント非保持者においては14.4%、病的バリアント保持者においては45.5%と大きな違いを認めている。相同組換え修復機能に関わる遺伝子群;ATM、BRCA1、BRCA2、PALB2
注5)2016年11月11日プレスリリース「加齢黄斑変性発症に関わる新たな遺伝子型を発見」
注6)2021年5月17日東京大学プレスリリース「ピロリ菌は遺伝性乳癌・卵巣癌と共通の機序で胃癌を引き起こす~細菌癌蛋白質CagAによる癌抑制分子BRCA1の不活性化~(外部サイト)」
注7)Imai S. et al. Helicobacter pylori CagA elicits BRCAness to induce genome instability that may underlie bacterial gastric carcinogenesis. Cell Host Microbe. 2021;29(6):941-958.e10.
今後の期待
本研究では、日本の11,000人以上の胃がん患者群と44,000人以上の非がん対照群を対象とした世界最大規模の症例対照研究を通じて、遺伝要因と環境要因の大規模統合解析を実施しました。今回の研究成果により、胃がんのリスクと関連する遺伝子の存在とその特徴や、それらの遺伝子の病的バリアントが存在するとピロリ菌感染による胃がんのリスクがさらに高まることが明らかになりました。また、相同組換え修復機能に関わる遺伝子群の病的バリアント保持者は、非保持者と比較して、ピロリ菌除菌により胃がんのリスクをより一層低減させることができる可能性が示されました。
本結果は研究対象となった集団に基づく結果のため、ひとりひとりのその他の遺伝要因や環境要因でリスクが異なる可能性があります。また、実際にピロリ菌除菌がどの程度の胃がんの予防効果があるのか、どのタイミングで除菌を行うと良いのかなど、臨床現場に応用するにはさらなる検証が必要です。
今後、本研究の成果は、診断の精度向上、原因遺伝子を標的とした治療法開発、より適切な胃がんの予防対策など、胃がんのゲノム医療の構築に寄与するものと期待できます。
補足説明
1.症例対照研究
疾患に罹患した集団(症例)と罹患していない集団(対照)において、特定の要因について評価し比較することで、特定の要因と疾患との関連を評価する研究手法。
2.病的バリアント
ヒトのDNA配列は約30億の塩基対から構成されるが、その配列の個人間での違い(多様性)を遺伝的バリアントという。また、その遺伝的バリアントのうち疾患に関連しているものを病的バリアントという。
3.ヘリコバクターピロリ(ピロリ菌)
胃炎、消化性潰瘍、胃がんなど多くの疾患のリスク因子として知られている細菌。世界中に多くの感染者がいると推定されている。特に日本など東アジアに蔓延するピロリ菌は病原性・発がん活性がより高いと考えられているCagAサブタイプ(東アジア型CagA)を産生する。
4.バイオバンク・ジャパン(BBJ)
日本人集団約27万人を対象とした、世界最大級の疾患バイオバンク。日本医療研究開発機構のゲノム医療実現バイオバンク利活用プログラム「利活用を目的とした日本疾患バイオバンクの運営・管理」において運営され、DNAサンプルや血清サンプルを臨床情報と共に保管し、研究者へ提供している。2003年から東京大学医科学研究所内に設置されている。
5.愛知県がんセンター病院疫学研究(HERPACC)
愛知県がんセンターにおいて、1988年より実施されている大規模病院疫学研究。愛知県がんセンターの初診患者を対象に詳細な生活習慣に関するアンケート調査と、臨床情報および血液サンプルの収集を行っている。HERPACCはHospital-based Epidemiologic Research Program at Aichi Cancer Centerの略。
6.相同組換え修復機能
DNA二本鎖の双方に起こった切断を修復する機能。
7.四分位範囲
データの分布を示すもので、データを四等分にして、その25%の値から75%の値の範囲を示している。
8.ミスマッチ修復機能
DNA複製などの際に生じた塩基のミスマッチ(誤対合、塩基の誤挿入、欠失など)を修復する機能。
9.交互作用
疾患の要因が複数あるとき、それぞれの要因同士が疾患のリスクを強め合う現象。
10.累積リスク
属する集団がある年齢までにある病気に罹患する確率をいう。日本の年齢階級別の罹患率と年齢階級別の人口割合と今回の解析結果を基に算出している。
国際共同研究グループ
理化学研究所 生命医科学研究センター
基盤技術開発研究チーム
チームリーダー 桃沢 幸秀(モモザワ・ユキヒデ)
特別研究員 碓井 喜明(ウスイ・ヨシアキ)
(愛知県がんセンター研究所 がん情報・対策研究分野 任意研修生、岡山大学 医学部 血液・腫瘍・呼吸器内科学分野 客員研究員)
上級テクニカルスタッフ 岩﨑 雄介(イワサキ・ユウスケ)
テクニカルスタッフⅠ 髙田 定暁(タカタ・サダアキ)
テクニカルスタッフⅡ 碧井 智美(アオイ・トモミ)
テクニカルスタッフⅡ 遠藤 ミキ子(エンドウ・ミキコ)
人材派遣(研究当時)箱崎 希(ハコザキ・ノゾミ)
人材派遣 鈴木 邦彦(スズキ・クニヒコ)
がんゲノム研究チーム
チームリーダー 中川 英刀(ナカガワ・ヒデワキ)
ゲノム解析応用研究チーム
チームリーダー 寺尾 知可史(テラオ・チカシ)
愛知県がんセンター
研究所
がん予防研究分野
分野長 松尾 恵太郎(マツオ・ケイタロウ)
主任研究員 尾瀬 功(オゼ・イサオ)
技師 春日井 由美子(カスガイ・ユミコ)
がん情報・対策研究分野
分野長 伊藤 秀美(イトウ・ヒデミ)
主任研究員 小栁 友理子(コヤナギ・ユリコ)
研究員 谷山 祐香里(タニヤマ・ユカリ)
研究所長 井本 逸勢(イモト・イッセイ)
病院
内視鏡部
部長 田近 正洋(タヂカ・マサヒロ)
医長 田中 努(タナカ・ツトム)
総長 丹羽 康正(ニワ・ヤスマサ)
東京大学 医科学研究所 人癌病因遺伝子分野
教授 村上 善則(ムラカミ・ヨシノリ)
東京大学大学院 新領域創成科学研究科 メディカル情報生命専攻
クリニカルシークエンス分野
教授 松田 浩一(マツダ・コウイチ)
複雑形質ゲノム解析分野
教授 鎌谷 洋一郎(カマタニ・ヨウイチロウ)
微生物化学研究所 第3生物活性研究部
部長 畠山 昌則(ハタケヤマ・マサノリ)
国立がん研究センター中央病院
遺伝子診療部門
部門長 吉田 輝彦(ヨシダ・テルヒコ)
医長 平田 真(ヒラタ・マコト)
(東京大学医科学研究所 人癌病因遺伝子分野 非常勤講師)
佐々木研究所附属杏雲堂病院 遺伝子診療科
科長 菅野 康吉(スガノ・コウキチ)
(国立がん研究センター中央病院 遺伝子診療部門 非常勤医員(研究当時))
QIMRベルクホーファー医学研究所 Division of Genetics and Population Health(オーストラリア)
グループリーダー アマンダ・B・スパードル(Amanda B.Spurdle)
研究支援
本研究は、日本医療研究開発機構(AMED)ゲノム創薬基盤推進研究事業「乳がん・大腸がん・膵がんに対する適切な薬剤投与を可能にする大規模データ基盤の構築(研究開発代表者:桃沢幸秀)」、同革新がん的がん医療実用化研究事業「がんリスクに対する環境要因・遺伝要因の公衆衛生学的インパクトを評価する大規模分子疫学研究(研究開発代表者:松尾恵太郎)」「個人の生活習慣等の環境要因と遺伝的リスクを考慮した科学的根拠に基づく効率的な乳がん予防法の開発研究(研究代表者:松尾恵太郎)」、同ゲノム研究バイオバンク事業「利活用を目的とした日本疾患バイオバンクの運営・管理(研究代表者:山梨裕司)」、日本学術振興会(JSPS)科学研究費助成事業特定領域研究「分子疫学コーホート研究の支援に関する研究(研究代表者:浜島信之)」、同新学術領域研究(研究領域提案型)「がん研究分野の特性等を踏まえた支援活動(領域代表者:今井浩三・中村祐輔)」、同学術変革領域研究(学術研究支援基盤形成)「コホート・生体試料支援プラットフォーム(研究代表者:村上善則・今井浩三)」、同基盤研究(B)「クローン性造血と生活習慣曝露、生活習慣病リスクとの関連を解明する研究(研究代表者:松尾恵太郎)」、厚生労働省第3次対がん10か年総合戦略研究経費「生活習慣改善によるがん予防法の開発に関する研究(研究代表者:津金昌一郎)」、Australian National Health and Medical Research Council(Amanda B. Spurdle)による支援を受けて行われました。
原論文情報
Yoshiaki Usui, Yukari Taniyama, Mikiko Endo, Yuriko N. Koyanagi, Yumiko Kasugai, Isao Oze, Hidemi Ito, Issei Imoto, Tsutomu Tanaka, Masahiro Tajika, Yasumasa Niwa, Yusuke Iwasaki, Tomomi Aoi, Nozomi Hakozaki, Sadaaki Takata, Kunihiko Suzuki, Chikashi Terao, Masanori Hatakeyama, Makoto Hirata, Kokichi Sugano, Teruhiko Yoshida, Yoichiro Kamatani, Hidewaki Nakagawa, Koichi Matsuda, Yoshinori Murakami, Amanda B. Spurdle, *Keitaro Matsuo, *Yukihide Momozawa, “Helicobacter pylori, Homologous-Recombination Genes, and Gastric Cancer”, The New England Journal of Medicine, 10.1056/NEJMoa2211807
発表者
理化学研究所
生命医科学研究センター 基盤技術開発研究チーム
特別研究員 碓井 喜明(ウスイ・ヨシアキ)
(愛知県がんセンター研究所 がん情報・対策研究分野 任意研修生、岡山大学 医学部 血液・腫瘍・呼吸器内科学分野 客員研究員)
チームリーダー 桃沢 幸秀(モモザワ・ユキヒデ)
愛知県がんセンター研究所 がん予防研究分野
分野長 松 尾恵太郎(マツオ・ケイタロウ)
東京大学 医科学研究所 人癌病因遺伝子分野
教授 村上 善則(ムラカミ・ヨシノリ)
東京大学 大学院新領域創成科学研究科 メディカル情報生命専攻
クリニカルシークエンス分野
教授 松田 浩一(マツダ・コウイチ)
微生物化学研究所 第3生物活性研究部
部長 畠山 昌則(ハタケヤマ・マサノリ)
国立がん研究センター中央病院 遺伝子診療部門
部門長 吉田 輝彦(ヨシダ・テルヒコ)
佐々木研究所附属杏雲堂病院 遺伝子診療科
科長 菅野 康吉(スガノ・コウキチ)
報道担当
理化学研究所 広報室 報道担当
愛知県がんセンター 運用部経営戦略課企画・経営グループ
岡山大学 総務・企画部 広報課
東京大学 医科学研究所 国際学術連携室(広報)
東京大学 大学院新領域創成科学研究科 広報室
微生物化学研究所 知的財産情報部
国立がん研究センター 企画戦略局 広報企画室
佐々木研究所 附属佐々木研究所 研究事務室