2018-08-10 慶應義塾大学医学部,日本医療研究開発機構
概要
慶應義塾大学医学部内科学(消化器)教室の佐藤俊朗准教授らの研究グループは、36例のヒト由来胃がん細胞の効率的な体外培養・増殖に成功し、“Wnt”と呼ばれる増殖因子によって多くの胃がんの細胞増殖がコントロールされることを見出しました。さらに、動物実験モデルを用い、Wntを標的とした治療法が胃がんに有効であることを示しました。
多くのがんは、遺伝子変異が原因である細胞増殖異常によって致死的な病となることが分かっています。しかしながら、胃がんの細胞増殖異常につながる遺伝子異常については十分に解明されていませんでした。
本研究グループは、新しい培養技術によって、36人の患者さんの胃がん細胞を体外で培養し、胃がんの細胞増殖異常につながる遺伝子異常の調査をおこないました。胃の正常細胞はWnt とR-spondinと呼ばれる2つの増殖因子が協調して細胞増殖を制御していますが、多くの胃がんはR-spondinがなくても増殖できる能力を獲得していることを発見しました。さらに、研究グループは、こうした胃がんに特徴的な遺伝子変異を特定し、それらの遺伝子変異がヒトの正常胃細胞の増殖異常につながることを実証しました。興味深いことに、多くの胃がんは、その増殖にR-spondinが不要となっても、Wntは依然として必要であることを見出しました。 こうした結果を基に、ヒト由来の胃がん細胞を移植したマウスモデルを用い、Wntを抑制する標的治療薬が胃がんの増殖を著明に抑えることを示しました。
本研究は、胃がんの多くがWntと呼ばれる増殖因子に依存していることを初めて明らかにしており、今後胃がん根治を目指した治療の新しい突破口となることが期待されます。
この研究成果は、2018年8月9日(米国東部時間)に米科学誌『Cell』に掲載されました。
研究の背景
胃がんはアジアで多いがんであり、日本ではがん死亡原因の第3位となっています(2016年、厚生労働省)。現在まで、手術以外の根源的な胃がん治療は確立されておらず、手術治療が不可能となった時点での5年生存率は10%以下に留まっています(2007年‐2009年診断症例、全国がんセンター協議会「全がん協加盟施設の生存率共同調査」)。胃がんは欧米では罹患率が低いため、あまり研究がなされておらず、日本を中心としたアジア諸国が医学研究を主導しています。
体細胞は、その周りに存在する増殖因子というタンパク質の刺激(増殖スイッチ)によって、分裂が調節されています。従って、周囲の環境に十分な増殖因子がなければ、その細胞は分裂ができません。しかし、細胞に特定の遺伝子変異が入ると増殖スイッチが壊れ、周りに増殖因子がなくても勝手に増殖する“がん”特有の状態に陥ることがあります。
これまでの長いがん研究の中で、多くの遺伝子変異と増殖スイッチ異常の関係が明らかにされ、増殖スイッチ異常を標的とする新しい薬剤の開発につながりました。例えば、胃がんの一部の細胞では、HER2と呼ばれる遺伝子が増幅され、周りにEGFという増殖因子の刺激(増殖スイッチ)がなくても勝手に増殖する状態になります。こうしたHER2遺伝子に異常をもつ胃がんには、対応する増殖スイッチをオフにするハーセプチンという薬の治療効果があることが分かり、既に臨床応用されています。
近年の遺伝子変異解析技術の進歩によって多くのがん組織のDNA塩基配列が解析され、このような遺伝子変異と増殖スイッチの関係性が次々と明らかになってきました。一方で、胃がん組織は、がん以外の細胞(間質細胞・免疫細胞・正常胃細胞など)を多く含むため、従来の細胞培養技術を用いた場合、がん細胞のみを対象とした遺伝子変異解析が行えず、遺伝子変異がどのように胃がんの異常細胞増殖につながるかを解明することは困難でした。
今回、研究グループは、先行研究で開発したオルガノイド培養技術(Sato T, et al., Nature 2009, Sato T, et al., Gastroenterology 2011.)(注1)を用い、培養条件の最適化を行うことによって、胃がん組織からがん細胞のみを選択的に採取し培養することに成功しました。このオルガノイドを用いて、胃がん細胞に特化した遺伝子変異解析を行い、胃がんの増殖異常の解明に取り組みました。
研究の成果と意義・今後の展開
本研究では、オルガノイド培養技術をヒト由来の胃がん細胞の体外培養に応用しました。こうして純粋培養された胃がん細胞を用いることで、飛躍的に高い精度で胃がんの遺伝子変異解析ができるようになりました(図1)。
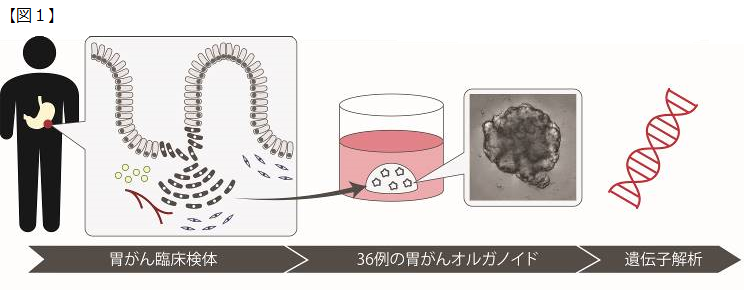
臨床検体は間質細胞や免疫担当細胞が存在しており、詳細な解析が困難であった。オルガノイド培養によって胃がん細胞を純化することで、精度の高い遺伝子解析が可能となった。
これに加え、オルガノイドの生成過程でがん細胞の増殖する様子を詳細に調べ、正常の胃細胞と胃がん細胞の増殖における相違を明らかにしました。
正常の胃細胞の増殖には、EGF、FGF10、Wnt、R-spondinなどの増殖因子が必須であることが知られていますが、胃がん細胞は、特定の増殖因子がなくても分裂ができること、また、HER2異常を有する胃がん細胞は、EGF増殖スイッチが常にオンになっているため、EGFがなくても増殖することを確認しました。さらに、HER2に異常がない胃がん細胞でも、EGFに似た増殖因子を自ら作り出すことで、周囲にEGFがなくても増殖できる胃がんが存在することを発見し、今後のハーセプチン治療の考え方に洞察を与える研究結果を報告しました。
本研究では、従来から注目されてきたEGFとは別の “Wnt”と呼ばれる増殖因子に注目して解析を行いました。 正常の胃細胞はWntシグナルと呼ばれる増殖スイッチがないと増殖することができません。このWntシグナルの活性化には、主役であるWntタンパクとサポーター役であるR-spondinの2つの増殖因子が協調することで、効率的な細胞増殖を導いています。本研究により、胃がんは(1)増殖のためにWntとR-spondinの両方が必要な胃がん、(2)WntもR-spondinもなくても増殖できる胃がん、(3)増殖のためにWntは必要だが、R-spondinが不要となった胃がん、の3種類に分けられることを見出しました。中でも、(3)のサポーター役のR-spondinがなくても増殖スイッチをオンにできる胃がんは、Wntに高い依存性を示し、Wntを標的とした新しい治療法の開発が期待できると考え、本研究の焦点としました(図2)。
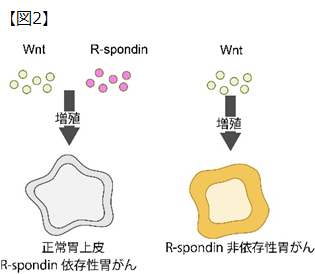
正常の胃細胞は、増殖のためのWntシグナルの活性化に、WntタンパクとR-spondinの2種類の増殖因子が必要である。
一方、R-spondin非依存性胃がんは、Wntタンパクのみで増殖が可能である。
研究グループは(3)のような“R-spondin非依存的増殖”の発症メカニズムを探るため、胃がん細胞の増殖異常パターンと遺伝子異常の関係性を調べました。その結果、R-spondin非依存的増殖を示す胃がんに、RNF43と呼ばれる遺伝子の異常が集積していることがわかりました。RNF43遺伝子変異は動物実験でR-spondin非依存的増殖を引き起こすことが知られており、胃がんでも同様にRNF43遺伝子の異常がR-spondin非依存的増殖の原因であることが裏付けられました。一方、多くのR-spondin非依存性胃がんにはRNF43の異常が見つからず、既知のものとは異なる新規のメカニズムの関与が予想されました。
研究グループは、新しいメカニズムの関与が疑われた胃がんだけが持つ遺伝子変異を探索し、E-カドヘリン遺伝子とp53遺伝子の2つの遺伝子変異が関与することを見出しました。E-カドヘリン遺伝子変異はスキルス胃がんと呼ばれる若年女性にも発症しうる極めて予後の悪い胃がんに特徴的な遺伝子変異として知られています。また、p53遺伝子変異は、あらかじめプログラムされた細胞死(アポトーシス)を抑制する働きをもつことで知られています。しかし、これらの遺伝子変異がR-spondin非依存の増殖制御に関与することは知られていませんでした。こうした関係性を証明するため、研究グループは CRISPR-Cas9(注2)と呼ばれるゲノム編集技術を用い、正常な胃細胞に2つの遺伝子変異を導入することで人工胃がん細胞を作製しました。研究グループの予測通り、この人工胃がん細胞は、“R-spondin非依存的増殖”を獲得し、スキルス胃がんのような組織異常を呈することが分かりました(図3)。
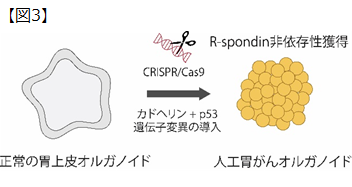
R-spondin非依存性胃がんにおいて見出されたカドヘリンとp53の遺伝子変異を、正常胃細胞に導入した。作製した人工胃がん細胞は“R-spondin非依存的増殖”を獲得した。
研究グループはR-spondin非依存性胃がん細胞を免疫不全マウスに移植することによって、培養されたヒト由来の胃がん細胞が生体内で増殖することを確認し、Wnt-C59(Wntの産生を阻害する目的で使用)により、明らかな増殖の抑制が見られることを示しました。 Wnt-C59のようなWntを標的とした治療薬はすでに多くのがんへの臨床応用段階にあり、本研究成果が胃がん治療の新しい突破口となることが期待されます。
特記事項
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の次世代がん医療創生研究事業「がん多階層フェノタイプの理解に基づいた先端的創薬システムの開発」、老化メカニズムの解明・制御プロジェクト個体・臓器老化研究拠点「消化器組疾患発症制御を目指した加齢形質変化の理解」、JSPS科研費 JP26115007、JP17H06176、JP17K15967の支援によって行われました。
論文
- 英文タイトル:Divergent Routes toward Wnt/R-spondin Niche Independency during Human Gastric Carcinogenesis.
- タイトル和訳:胃がん癌化における多様なWnt/Rspondinニッチ非依存性の獲得
- 著者:南木康作、利光孝太、高野愛、藤井正幸、下川真理子、太田悠木、股野麻未、清野隆史、 錦織伸吾、石川景子、川崎健太、戸ヶ崎和博、高橋シリラット、須河恭敬、石田洋樹、 杉本真也、川久保博文、Jihoon Kim、北川雄光、関根茂樹、Bon-Kyoung Koo、金井隆典、佐藤俊朗
- 掲載誌:Cell
用語解説
- (注1)オルガノイド培養技術:
- 従来の細胞培養技術では、細胞は培養皿上に接着した状態で2次元培養されていた。オルガノイドは、増殖の足場となるジェルの中で必要な細胞増殖因子を培養液中に加えることで3次元構造体として育てられた培養細胞を指し、正常およびがん幹細胞をその組織構造を保った状態で長期間にわたって増殖することが可能である。本研究では、2つの細胞増殖因子であるWntとR-spondinに着目している。これらは同一の増殖シグナル伝達経路に作用し、R-spondinはWntの作用をサポートする役割があると考えられている。
- (注2)CRISPR/Cas9:
- ゲノム編集技術の一つであり、本研究においてゲノム編集のために用いられた。CRISPR/Cas9システムは標的とした遺伝子配列に特異的に結合するRNAとその領域を切断する蛋白質から構成されており、簡便で効率よく細胞の遺伝子改変を行うことが可能である。
お問い合わせ先
本発表資料のお問い合わせ先
慶應義塾大学医学部内科学教室(消化器)
准教授 佐藤 俊朗(さとう としろう)
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構
戦略推進部 がん研究課
基盤研究事業部 研究企画課