2023-05-17 理化学研究所
理化学研究所(理研)脳神経科学研究センター 高次脳機能分子解析チーム(研究当時)の渡我部 昭哉 研究員(現 触知覚生理学研究チーム 研究員)、山森 哲雄 チームリーダー(研究当時、現 触知覚生理学研究チーム 客員主管研究員)、脳画像解析開発ユニットのヘンリック・スキッベ ユニットリーダーらの国際共同研究グループは、「コモンマーモセット[1]」(マーモセット)において、精神・神経疾患と関わりが深い大脳皮質前頭前野[2]が、脳の他の領域とどのようにつながっているかを詳細にマッピングし、神経結合データベースとして公開しました。
本研究成果は、霊長類特有の神経回路構造にヒントを与えるもので、ヒト脳の理解に貢献すると期待できます。本研究成果は、2014年に開始した「革新脳プロジェクト」における代表的な研究成果です。
マーモセットは、ニホンザルなどに比べるとはるかに小型でありながら霊長類特有の脳構造を持ち、神経科学のモデル動物として注目されています。
今回、国際共同研究グループは最新鋭の神経トレーサー[3]技術、イメージング技術を用いたマッピングにより、マーモセットの大脳皮質前頭前野と他の皮質領野との神経結合を高精細に3次元(3D)で再現することに成功しました。解析の結果、この結合がマウスには見られない特徴的な「柱(カラム)型の結合」と「弱い拡散型の結合」の2種類から成り立つことを示しました。今回得られたデータを使えば、さまざまな定量的な解析が可能になり、マーモセットのみならずヒトを含めた霊長類の脳研究が加速すると考えられます。
本研究は、科学雑誌『Neuron』オンライン版(5月16日付:日本時間5月17日)に掲載されました。
背景
現在、日本の精神疾患の患者数は419万人注1)と非常に多く、社会的問題になっています。精神疾患は脳の働きの異常によって起こると考えられ、その治療法開発には脳の構造と機能を知ることが重要です。このような背景から、さまざまな方法で脳の全体像を明らかにしようという脳研究プロジェクト[4]が世界中で始まっています。日本では、「革新的技術による脳機能ネットワークの全容解明プロジェクト(革新脳)」が2014年に発足しました。革新脳プロジェクトの特徴は、小型霊長類マーモセットを研究の主軸としてヒトを含む霊長類脳の理解を深めようという点です。
ヒトの脳は、およそ1,000億個の神経細胞が相互に連結して回路を作る、複雑な計算機と見なせます。脳のどの場所のどの神経細胞同士が連結しているかは、脳の機能と直結しており、古くから盛んに研究されてきました。しかし、脳の複雑な構造を解明するのは容易ではなく、新しい技術が開発されるたびに発見があり、理解が深まってきました。
本研究では、精神・神経疾患と関わりが深いとされる大脳皮質前頭前野に着目し、マーモセットの前頭前野と他領域の結合を最新技術で探索し、今後の脳研究に資する公開データベースを作成することを試みました。
注1)2020年厚生労働省「精神疾患を有する総患者数の推移」(外部サイト)
研究手法と成果
ヒトの脳を理解するにはモデル動物が欠かせません。マーモセットの脳の重さはアカゲザルの約10分の1、ヒトの約170分の1と霊長類としては小型ですが、その大脳皮質は霊長類特有の構造を示します。一方神経科学研究によく用いられるマウス(マーモセットの約30分の1)の大脳皮質前頭前野は、霊長類のものとかなり異なっています。このことから、霊長類脳を理解する上でマーモセットは適切なモデル動物と考えられます。
近年、イメージング技術の進歩やコンピュータの性能向上などに伴い、脳の神経回路の全体像、いわゆる「コネクトーム[5]」を明らかにしようという試みがさまざまなレベルで行われていますが、霊長類では他のモデル動物種(マウスなど)に比べると、顕微鏡レベルのコネクトーム研究は遅れています。
国際共同研究グループは、順行性神経トレーサー[3]をマーモセット大脳皮質前頭前野のさまざまな箇所に注入し、その位置に存在する神経細胞から伸びる神経線維の全体を蛍光標識しました(図1)。
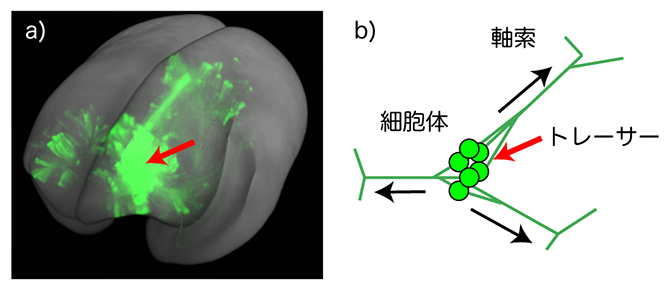
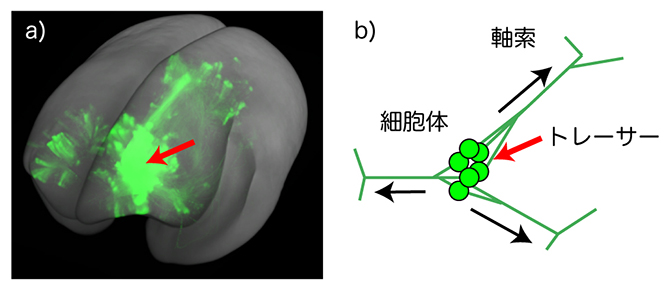
図1 マーモセット大脳皮質前頭前野から伸びる神経軸索の3D画像と順行性神経トレーサー
a)トレーサーを注入した脳の全脳イメージングデータから大脳皮質のトレーサーシグナルを取り出し、3D再構成したもの。赤矢印がトレーサー注入部位。
b)順行性トレーサーは、神経細胞の細胞体から取り込まれ、軸索を通して神経終末まで運ばれ、神経細胞全体を蛍光で標識する。この図は、複数のニューロンから伸びる軸索が束になり、終末で分岐する様子。
次に、2光子連続トモグラフィー(STPT)法[6]を用いた全脳イメージングを行い、前頭前野からの神経連絡マップを作成しました(図2)。この方法では、神経細胞の軸索[7]1本1本を判別できるほどの高い解像度で脳の連続切片を撮像し、イメージプロセシングパイプライン[8]を経て、解析可能なデータに変換します。その結果、脳の3次元(3D)構造を高精度に再現することが可能です。
図2は、前頭前野の8aD野と呼ばれる領域へ順行性神経トレーサーを注入した例です。一見して、特徴的な柱(カラム)状のシグナルの塊が林立していることが分かります。このような「カラム構造」の存在は半世紀前から報告されていましたが、今まで系統だって解析されたことはありませんでした。このカラム構造の定量的な解析は、高精度3Dマッピングによって初めて可能になった成果の一つです。
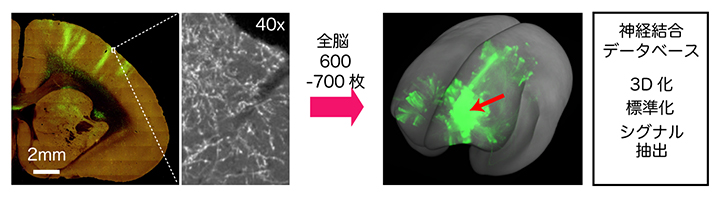
図2 2光子連続トモグラフィー(STPT)法による高解像度3Dイメージング
(左)1回の撮影で約1mm四方の範囲を高解像度(約1.3μm/ピクセル)で撮像できる。ミクロトームで表面を切削後、電動ステージで全切削表面を撮像し、この動作を600~700回繰り返すことで脳全体の画像イメージを取得できる。緑色のカラム構造の断面が見られる。
(右)取得した画像を統合すると、脳全体の3D画像が得られる。個別の脳を標準化し、さらに順行性神経トレーサーのシグナルを背景画像から抽出したものを解析に使う。これらのデータは、公開したデータベースに登録されている。緑色のカラム構造が見られる。赤矢印は神経トレーサーの注入部位。
図3aに示すように、大脳皮質は立体的に湾曲していて、そのままでは解析しにくいため、皮質部分を平面に展開したフラットマップを作成しました(図3b)。この際、大脳皮質の層構造を保ったままで平面化すると、カラム構造がフラットマップに対して垂直になるため解析しやすくなります(図3c)。
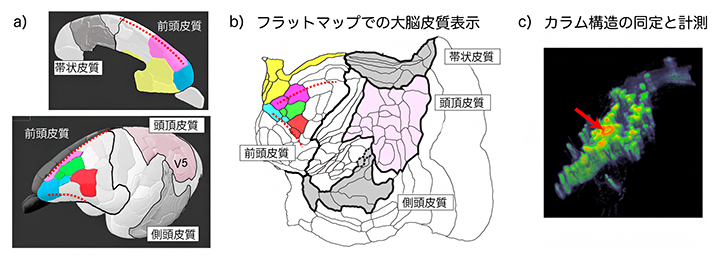
図3 フラットマップによる大脳皮質の解析
a)前頭皮質の一部である大脳皮質前頭前野領域(黄・青・緑・ピンクで塗った領域など)は、少し離れた帯状皮質、頭頂皮質、側頭皮質と連絡する。
b)aの大脳皮質領域をフラットマップに展開した図。
c)フラットマップを立体化したフラットマップスタックにより、図2の神経トレーサー注入部位周辺を表示したもの。フラット化によりカラム(柱)状のシグナルが垂直方向にそろい、解析がしやすくなる。赤矢印は神経トレーサー注入部位。
この手法を使って、カラム状シグナルの分布やその形状を調べ、大脳皮質の三つの領域、すなわち帯状皮質[9]、頭頂皮質[9]、側頭皮質[9]においては、それぞれ前頭前野(前頭皮質[9]の一部)内のトレーサー注入位置に応じた分布を示すことを見いだしました(図4)。このようなカラム状シグナルの分布パターンは、マウスではマーモセットほど明確ではなく、霊長類特有の神経回路構造に寄与していると考えられます。
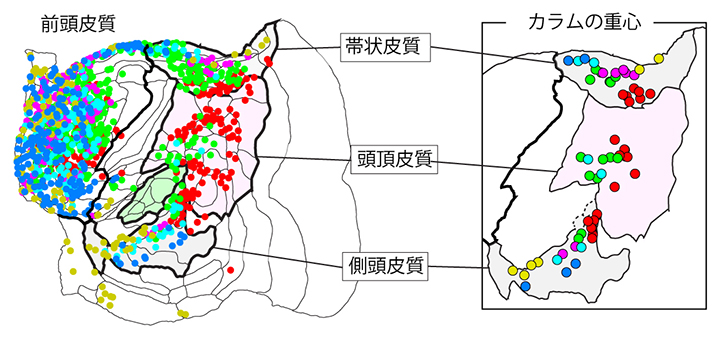
図4 カラム状シグナルの分布
(左)大脳皮質前頭前野(前頭皮質の一部)のさまざまな副領域への注入から生じるカラム状シグナルの分布を示した。一つの注入からは複数のカラム状シグナルが生成する。
(右)注入ごとにカラム状シグナルの重心を示したもの。異なる色は、異なる領域からのシグナルを示す。このシグナルの分布は、大脳皮質前頭前野での位置関係が反映されている。
さらに、カラム状シグナル以外に、強度は弱いながらも広範囲に広がる拡散的シグナルが存在することから、前頭前野から他の大脳皮質領域への神経結合は「カラム型結合」と「拡散型結合」の2種類から構成されていることが明らかになりました。
今後の期待
今回の新しい神経連絡マップの特徴は、全てのデータがデジタル化され定量的な解析が可能なことです。これらのデータを基に、前頭前野と他の脳領域の神経連絡をかなりの高精度で予測できるようになりました。この情報はマーモセットを使った脳研究を加速するだけでなく、マーモセットよりずっと大きい脳を持つマカクザル類や、ヒトの研究にも役立つと期待できます。
近年、磁気共鳴画像(MRI)[10]を用いた基礎研究や臨床診断が進展していますが、MRI画像をより正確に解釈するためには、全脳の神経連絡マップとMRI画像の比較が重要です。現在、国際共同研究グループは全大脳皮質の神経連絡マップの構築を目指して、前頭前野以外の大脳皮質領域の調査を続けており、今後、より包括的な霊長類脳の理解が進むと期待されます。
補足説明
1.コモンマーモセット
南米原産の小型のサル。成体でも体重300~500g程度で、生後1年半から2年で繁殖が可能になる。アカゲザル、カニクイザル、ニホンザルなどのマカクザル類に比べると繁殖力が高く、取り扱いも比較的容易である。遺伝子操作が可能なこと、社会性が高いこと、発達した視覚皮質、前頭前皮質を持つことなどから、神経科学に適したモデル動物として注目されている。
2.大脳皮質前頭前野
大脳皮質は、脳の外側に位置する灰白質の層であり、特に前頭葉は認知機能を担う主要な部位の一つである。その前部に位置する前頭前野は、計画的、社会的な行動や感情の調節などに関わっている。前頭前野の障害は、注意欠陥・多動性障害(ADHD)や、双極性障害、統合失調症、うつ病、強迫性障害など多くの精神疾患の原因になると考えられている。霊長類の前頭前野は、面積が大きいだけでなく、マウスにはない顆粒層を持つ領域が含まれるなどよく発達している。
3.神経トレーサー、順行性神経トレーサー
神経細胞の細胞体は10~100μm程度の大きさしかないが、そこから数mmに及ぶこともある軸索が伸びて、遠隔地に電気インパルスを伝える。この神経連絡経路を可視化する方法として、神経トレーサー技術が開発された。神経トレーサーには、主に順行性と逆行性の2種類がある。順行性トレーサーは、細胞体から取り込まれたアイソトープ(同位体)、蛍光物質などが、軸索を通って遠隔地に輸送されることで、神経連絡を可視化する。一方、逆行性トレーサーは、神経終末から取り込まれた蛍光物質などが細胞体まで逆方向に輸送されることで、神経連絡の起始点を可視化する。本研究では、アデノ随伴ウイルス(AAV)を改変し、高輝度に蛍光標識できるトレーサーを用いた。
4.脳研究プロジェクト
日本の「革新的技術による脳機能ネットワークの全容解明プロジェクト(革新脳); Brain/MINDS Project」以外に、アメリカの「BRAIN Initiative」、ヨーロッパの「Human Brain Project」、中国の「China Brain Project」など、さまざまな目標を掲げた大型の脳プロジェクトが、2013年ごろから世界各国で発足した。
5.コネクトーム
全ての神経細胞の全てのつながり、すなわち神経回路の全体像を意味する。線虫やショウジョウバエでは電子顕微鏡を使ったコネクトーム解析が可能になったが、哺乳類脳で同じレベルの解析をすることはまだ遠い目標である。しかし、核磁気共鳴画像(MRI)や、2光子連続トモグラフィー(STPT)法などの全脳イメージング技術を使って、mmレベル、μmレベルの構成単位同士のつながりの包括的な調査は盛んに行われており、マクロコネクトーム、メゾコネクトームなどと呼ばれている。
6.2光子連続トモグラフィー(STPT)法
2012年にRaganらによって報告された全脳イメージングを可能にする技術。2014年のアレン脳科学研究所によるマウスメゾコネクトームプロジェクトでは、この方法が採用され、マウス全脳データベースが作られた。この方法では、電動ステージと2光子顕微鏡をコンピュータ制御して、部分画像をつなぎ合わせることで切削表面全体の画像を取得し、さらにミクロトームの動作を連動して連続切片撮像を行うことにより、脳全体の撮像を可能にした(図2参照)。STPTはSerial two-photon tomography imagingの略。
7.軸索
神経細胞は、おおまかに樹状突起、細胞体、軸索、神経終末から成り立つ。遺伝情報を収納する細胞核を収めるのが細胞体である。樹状突起は電気信号を受け取るアンテナであり、受け取った信号は細胞体で統合され、さらに次の神経細胞に伝達される。この際、信号(電気インパルス)を伝えるケーブルとして使われる長い突起が軸索である。一つの神経細胞からは一つの軸索が生じるが、この軸索は何本もの側枝を出し、複数箇所に到達する。それぞれの場所の終末(神経終末)でシナプスが作られ、次の神経細胞にシグナルが伝達される。
8.イメージプロセシングパイプライン
2光子連続トモグラフィー法では、1切片あたり数百枚に分割された画像が、切片の数だけ生成される。この生データを利用可能な形に画像処理(イメージプロセシング)する作業工程をパイプラインと呼ぶ。具体的には、分割画像の貼り合わせ(ステッチング)、トレーサーシグナルの識別・分離、注入部位の同定、3次元画像の標準脳への位置合わせなどが含まれる。
9.帯状皮質、頭頂皮質、側頭皮質、前頭皮質
大脳皮質は、視覚野、聴覚野、運動野など、特定の機能を受け持つ多くの皮質領野から成り立つ。そのうち、大脳皮質内の情報統合に特化した領域を連合野と総称する。連合野は、脳の部位に応じて、前頭皮質(前頭葉)の一部である前頭前野、帯状皮質(帯状回)、頭頂皮質(頭頂葉)、側頭皮質(側頭葉)と呼ばれている(図3参照)。
10.磁気共鳴画像(MRI)
高磁場中における水素原子などの核スピンの共鳴現象により、断面撮像を行う装置。生体の内部構造を破壊せずに撮像できるため、病院での画像診断に広く使われるほか、脳研究においても威力を発揮している。特に、拡散強調イメージング(DWI)や機能的MRI(f-MRI)などの応用技術を使えば、脳の神経連絡を推測できる。MRIはMagnetic Resonance Imagingの略。
国際共同研究グループ
理化学研究所 脳神経科学研究センター
高次脳機能分子解析チーム(研究当時)
研究員 渡我部 昭哉(ワタカベ・アキヤ)
(現 触知覚生理学研究チーム 研究員)
研究員 阿部 央(アベ・ヒロシ)
(現 触知覚生理学研究チーム 研究員)
研究員 高司 雅史(タカジ・マサフミ)
(現 触知覚生理学研究チーム 研究員)
テクニカルスタッフ(研究当時)張田 由希(Jian Wang)
チームリーダー(研究当時)山森 哲雄(ヤマモリ・テツオ)
(現 触知覚生理学研究チーム 客員主管研究員)
脳画像解析開発ユニット
ユニットリーダー ヘンリック・スキッべ(Henrik Skibbe)
基礎科学特別研究員 ムハンマド・フェブリアン・ラフマディ(Muhammad Febrian Rachmadi)
コネクトミクス開発ユニット
ユニットリーダー アレクサンダー・ウッドワード(Alexander Woodward)
研究員 ルイ・ゴン(Rui Gong)
自然科学研究機構 生命創生探究センター
特任准教授 中江 健(ナカエ・ケン)
国立精神・神経医療研究センター
部長 一戸 紀孝(イチノヘ・ノリタカ)
自治医科大学 分子病態治療研究センター
教授 水上 浩明(ミズカミ・ヒロアキ)
東京都立大学大学院 人間健康科学研究科
准教授 畑 純一(ハタ・ジュンイチ)
セントルイス・ワシントン大学(米国)医学部
教授 デイビッド・ヴァン・エッセン(David C. Van Essen)
慶應義塾大学 医学部
教授 岡野 栄之(オカノ・ヒデユキ)
京都大学大学院 情報学研究科
教授 石井 信(イシイ・シン)
研究支援
本研究は、日本医療研究開発機構(AMED)「革新的技術による脳機能ネットワークの全容解明プロジェクト(革新脳)」の「マーモセット脳の構造マップ(領域代表者:山森哲雄)」による助成を受けて行われました。
原論文情報
Akiya Watakabe, Henrik Skibbe, Ken Nakae, Hiroshi Abe, Noritaka Ichinohe, Muhammad Febrian Rachmadi, Jian Wang, Masafumi Takaji, Hiroaki Mizukami, Alexander Woodward, Rui Gong, Junichi Hata, David C. Van Essen, Hideyuki Okano, Shin Ishii, Tetsuo Yamamori, “Local and long-distance organization of prefrontal cortex circuits in the marmoset brain”, Neuron, 10.1016/j.neuron.2023.04.028
発表者
理化学研究所
脳神経科学研究センター 高次脳機能分子解析チーム(研究当時)
研究員 渡我部 昭哉(ワタカベ・アキヤ)
(現 触知覚生理学研究チーム 研究員)
チームリーダー(研究当時)山森 哲雄(ヤマモリ・テツオ)
(現 触知覚生理学研究チーム 客員主管研究員)
脳画像解析開発ユニット
ユニットリーダー ヘンリック・スキッべ(Henrik Skibbe)
報道担当
理化学研究所 広報室 報道担当