2023-05-18 ワシントン大学セントルイス校
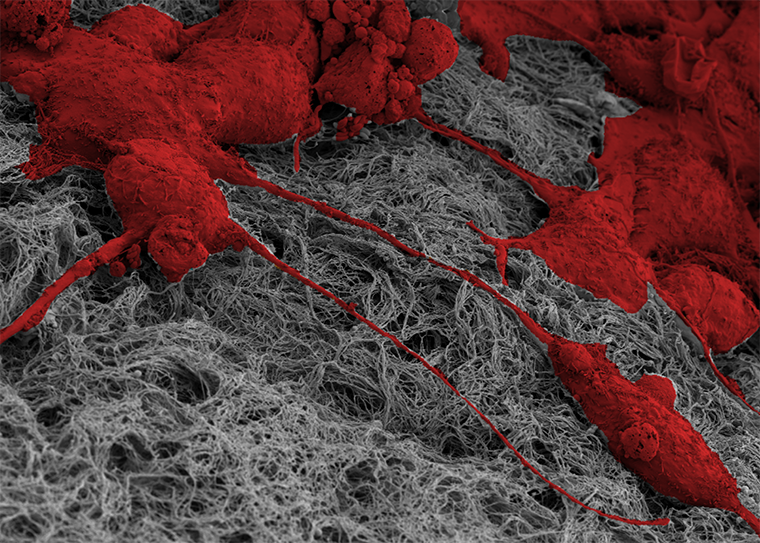
Scanning electron microscopy image of MCF10A human mammary epithelial cells (in red) with mechanical memory of past stiff environments pulling on collagen fibers (in gray) to install matrix memory, which helps propel future cell invasion. (Image: José Almeida/Washington University Center for Cellular Imaging)
◆研究者は、生体医工学の大学院生José Almeidaと機械工学・材料科学の大学院生Jairaj Mathurで、McKelvey School of Engineeringの機械工学・材料科学准教授Amit Pathakの研究室に所属しています。この研究成果は、5月5日付の学術誌「Molecular Biology of the Cell」にオンライン掲載されました。
◆Almeida教授とMathur教授は、細胞が過去の環境に関する機械的記憶を保存できることを発見した。このように、細胞は、個々の記憶ではなく、マトリックスを介して、学んだことを未来の細胞と共有し、将来の侵略への道を容易にするために、効果的に環境を再形成するのです。また、記憶を外部にエンコードすることで、遺伝子の活性化やエピジェネティック・リモデリングによって同様の適応を伝播させるよりもはるかに短い時間で、単一細胞の寿命を超えて集合記憶を保存することができます。
<関連情報>
- https://source.wustl.edu/2023/05/environmental-memory-propels-collective-cell-migration/
- https://www.molbiolcell.org/doi/10.1091/mbc.E22-10-0469
機械的にプライミングされた細胞は、硬さと次元が異なる環境を越えて侵入するために、記憶を繊維状マトリックスに移す Mechanically primed cells transfer memory to fibrous matrices for invasion across environments of distinct stiffness and dimensionality
José A. Almeida,Jairaj Mathur,Ye Lim Lee,Bapi Sarker and Amit Pathak
Molecular Biology of the Cell Published:5 May 2023
DOI:https://doi.org/10.1091/mbc.E22-10-0469
Abstract
Cells sense and migrate across mechanically dissimilar environments throughout development and disease progression. However, it remains unclear whether mechanical memory of past environments empowers cells to navigate new, three-dimensional extracellular matrices. Here, we show that cells previously primed on stiff, compared with soft, matrices generate a higher level of forces to remodel collagen fibers and promote invasion. This priming advantage persists in dense or stiffened collagen. We explain this memory-dependent, cross-environment cell invasion through a lattice-based model wherein stiff-primed cellular forces remodel collagen and minimize energy required for future cell invasion. According to our model, cells transfer their mechanical memory to the matrix via collagen alignment and tension, and this remodeled matrix informs future cell invasion. Thus, memory-laden cells overcome mechanosensing of softer or challenging future environments via a cell–matrix transfer of memory. Consistent with model predictions, depletion of yes-associated protein destabilizes the cellular memory required for collagen remodeling before invasion. We release tension in collagen fibers via laser ablation and disable fiber remodeling by lysyl-oxidase inhibition, both of which disrupt cell-to-matrix transfer of memory and hamper cross-environment invasion. These results have implications for cancer, fibrosis, and aging, where a potential cell-to-matrix transfer of mechanical memory of cells may generate a prolonged cellular response.