2023-08-10 東京大学
発表のポイント
◆Pre-mRNAスプライシングに必要なU6 snRNAの3’末端の連続したウリジン配列が、ウリジン転移酵素(TUT1)によって合成・付加される分子機構を明らかにしました。
◆TUT1がU6 snRNAの特徴的な配列と構造を認識し、U6 snRNAの内在配列がウリジン付加反応を制御していることが分かりました。
◆U6 snRNAの成熟化プロセスの異常が引き起こす常染色体潜性(劣性)皮膚疾患である多形皮膚委縮を伴う好中球減少症などの疾患の理解に貢献することが期待されます。
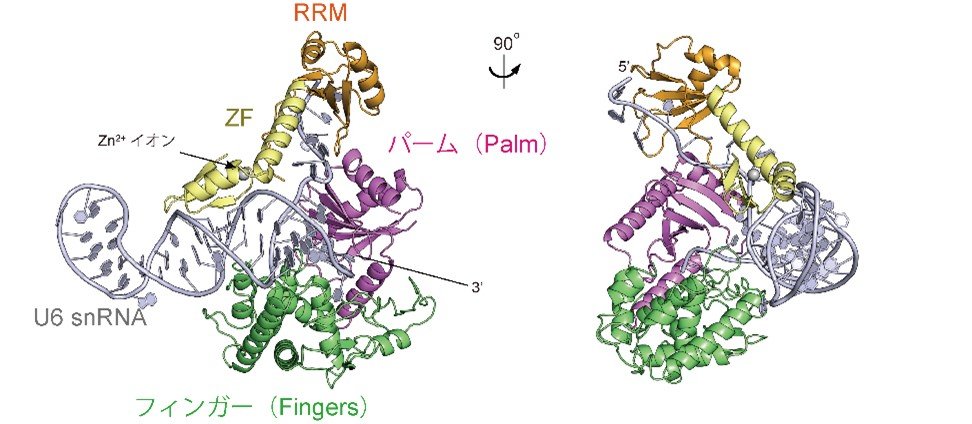
ヒト由来ウリジル化酵素TUT1とU6 snRNAの複合体構造
発表概要
東京大学大学院新領域創成科学研究科メディカル情報生命専攻の山下征輔助教と富田耕造教授は、U6 snRNA(注1)がpre-mRNAスプライシング(注2)の反応サイクルへ参画するのに必要なU6 snRNAの3′ 末端の連続したウリジン(オリゴウリジン、注3)配列が、ウリジン転移酵素(TUT1:Terminal uridyltransferase 1、注4)によって合成・付加される分子機構を明らかにしました。
ヒトを含む真核生物では、前駆体mRNA(pre-mRNA)はスプライシングによってpre-mRNA中のイントロンが取り除かれ、エクソン同士が連結され、機能を持ったmRNAへと成熟化されます。Pre-mRNAのスプライシングは、5種類のsnRNA(small nuclear RNA:U1、U2、U4、U5、U6)と多数のタンパク質からなるスプライソソーム(注5)によって行われます。U6 snRNAはスプライシング反応の中心的な役割を果たしており、その成熟化プロセスの異常はpre-mRNAスプライシングの異常を引き起こす可能性があります。
本研究成果は、U6 snRNAの成熟化プロセスの異常に起因する、常染色体潜性(劣性)皮膚疾患である多形皮膚委縮を伴う好中球減少症などの理解に貢献することが期待できます。
本研究成果は、8月10日付で「Nature Communications」にオンライン掲載されました。
発表内容
<研究の背景>
真核細胞において、pre-mRNAスプライシングはリボ核タンパク質(RNP:ribonucleoprotein)複合体であるスプライソソームによって行われます。主要なスプライソソームは5つのRNP複合体(U1、U2、U4、U5、U6 snRNP:small nuclear RNP)と数多くのタンパク質から構成されます。U6 snRNPはU6 snRNA、p100、およびLsm2-8タンパク質を含み、U6 snRNAはスプライソソーム内でスプライシング反応を触媒する活性部位を形成します。
U6 snRNAは5′-ステム(5′-stem)、内在性ステム-ループ(internal stem-loop:ISL)、テレステム(telestem)から構成される特徴的な2次構造を持ち、5′-stemとISLの間にはAUAモチーフ配列が存在します(図1左)。一次転写物の3’末端にはウリジン転移酵素、TUT1タンパク質によって、ウリジン三リン酸(UTP:uridine-triphosphate)を基質として複数のウリジンが付加されます(オリゴウリジン化)。その後、3′-5’エキソヌクレアーゼであるMpn1タンパク質によって適切な長さにウリジン配列は切り詰められます。最終的に、成熟U6 snRNAの3’末端には2’、3′-環状リン酸(>p)を有する5個の連続したウリジン(オリゴウリジン:UUUUU>p)が存在します(図1右)。
この3’末端の成熟プロセスにより、U6 snRNAの細胞内での安定性が向上します。U6 snRNAの3’末端の連続したオリゴウリジン配列はLsm2-8タンパク質複合体の結合部位であり、Lsm2-8タンパク質がU6 snRNAに結合することにより、pre-mRNAのスプライシング反応が促進されます。これまで、U6 snRNAの3’末端へのオリゴウリジン配列付加の詳細な分子機構は明らかにされていませんでした。
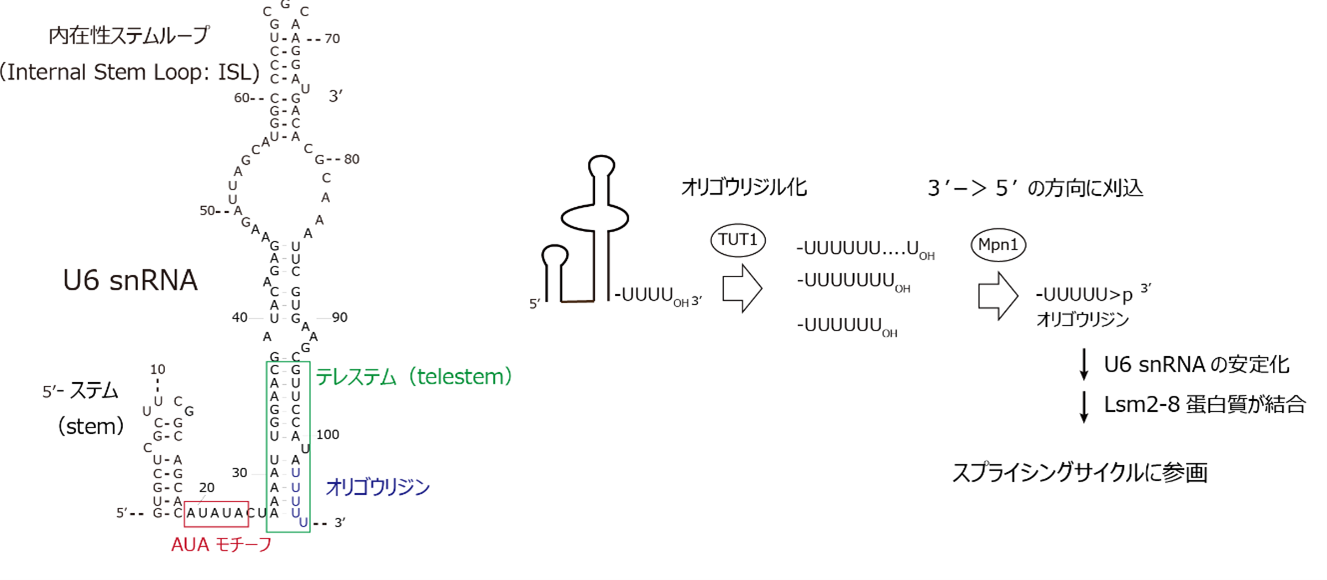
図1:U6 snRNAの2次構造および3’末端の成熟化過程
(左)ヒトU6 snRNAの2次元構造。5′-ステム(stem)、AUAモチーフ、テレステム(telestem)、内在性ステムループ(ISL)からなる。
(右)U6 snRNAの3’末端成熟化プロセス。TUT1でオリゴウリジル化された後、MpnIによってある程度まで短く刈り込まれる。3’末端のオリゴウリジン配列はスプライシング反応に必要。
<研究の内容>
本研究では、ヒト由来のTUT1タンパク質によるU6 snRNAの3’末端の特異的ウリジル化の分子基盤を明らかにするため、TUT1とU6 snRNAの複合体の三次元構造をX線結晶構造解析によって同定しました(図2)。
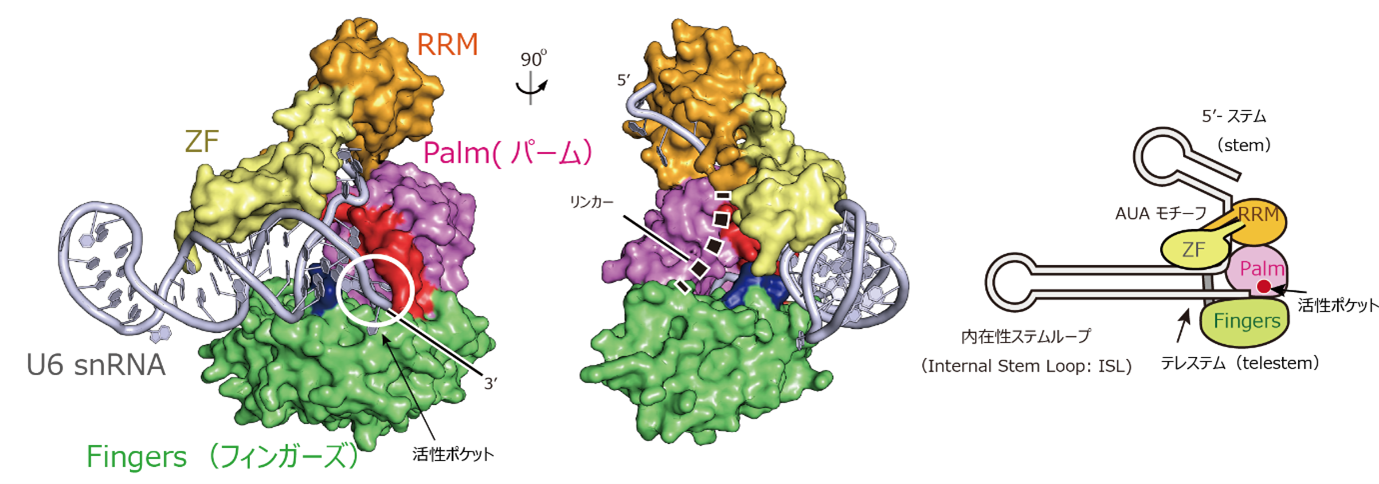
図2:U6 snRNAとTUT1の複合体構造(左)とその概略図(右)
(左)TUT1とU6 snRNAの複合体の構造。
(右)TUT1とU6 snRNAの相互作用の模式図。
U6 snRNAのAUAモチーフはTUT1のZF-RRMとPalm(パーム)によって抱え込まれており、結果、テレステムの3’末端が活性ポケットに入り込んでいる。
U6 snRNAの5′-ステムと3′-テレステムの間の一本鎖部分のAUAモチーフは、複数のドメインから構成されるTUT1タンパク質のアミノ末端側のZF-RRMによって特異的に認識され、また、ZF-RRMと触媒ドメインを構成するPalm(パーム)ドメインによって抱えこまれています。その結果、U6 snRNAのテレステムの3′-末端が活性部位に引き寄せられることが分かりました。さらに、U6 snRNAの変異体とTUT1タンパク質の変異体を用いた生化学的解析からも、TUT1がU6 snRNAの特異的な構造と配列を認識し、その3’末端をウリジル化することが確かめられました。また、生化学的解析から、U6 snRNAの3’末端にTUT1タンパク質によって付加されるウリジンの数は、U6 snRNAのテレステム中の4つのアデニンの連続配列(オリゴアデニン配列:AAAA)によって規定されていることが分かりました(図3)。
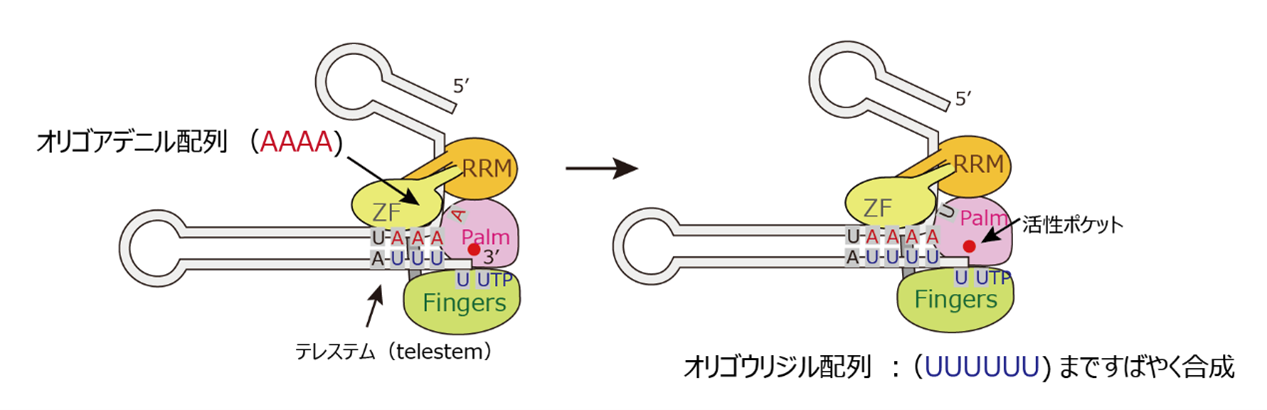
図3:U6 snRNAのTUT1のによるオリゴウリジル配列付加の制御機構
U6 snRNAのテレステム(telestem)のオリゴアデニル配列(4連続のアデニン:AAAA)が3’末端側のオリゴウリジン配列と塩基対合するまでTUT1はウリジンを付加する。結果、6つのウリジンが連続したウリジン配列(UUUUUU)が素早く合成される。
TUT1タンパク質は、U6 snRNAの3’末端のウリジン配列がテレステムのオリゴアデニン配列と完全に塩基対を形成するまで、素早くウリジンを付加します。その結果、TUT1によって産生されるU6 snRNAは主に3’末端に6つのウリジン(UUUUUU)を持ち、その後、MpnIによって末端のUが削れ、5つの連続したウリジン(UUUUU>p)になることが明らかになりました。このことは、U6 snRNAの内在配列がTUT1タンパク質によるU6 snRNAの3’末端のウリジル化反応を制御していることを示しています。
<今後の展望>
U6 snRNAはpre-mRNAのスプライシングにおいて中心的な役割を果たしており、その成熟化プロセスの異常はpre-mRNAスプライシングの異常を引き起こす可能性があります。pre-mRNAのスプライシング異常に関連する疾患としては、脊髄性筋萎縮症、筋萎縮性側索硬化症、網膜色素変性症などの重篤な疾患が報告されており、またU6 snRNAの成熟化プロセスの異常と常染色体潜性(劣性)皮膚疾患である多形皮膚委縮を伴う好中球減少症との関連も報告されています。本研究の成果はU6 snRNAの成熟化プロセスの異常による疾患の理解に貢献するものと考えられます。
<研究助成>
本研究は、日本学術振興会科学研究費助成事業 最先端次世代研究開発プログラム(NEXT program:LS135)、基盤研究A(23H00368、18H03980、26251009)、若手研究(19K16053)、文部科学省科学研究費助成事業 新学術領域研究(26113002)などの支援を受けて行われました。
発表者
東京大学大学院新領域創成科学研究科 メディカル情報生命専攻
山下 征輔(助教)
富田 耕造(教授)
論文情報
〈雑誌〉 Nature Communications
〈題名〉 Mechanism of U6 snRNA oligouridylation by human TUT1
〈著者〉 Seisuke Yamashita, and Kozo Tomita*
〈DOI〉 10.1038/s41467-023-40420-9
〈URL〉 https://www.nature.com/articles/10.1038/s41467-023-40420-9
用語解説
(注1)U6 snRNA
Pre-mRNAスプライシング(注2)を触媒するスプライソソーム(注5)を構成するタンパク質をコードしない機能性RNA分子のひとつ。スプライシング反応の触媒活性を担うことが知られています。
(注2)pre-mRNAスプライシング
ヒトを含む真核生物における、タンパク質をコードするDNAから転写された前駆体mRNA (pre-mRNA)の多くは、介在領域(intron:イントロ)によってタンパク質をコードする領域(exon:エクソン)が分断されています。Pre-mRNAから不要なイントロンを取り除き、エクソン同士を連結することをpre-mRNAのスプライシングと呼びます。Pre-mRNAスプライシングは、遺伝子情報の多様性や機能の調節に寄与します。
(注3)ウリジン(オリゴウリジン)
RNAは主にアデニン(A)、グアニン(G)、ウリジン(U)、シトシン(C)の4種類のヌクレオチドを構成成分としてもちます。ウリジン(U)が複数連なった配列をもつRNAをオリゴウリジンと呼びます。
(注4)ウリジン転移酵素
RNAの末端に核酸性の鋳型を用いずにウリジンを転移、付加し、オリゴウリジン配列を合成する酵素のことを呼びます。
(注5)スプライソソーム
スプライソソームは、真核生物の細胞核内に存在するタンパク質とRNAからなるリボ核タンパク質複合体(RNP:Ribonucleoprotein)で、pre-mRNAのスプライシングに関与します。主要なスプライソソーム中のRNA成分は、snRNA(small nuclear RNA)と呼ばれ、U1、 U2、 U4、 U5、 U6 の5種類存在し、pre-mRNA内のスプライシングによって切断される部分を含む特定の配列やタンパク質と協奏的に相互作用します。スプライシング反応の触媒活性を担うのは、スプライソソーム中のタンパク質ではなくU6 snRNAであることが知られています。
お問い合わせ
新領域創成科学研究科 広報室