2023-08-31 理化学研究所,東京大学,医薬基盤・健康・栄養研究所,日本医療研究開発機構,神奈川県立産業技術総合研究所
理化学研究所(理研)生命医科学研究センタ ー粘膜システム研究チームの大野 博司 チームリーダー(神奈川県立産業技術総合研究所(KISTEC)腸内細菌叢プロジェクト プロジェクトリーダー(研究当時))、窪田 哲也 上級研究員(研究当時、医薬基盤・健康・栄養研究所(NIBIOHN)国立健康・栄養研究所臨床栄養研究部長(研究当時)、KISTEC腸内細菌叢プロジェクト サブリーダー(研究当時))、竹内直志特別研究員(研究当時)、理研統合生命医科学研究センター(研究当時)の小安 重夫 センター長(研究当時、現 理研生命医科学研究センター 免疫細胞システム研究チーム チームリーダー)、東京大学医学部附属病院 糖尿病・代謝内科の門脇 孝 教授(研究当時)、同病態栄養治療センター 病態栄養治療部の窪田 直人 准教授らの共同研究グループは、2型糖尿病[1]の基盤であるインスリンの働きが悪くなる「インスリン抵抗性[2]」に関連する特徴的な腸内細菌および糞便代謝物[3]を特定しました。
本研究成果は、2型糖尿病の発症予測や未病(前糖尿病)[4]段階での治療介入などに貢献するものと期待されます。
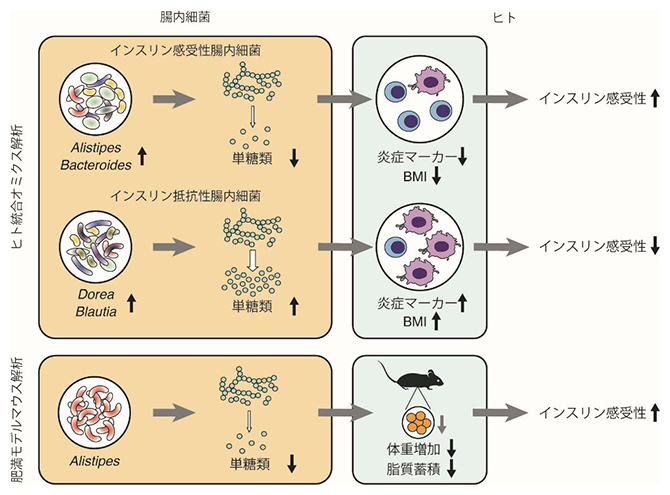
今回、共同研究グループは、日本人306人の腸内細菌および糞便代謝物を網羅的に調べる統合オミクス解析[5]を実施し、糞便中の果糖、ガラクトースなどの単糖類[6]がインスリン抵抗性に関連することを発見しました。また、腸内細菌のうちAlistipes属はインスリン抵抗性、単糖類ともに負の相関を示したことから、Alistipes属にインスリン抵抗性の改善効果があると予測しました。実際に、Alistipes indistinctusをインスリン抵抗性モデルマウスに投与した結果、この細菌株にインスリン抵抗性の改善効果および腸管内単糖類の減少効果があることを突き止めました。
本研究は、科学雑誌『Nature』オンライン版(8月30日付:日本時間8月31日)に掲載されました。
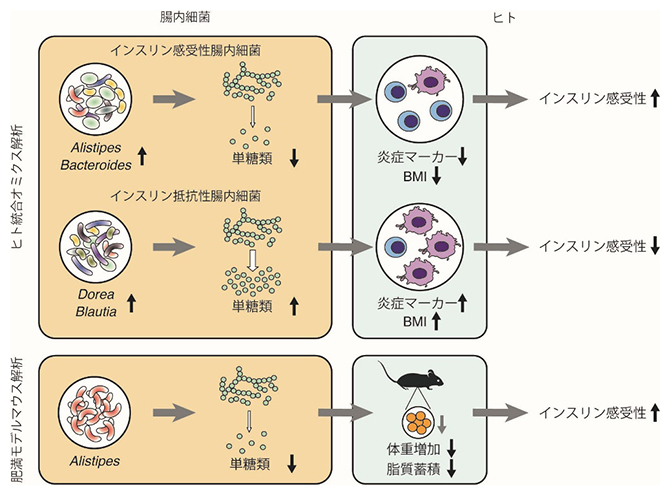
統合オミクス解析によるインスリン抵抗性に関連する腸内細菌の同定
背景
2型糖尿病はインスリンの働きが悪くなる「インスリン抵抗性」が基盤となり、高血糖を呈する疾患です。2型糖尿病は日本のみならず世界中で患者が増加しており、また、心臓病、腎臓病、網膜症による失明など重篤な合併症の原因になることから、その機序解明が望まれています。近年さまざまな研究により、2型糖尿病やその背景にあるインスリン抵抗性に、腸内細菌が関与していることが示唆されています。
しかし、これら多くの研究はある種の腸内細菌とインスリン抵抗性との関連を示唆するのみで、その機序を示すことは困難でした。その一因として、従来のヒト腸内細菌の研究は細菌の種類およびその遺伝子を調べるメタゲノム解析[7]が一般的であり、疾患を直接的に制御する腸内細菌代謝物のような低分子化合物に関する知見が不足していたことが挙げられます。
そこで、共同研究グループはヒト検体の統合オミクス解析により腸内細菌に関する情報を網羅的に調べることで、腸内細菌がインスリン抵抗性の病態にどのように関与しているかを多角的に調べることにしました。特に、膨大な低分子化合物を探索できるメタボローム解析[8]の併用により、腸内細菌の遺伝子だけでなく、ヒトの生理機能に直接影響を与える腸内細菌からの”メッセンジャー”としての役割を果たす代謝物を探索することで、腸内細菌の直接的な役割をより的確に調べることにしました。
なお本研究は、理研、東京大学、NIBIOHN、KISTECとの共同研究であると同時に、2013年理研統合生命医科学研究センター(現生命医科学研究センター)発足時に開始したセンタープロジェクトの一つであり、センター内外から多くの研究者が参加して実施されました。
研究手法と成果
共同研究グループは、東京大学医学部附属病院予防医学センターを受診した日本人を対象に、①肥満の人(BMI[9]:25kg/m2以上)、②前糖尿病の指標を満たす人(空腹時血糖:110mg/dL以上、もしくはHbA1c[10]:6.0%以上)、③それ以外の人、それぞれ100人ずつ程度を目標に被験者を募集しました。以前の研究から糖尿病薬が腸内細菌に影響を与えることが示されており、また未病(前糖尿病)の段階における腸内細菌の変化を調べることが本研究の目的であることから、糖尿病薬を使用中の人は対象からは除外しました。募集の結果、合計306人の被験者が集まりました。
集まった被験者を対象に、身長、体重、生化学検査(コレステロール、血糖、HbA1cなど)の一般的な検診項目とともに、糞便、血液を追加採取しました。これらの検体を使用し、糞便細菌叢解析、糞便メタゲノム解析、糞便メタボローム解析、血液メタボローム解析、血液サイトカイン[11]解析、末梢血単核細胞CAGE解析[12]を組み合わせた「統合オミクス解析」を実施しました。
糞便メタボローム解析の結果、過去のヒト腸内細菌研究で報告されていた数を大幅に上回る2,849種類の代謝物の同定に成功しました。これらの糞便代謝物と各種臨床マーカーとの関連性を解析したところ、インスリン抵抗性のマーカーのHOMA-IR[13]、およびメタボリック症候群やBMIなど代謝異常のマーカーが、ブドウ糖、果糖、ガラクトース、キシロースなどの「単糖類」と関連していることを発見しました(図1)。また、英国で実施されたTwinsUKコホート[14]データ注1)を再解析し、同様にHOMA-IRやBMIが単糖類と関連していることを確認しました。
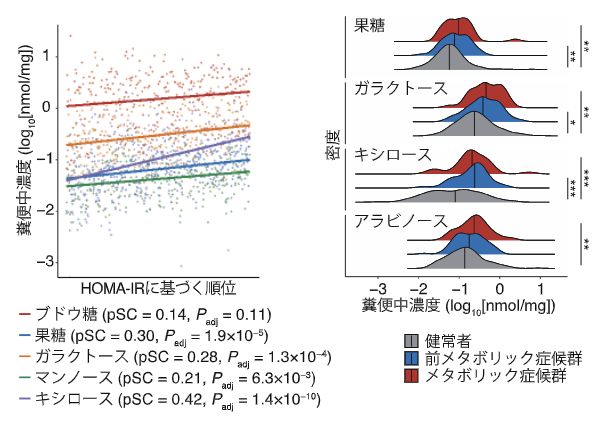
図1 糞便中の単糖類とインスリン抵抗性マーカーとの関連
左:糞便中の単糖類とインスリン抵抗性のマーカーであるHOMA-IRとの関連。
右:糞便中の単糖類とメタボリック症候群のマーカーとの関連。*P<0.05、**P<0.01、***P<0.001。
次に、これら単糖類の増減に腸内細菌が関与するかどうかを調べました。以前よりメタゲノム解析では、前糖尿病や肥満の人の腸内細菌は糖質代謝が活発になっていることが示されていました注2、3)。そこで、「どの腸内細菌種が単糖類に関連するか」「どのような腸内細菌の遺伝子機能が単糖類に関連するか」の2点を中心に解析しました。
その結果、被験者306人の腸内細菌は四つの大きなパターン(図2上のクラスターA~D)に分けられること、そのうちBlautia属、Dorea属の細菌を多く含む腸内細菌叢パターン(図2の緑帯:グループ1)はインスリン抵抗性や単糖類と正に関連する一方、Bacteroides属、Alistipes属を多く含む腸内細菌叢パターン(図2の青帯:グループ2)は負に関連することを見いだしました(図2)。さらに、Bacteroides属、Alistipes属を多く含む腸内細菌叢パターンには、デンプンやショ糖など複雑な糖質をヒトが吸収できる単糖類に変換する遺伝子機能は少なく、単糖類そのものを利用する遺伝子機能が多く検出されました。
以上の結果から、インスリン抵抗性に関連する腸管内の単糖類の増減には、特定の腸内細菌種と糖質分解・利用に関わる腸内細菌の遺伝子機能が関与している可能性が示されました。

図2 四つの腸内細菌パターンとインスリン抵抗性との関連
腸内細菌はその共起性(同じグループでは同じような増減パターンを示すこと)に基づき、グループ1(緑)、2(青)、3(青紫)、4(灰)、その他(白)に分けられる。中央のヒートマップのZスコアは各細菌の存在比を示し、赤色が濃いほど存在比が大きく、青色が濃いほど存在比が小さいことを表す。被験者306人の腸内細菌パターンをクラスターA、B、C、Dに分類したところ、クラスターCではグループ2の細菌(Bacteroides属、Alistipes属が主体)が、クラスターDではグループ1の細菌(Blautia属、Dorea属が主体)が、クラスターBではグループ3および4の細菌がそれぞれ多かった。図上の円グラフは、各クラスターの被験者の割合をインスリン感受性(濃い青、インスリンの働きが良い)、中間(灰)、インスリン抵抗性(濃い赤、インスリンの働きが悪い)の三つに分けて示している。円グラフを見ると、クラスターCではインスリン抵抗性の被験者の割合が有意に少なく、それに対しクラスターDではインスリン抵抗性の被験者の割合が相対的に多かった。つまり、Bacteroides属、Alistipes属を主体とする腸内細菌叢パターンは、Blautia属、Dorea属を主体する腸内細菌叢パターンと比べてインスリン抵抗性と負に関連することが分かった。
単糖類はそれ自体が過剰な栄養素になる一方で、ヒト体内の免疫細胞から炎症性サイトカイン[11]の産生を促すことで、インスリン抵抗性や肥満を増悪させる可能性が示されています注4)。末梢血単核細胞(免疫細胞)のCAGE解析と血中サイトカインの解析を組み合わせることで、インスリン抵抗性に関連する炎症関連の遺伝子プロモーター[15]活性と炎症性・抗炎症性サイトカインを同定しました。さらに、相関係数に基づく因子間の相互作用を明らかにするネットワーク解析[16]を行ったところ、糞便中の単糖類は、腸内細菌と免疫細胞の炎症関連遺伝子、炎症性サイトカインを結ぶネットワークハブであることが可視化されました(図3)。
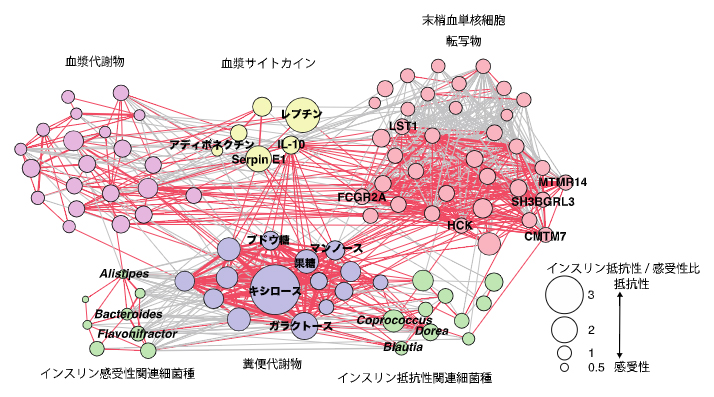
図3 糞便中の単糖類は腸内細菌と炎症関連マーカーをつなぐネットワークハブ
インスリン抵抗性に関連する腸内細菌、糞便代謝物、血漿代謝物、血漿サイトカイン、末梢血単核細胞転写物を同定し、相関係数に基づくネットワークを作成した。赤色の線は正の相関、灰色の線は負の相関、線の太さは相関係数の絶対値、円の大きさはインスリン抵抗性被験者/インスリン感受性被験者の比を示す。
最後に、統合オミクス解析で同定した腸内細菌種のうちインスリン感受性[2](インスリンの働きが良い状態)に関連する細菌種が、実際に病態を改善する効果を持つか、実験的な検証を試みました。前述の通り、Alistipes属は単糖類と負の相関をする細菌種です。その代表株であるAlistipes indistinctusを肥満モデルマウスに投与したところ、インスリン抵抗性の指標であるインスリンの血糖低下作用が改善しました(図4上段)。さらに、このマウスでは腸管および血液中の単糖類の量が減少しました(図4下段)。以上の実験結果から、統合オミクス解析で見いだされたAlistipes indistinctusは腸管内の単糖類の量を減少させることで、インスリン抵抗性を改善させる可能性が示されました。
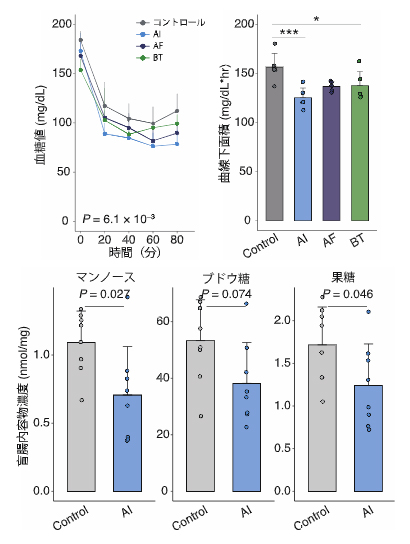
図4 Alistipes indistinctusによる血糖改善効果
上段:Alistipes indistinctus(AI)、Alistipes finegoldii(AF)、Bacteroides thetaiotaomicron(BT)を肥満モデルマウスに投与し、インスリンの血糖低下作用を比較した。左は血糖値と経過時間を示すグラフで、右はその曲線下面積を比較したグラフ。曲線下面積は血糖値の時系列グラフ(左)の曲線下の範囲を表し、値が小さいほど血糖低下作用が大きいことを示す。
下段:AI投与後の盲腸内容物中の各単糖類の濃度。AIにより単糖類の量が減少した。
注1)Zierer, J. et al. The fecal metabolome as a functional readout of the gut microbiome. Nat Genet 50, 790-795 (2018).
注2)Turnbaugh, P. J. et al. A core gut microbiome in obese and lean twins. Nature 457, 480-484 (2009).
注3)Karlsson, F. H. et al. Gut metagenome in European women with normal, impaired and diabetic glucose control. Nature 498, 99-103 (2013).
注4)Després, J. P. & Lemieux, I. Abdominal obesity and metabolic syndrome. Nature 444, 881-887 (2006).
今後の期待
本研究では、2型糖尿病の背景病態であるインスリン抵抗性に関連する腸内細菌を統合オミクス解析という従来にはない多角的な視点から調べることで、腸管内の単糖類がインスリン抵抗性に強く関連すること、また特定の腸内細菌種とその遺伝子機能がこれら単糖類と関連することを見いだしました。さらに、統合オミクス解析を通じて同定したAlistipes属の代表株であるAlistipes indistinctusが、実際にマウスのインスリン抵抗性を改善させることを明らかにしました。
本研究は、これまで明らかにされていなかった腸内細菌とインスリン抵抗性をつなぐ機序を解明したとともに、腸内細菌および腸管内単糖類が治療標的になり得ることを示しました。今後、本成果を基に、新しいプロバイオティクス[17]やインスリン抵抗性の治療薬が創出されるものと期待されます。
補足説明
1.2型糖尿病
糖尿病は、大きく1型糖尿病、2型糖尿病、その他の特定の機序や疾患による糖尿病などに分類される。2型糖尿病は、インスリン分泌低下とインスリン抵抗性(インスリンの働きが悪くなること)が合わさり、血糖値が上昇し、発症する。日本の糖尿病患者数は約1,150万人で、そのうち約90%は2型糖尿病であると考えられている。
2.インスリン抵抗性、インスリン感受性
体内で産生されるインスリンは血糖を低下させる唯一のホルモンであるが、インスリンが血糖低下作用を発揮する状態をインスリン感受性と呼ぶ。一方、さまざまな原因でインスリンによる血糖低下作用が減弱することをインスリン抵抗性と呼ぶ。2型糖尿病やメタボリック症候群の基礎になる病態であると考えられている。
3.代謝物
腸内細菌が産生する、脂肪酸、アミノ酸、糖、ビタミンなどの低分子化合物。多くはヒト体内では合成が不可能であり、食事由来成分から腸内細菌独自の機能で合成される。腸内細菌の種類によって合成される代謝物は異なる。
4.未病(前糖尿病)
未病とは、発病には至らないものの、病的状態に近づきつつある状態。2型糖尿病の場合、インスリン抵抗性を呈するものの、高血糖には至らない状態(前糖尿病)などを指す。
5.統合オミクス解析
さまざまな網羅的解析手法を組み合わせることで生体試料を多角的に調べる手法。遺伝子を調べるゲノミクス、転写物を調べるトランスクリプトミクス、タンパク質を調べるプロテオミクス、そして代謝物を調べるメタボロミクスなどを実施し、それぞれの解析結果を基に関連性などを調べる。
6.単糖類
糖質の最小単位である糖を指す。主にブドウ糖、果糖、ガラクトースなどを含む。単糖類はヒト体内に吸収可能なため、ヒトの代謝生理に影響を与えると考えられている。
7.メタゲノム解析
環境中(腸内細菌を解析する場合は糞便)の微生物由来DNAを網羅的にシークエンシングすることで、微生物の種類のみならずその遺伝子機能を調べることが可能な解析方法。
8.メタボローム解析
低分子化合物(代謝物)を網羅的に探索する実験手法。ガスクロマトグラフィー質量分析計、液体クロマトグラフィー質量分析計、核磁気共鳴装置などを用いて、試料中に含まれる物質の化学的・構造的特性を同定する。
9.BMI
ヒトの肥満の程度を示す指標。「BMI=体重(kg)/身長(m)2」の計算式に基づき体重と身長の関係から算出される。値が大きいほど肥満の傾向にあることを意味する。BMIはBody Mass Indexの略。
10.HbA1c
赤血球に含まれるヘモグロビンにブドウ糖が結合したものを指す。過去1、2カ月の血糖値を反映していると考えられ、臨床的に重要な糖尿病の指標である。
11.サイトカイン、炎症性サイトカイン
サイトカインは、免疫応答や炎症反応などの調節に関わる細胞間の情報伝達を担当するタンパク質の一群のこと。免疫細胞やその他の細胞によって産生され、特定の受容体を持つ細胞に対してシグナルを送ることで、さまざまな生体内プロセスを引き起こす。特に炎症反応を引き起こすサイトカインを炎症性サイトカインと呼び、インスリン抵抗性を悪化させる一因であると考えられている。
12.CAGE解析
RNAシークエンシング解析などの通常の遺伝子発現解析と異なり、各遺伝子を転写開始点ごとに定量可能な解析方法。理研で開発された技術である。CAGEはCap Analysis Gene Expressionの略。
13.HOMA-IR
インスリン抵抗性を簡便に把握する臨床マーカー。空腹時の血中インスリン値と血糖値を基に算出される。
14.TwinsUKコホート
1992年に英国で設立された、双生児を対象とした大規模な研究グループおよびそのコホート(集団)のこと。健康状態、疾患リスク、遺伝的要因、ライフスタイル、環境因子などに関する情報を収集することで、これらの要因が健康に及ぼす影響を理解するための研究が行われている。
15.プロモーター
遺伝子の転写(DNAの遺伝情報をRNAにコピーするプロセス)を開始するためのDNAの特殊な領域。転写因子と呼ばれる分子が遺伝子の特定の部位に結合し、転写プロセスを開始するための必要なシグナルを提供する。
16.ネットワーク解析
相関係数などを基に、因子間の相互作用を明らかにする解析手法。因子間の関連性の強さ、関連性を基にしたクラスター、さらに、多くの因子と関連性を持つ「ハブ」となる因子を可視化することが可能である。
17.プロバイオティクス
健康に良い影響を及ぼす微生物(主に細菌)を指す。現在は、主に乳酸菌やビフィドバクテリウムなどの微生物がプロバイオティクスとして使用されている。
共同研究グループ
理化学研究所
生命医科学研究センター
粘膜システム研究チーム
チームリーダー 大野 博司(オオノ・ヒロシ)
(神奈川県立産業技術総合研究所 腸内細菌叢プロジェクト プロジェクトリーダー(研究当時))
上級研究員(研究当時)窪田 哲也(クボタ・テツヤ)
(医薬基盤・健康・栄養研究所(NIBIOHN)国立健康・栄養研究所 臨床栄養研究部長(研究当時)、神奈川県立産業技術総合研究所 腸内細菌叢プロジェクト サブリーダー(研究当時)、現 朝日生命成人病研究所 研究部長兼看護科部長)
特別研究員(研究当時)竹内 直志(タケウチ・タダシ)
研究員 中西 裕美子(ナカニシ・ユミコ)
(神奈川県立産業技術総合研究所 腸内細菌叢プロジェクト 常勤研究員(研究当時))
研究員 根本 信乃(ネモト・シノ)
メタボローム研究チーム
チームリーダー 有田 誠(アリタ・マコト)
研究員(研究当時) 津川 裕司(ツガワ・ヒロシ)
副チームリーダー(研究当時) 池田 和貴(イケダ・カズキ)
マイクロバイオーム研究チーム
チームリーダー(研究当時) 服部 正平(ハットリ・マサヒラ)
副チームリーダー 須田 亙(スダ・ワタル)
ゲノム制御ネットワーク研究チーム(研究当時)
チームリーダー(研究当時)エリック・アーナー(Erik Arner)
(現 トランスクリプトーム研究チーム 客員主管研究員)
研究員(研究当時)アンドリュー・テジュン・クウォン(Andrew Tae-Jun Kwon)
統合ゲノミクス研究チーム
チームリーダー(研究当時)小原 收(オハラ・オサム)
技師 矢崎 潤史(ヤザキ・ジュンシ)
専門技術員 望月 芳樹(モチヅキ・ヨシキ)
代謝ネットワーク研究チーム
チームリーダー 北見 俊守(キタミ・トシモリ)
統合細胞システム研究チーム
チームリーダー 柚木 克之(ユギ・カツユキ)
トランスクリプトーム研究チーム
チームリーダー ピエロ・カルニンチ(Piero Carninci)
統合生命医科学研究センター(研究当時)
センター長 小安 重夫(コヤス・シゲオ)
(現 理研 生命医科学研究センター 免疫細胞システム研究チーム チームリーダー)
東京大学
大学院医学系研究科 代謝・栄養病態学
教授(研究当時)門脇 孝(カドワキ・タカシ)
(医学部附属病院 糖尿病・代謝内科 科長(研究当時))
医学部附属病院 糖尿病・代謝内科
助教[特任講師(病院)](研究当時)高本 偉碩(タカモト・イセキ)
医学部
准教授 窪田 直人(クボタ・ナオト)
(医学部附属病院 病態栄養治療センター 病態栄養治療部 部長)
教授(研究当時)山崎 力(ヤマザキ・ツトム)
(医学部附属病院 検診部 部長(研究当時))
准教授 山道 信毅(ヤマミチ・ノブタケ)
(医学部附属病院 予防医学センター センター長)
大学院医学系研究科 生物統計情報学
特任研究員(研究当時)水野 由子(ミズノ・ヨシコ)
(医学部附属病院 予防医学センター(研究当時))
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業基盤研究(A)「宿主ー腸内細菌叢相互作用が宿主の病理に及ぼす影響の研究(研究代表者:大野博司、22H00452)」同新学術領域研究(研究領域提案型)「脂質クオリティが解き明かす生命現象(研究代表者:有田誠、15H05897)」「精神病態の分子基盤解明を可能にする次世代トランスオミクス技術の開発(研究代表者:柚木克之、18H05431)」、同挑戦的研究(開拓)「質量分析インフォマティクスの開拓による生薬作用分子メカニズムの解明(研究代表者:津川裕司、21K18216)」、同基盤研究(C)「血管内皮細胞の選択的インスリン抵抗性を介した動脈硬化発症メカニズムの解明」(研究代表者:窪田哲也、19K08991)、日本医療研究開発機構(AMED)ムーンショット型研究開発事業「健康寿命伸長に向けた腸内細菌動作原理の理解とその応用(プロジェクトマネージャー:慶應義塾大学本田賢也、分担者:大野博司、22zf0127007)」、同革新的先端研究開発支援事業(疾患における代謝産物の解析および代謝制御に基づく革新的医療基盤技術の創出)「オミクス解析に基づくアレルギー発症機構の理解と制御基盤の構築(研究代表者:大野博司、19gm0710009h0006)」、科学技術振興機構(JST)戦略的創造推進事業ERATO「有田リピドームアトラスプロジェクト(研究統括:有田誠、研究分担者:津川裕司、JPMJER2101)」、国立がん研究センター研究開発費「質量分析インフォマティクス(研究分担者:津川裕司、2020-A-9)」「官民研究開発投資拡大プログラム(研究分担者:窪田直人、20AC5004)」、小野医学研究財団「NAFLDにおける腸内細菌/腸内代謝産物の役割の解明(研究代表者:窪田哲也)」、神奈川県立産業技術総合研究所(KISTEC)有望シーズ展開事業腸内細菌叢プロジェクト(プロジェクトリーダー:大野博司)、文部科学省地域イノベーション・エコシステム形成プログラム 神奈川発「ヘルスケア・ニューフロンティア」先導プロジェクトによる助成を受けて行われました。
AMEDでは、ムーンショット型研究開発事業の目標7「2040年までに、主要な疾患を予防・克服し100歳まで健康不安なく人生を楽しむためのサステイナブルな医療・介護システムの実現」の達成にむけて研究開発を推進しています。
謝辞
本研究にあたり公益財団法人朝日生命成人病研究所 所長春日雅人先生に多大なご支援・ご協力をいただきましたこと感謝申し上げます。
原論文情報
Tadashi Takeuchi, Tetsuya Kubota※, Yumiko Nakanishi, Hiroshi Tsugawa, Wataru Suda, Andrew Tae-Jun Kwon, Junshi Yazaki, Kazutaka Ikeda, Shino Nemoto, Yoshiki Mochizuki, Toshimori Kitami, Katsuyuki Yugi, Yoshiko Mizuno, Nobutake Yamamichi, Tsutomu Yamazaki, Iseki Takamoto, Naoto Kubota, Takashi Kadowaki, Erik Arner, Piero Carninci, Osamu Ohara, Makoto Arita, Masahira Hattori, Shigeo Koyasu, Hiroshi Ohno※(※責任著者), “Gut microbial carbohydrate metabolism contributes to insulin resistance”, Nature, 10.1038/s41586-023-06466-x
発表者
理化学研究所
生命医科学研究センター 粘膜システム研究チーム
チームリーダー 大野 博司(オオノ・ヒロシ)
(神奈川県立産業技術総合研究所(KISTEC)腸内細菌叢プロジェクト プロジェクトリーダー(研究当時))
上級研究員(研究当時)窪田 哲也(クボタ・テツヤ)
(医薬基盤・健康・栄養研究所(NIBIOHN)国立健康・栄養研究所 臨床栄養研究部長(研究当時)、KISTEC 腸内細菌叢プロジェクト サブリーダー(研究当時))
特別研究員(研究当時)竹内 直志(タケウチ・タダシ)
統合生命医科学研究センター(研究当時)
センター長 小安 重夫(コヤス・シゲオ)
(現 理研 生命医科学研究センター 免疫細胞システム研究チーム チームリーダー)
東京大学医学部附属病院
糖尿病・代謝内科
教授(研究当時)門脇 孝(カドワキ・タカシ)
病態栄養治療センター 病態栄養治療部
准教授 窪田 直人(クボタ・ナオト)
報道担当
理化学研究所 広報室 報道担当
東京大学医学部附属病院 パブリック・リレーションセンター
医薬基盤・健康・栄養研究所 戦略企画部 広報チーム
神奈川県立産業技術総合研究所 研究開発部 地域イノベーション推進課
AMED事業に関する問い合わせ先
日本医療研究開発機構(AMED)
研究開発統括推進室基金事業課