2023-08-31 理化学研究所,神戸大学,浜松医科大学
理化学研究所(理研)生命機能科学研究センター 呼吸器形成研究チームの榎本 泰典 研究員(研究当時)(現 客員研究員、浜松医科大学 再生・感染病理学講座 助教)、森本 充 チームリーダー、神戸大学医学部附属病院 呼吸器内科の永野 達也 講師らの共同研究グループは、肺胞オルガノイド[1]培養と呼ばれる新しい細胞培養技術を使って培養皿上にミニ肺胞を再現し、肺線維症[2]が発症する最も初期の現象を解明することに成功しました。
本研究成果は、肺線維症の代表疾患であり、効果的な治療法の乏しい難治性の特発性肺線維症(IPF)[2]の病態解明や、新たな治療薬の開発に貢献するものと期待されます。
特発性肺線維症は、肺胞の壁が厚く固くなり(線維化)、進行すると呼吸機能が低下し生命に関わる疾患です。
今回、共同研究グループは、試験管内で実際の臓器によく似た3次元組織を作る培養技術を応用してヒトおよびマウスの肺胞オルガノイドを作製し、肺の線維化を再現することに成功しました。線維化した肺胞オルガノイドの詳細な解析から、Ⅱ型肺胞上皮細胞[3]という肺胞上皮における組織幹細胞[4]が肺線維症の発症に中心的役割を果たし、その細胞老化がきっかけとなって線維化誘導性の特殊な細胞状態へと変化することが分かりました。線維化誘導性となったⅡ型肺胞上皮細胞は、TGFβ[5]という線維化誘導物質を周囲に分泌し、またTGFβの自身への作用がポジティブフィードバック[6]となって、IPF特有の非炎症性の線維化を誘導していくことを突き止めました。
本研究は、オンライン科学雑誌『Nature Communications』(8月31日付:日本時間8月31日)に掲載されました。
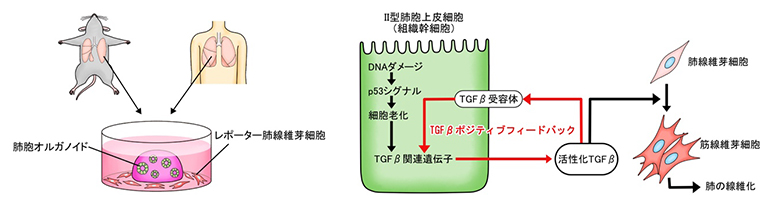
肺胞オルガノイドモデルを用いた肺線維化誘導プロセスの解明
背景
肺のガス交換機能を担う肺胞は、表面を覆う肺胞上皮細胞と組織の間を埋める肺線維芽細胞[7]などにより構成されています。肺線維症は、何らかの原因により肺線維芽細胞が筋線維芽細胞[7]に分化し、コラーゲンなどの異常タンパク質が蓄積することで、肺胞の壁が厚くなって固くなる(線維化する)病気です(図1)。この病態が進行すると呼吸機能が低下し、生命に関わります。特発性肺線維症(IPF)は肺線維症の代表的疾患であり、原因不明で治療が難しいため生命予後が悪く、日本でも難病指定を受けています。
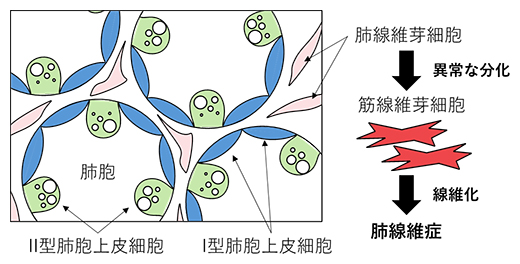
図1 肺胞と肺線維化
肺胞を構成する細胞のうち、2種類の肺胞上皮細胞(Ⅰ型とⅡ型)と肺線維芽細胞を示した模式図。肺線維症は、肺線維芽細胞が筋線維芽細胞に分化することで引き起こされる。
肺胞の上皮細胞にはⅠ型とⅡ型の二つのタイプがあり、Ⅱ型肺胞上皮細胞は組織幹細胞としても機能します。肺胞が傷つくとⅡ型肺胞上皮細胞が増殖して自分自身を補い、さらにⅠ型肺胞上皮細胞[3]に分化することで肺胞が再生されます。最近の研究から、IPFの発症には、Ⅱ型肺胞上皮細胞の障害と、肺線維芽細胞から分化した筋線維芽細胞の増殖が関わるとされています。しかしこれまで、Ⅱ型肺胞上皮細胞の障害と筋線維芽細胞の分化を直接結び付ける知見は十分ではありませんでした。
また一般的に、さまざまな臓器の線維化の誘導には炎症が関わることがよく知られていますが、IPFの肺では炎症所見が乏しく、実際にIPF患者に対して炎症を抑える治療を行っても有効ではないことが分かっています。すなわち、炎症に依存しない線維化プロセスの存在が示唆されていました。
そこで共同研究グループは、マウスおよびヒト肺の生組織からⅡ型肺胞上皮細胞だけを取り出し、試験管内で培養することで肺胞組織を再構成し、IPF特有の炎症に依存しない線維化プロセスの解明に挑みました。
研究手法と成果
共同研究グループは初めに、肺の線維化がどのように進行するかを調べました。ブレオマイシンという肺線維化を誘導する薬剤をマウスの気管内に投与して肺線維化を誘導し、生体における肺線維化発症プロセスの経時的な評価を行った結果、1)Ⅱ型肺胞上皮細胞のDNAダメージ、2)炎症、3)筋線維芽細胞の誘導、4)線維化が起こることを確認しました。
次に炎症が生じない環境でも線維化が誘導されるのかを検証するため、炎症を起こす免疫細胞を除いた肺組織を生体から分離し、試験管内でブレオマイシンを作用させる実験を行いました。するとこの場合でも、筋線維芽細胞の誘導が見られ、線維化プロセスに炎症が必須ではない可能性が示されました。
そこで、肺線維化を細胞レベル・分子レベルでさらに詳しく評価するため、フローサイトメトリー[8]という手法でマウスのⅡ型肺胞上皮細胞だけを取り出し、それを3次元的に培養することで肺胞オルガノイドを作製し、肺線維芽細胞との相互作用を調べることにしました(図2)。
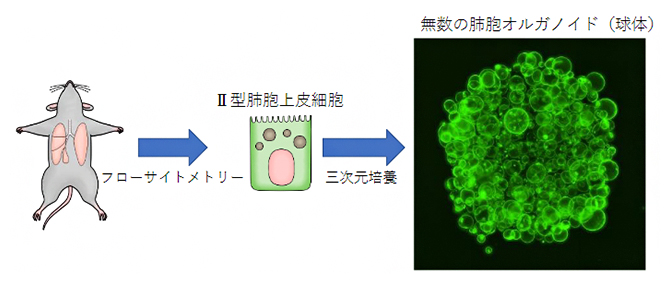
図2 肺胞オルガノイドの作製
マウスの肺からフローサイトメトリーを用いてⅡ型肺胞上皮細胞を取り出し、それを3次元培養することで、右のような球体である肺胞オルガノイド(直径約2mm)が形成される。
肺線維症を再現するため、肺胞オルガノイド培養の培地にブレオマイシンを添加してDNAダメージを与え、その後マウス肺線維芽細胞を同じ培養皿で培養しました。このマウス肺線維芽細胞には、筋線維芽細胞へ分化すると赤い蛍光を発するレポーター遺伝子[9]をあらかじめ組み込んでいます。この実験系により、上皮に障害を受けたオルガノイドの周囲の肺線維芽細胞が筋線維芽細胞に誘導される様子をライブイメージングすることに成功しました(図3)。
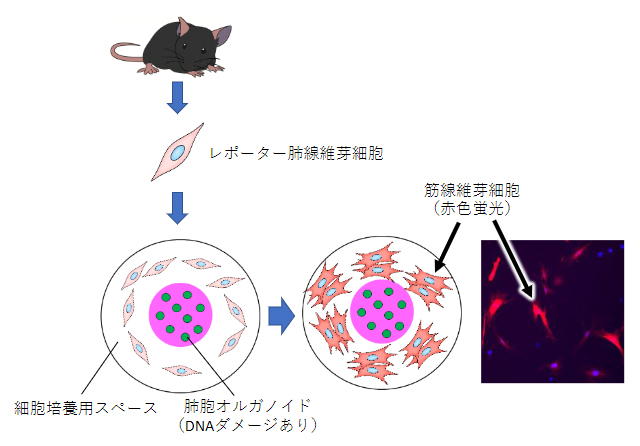
図3 上皮障害による線維化誘導のライブイメージング
肺胞オルガノイドにブレオマイシンを作用させDNAダメージを誘導し、その後に肺線維芽細胞をともに培養することで、筋線維芽細胞への分化をライブイメージングしている。筋線維芽細胞への分化は、赤色蛍光タンパク質を組み込んだレポーター遺伝子の発現でモニターした。
次に、DNAダメージを受けたⅡ型肺胞上皮細胞が線維化誘導能を獲得するプロセスを明らかにするため、肺胞オルガノイドで発現する遺伝子を網羅的に解析しました。その結果、ブレオマイシン投与によりDNAダメージを受けたオルガノイドでは、細胞老化の代表的シグナルであるp53シグナル[10]が高まっていることが分かりました。そこで、p53シグナルを高める薬剤で肺胞オルガノイドを処理したところ、ブレオマイシンを投与しなくても周囲の肺線維芽細胞が筋線維芽細胞に誘導されることが観察されました。これは、p53シグナルを受けて分泌される因子が、線維化の誘導に関わっていることを示唆しています。
p53シグナルと肺胞オルガノイドの関係をさらに詳しく調べた結果、Ⅱ型肺胞上皮細胞においてp53シグナルが高まると、「AT2-AT1遷移様状態」と呼ばれる、細胞分化の中間状態に相当し、細胞老化に特徴的な遺伝子を一過的に発現する細胞とよく似た細胞状態へと変化することが分かりました。この細胞状態になると、SASP(Senescence-Associated Secretory Phenotype: 細胞老化関連分泌現象)と総称される現象により、老化細胞に特徴的なタンパク質が分泌されます。そこで、SASPのタンパク質群の中から筋線維芽細胞を誘導する因子を探索したところ、TGFβが該当することが分かりました。Ⅱ型肺胞上皮細胞から周囲へと分泌されるTGFβは、オートクライン[11]としてⅡ型肺胞上皮細胞自身にも作用し、TGFβの発現と活性化を増幅する、いわゆるポジティブフィードバック現象が起きていました(図4)。また、Ⅱ型肺胞上皮細胞が「AT2-AT1遷移様状態」に変化するにはTGFβの活性化で十分であったことから、Ⅱ型肺胞上皮細胞におけるTGFβのポジティブフィードバックこそが、炎症に依存しない肺線維症の中心的機構であると結論付けました。
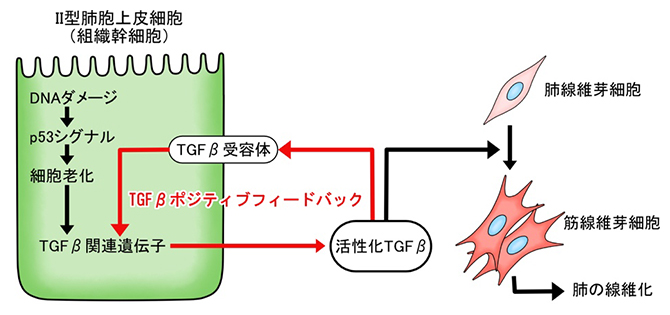
図4 Ⅱ型肺胞上皮細胞が起点となった、炎症に依存しない肺線維化誘導プロセスの機序
DNAダメージを受けたⅡ型肺胞上皮細胞では、p53シグナルが高まり細胞老化が起こる。これによりⅡ型肺胞上皮細胞は線維化誘導性の状態に変化し、TGFβを分泌するようになる。TGFβは周囲の肺線維芽細胞を筋線維芽細胞へ分化させるとともに、分泌元のⅡ型肺胞上皮細胞自身にも作用し、さらにその線維化誘導能力を高めている。
最後に、これらの現象がヒトの肺でも見られるのかを検証するため、切除手術を受けたヒト肺組織からⅡ型肺胞上皮細胞を取り出し、オルガノイドを用いた同様の実験を行いました。その結果、ヒトの肺細胞を用いた場合でも、TGFβのポジティブフィードバックが存在し、炎症に依存しない筋線維芽細胞の誘導を確認できました。
今後の期待
IPFに対して認可された治療薬剤は、2023年現在2種類のみであり、その効果も残念ながら疾患進行抑制までにとどまっています。これらの薬剤は肺線維芽細胞および筋線維芽細胞を主たる治療標的としていますが、共同研究グループが肺線維化オルガノイドモデルで改めて検証したところ、やはり筋線維芽細胞の誘導を抑制することはできませんでした。
今回の研究から、Ⅱ型肺胞上皮細胞でのTGFβポジティブフィードバックの成立が肺線維症の中心的機構であることが示されました。これはIPFの病態形成における上皮の重要性とこれに対する治療の可能性を示したものであり、IPFの新たな治療薬の探索に貢献するものと期待されます。
補足説明
1.肺胞オルガノイド
肺胞上皮細胞を3次元的に培養して作製される疑似肺胞組織。オルガノイド技術は近年さまざまな臓器・組織の研究で応用されている。
2.肺線維症、特発性肺線維症(IPF)
肺線維症は、肺胞の間質にコラーゲンなどの線維状タンパク質が異常に蓄積することで、肺胞のガス交換機能が妨げられる疾患の総称。特発性肺線維症は、原因不明で肺に線維化が起こる代表的疾患である。症状は数カ月から数年にわたって発現し、労作時呼吸困難、咳、および進行性の肺機能低下が特徴的である。IPFはidiopathic pulmonary fibrosisの略。
3.Ⅱ型肺胞上皮細胞、Ⅰ型肺胞上皮細胞
肺の末梢に存在する肺胞は、Ⅰ型とⅡ型の2種類の上皮細胞から構成される。Ⅱ型肺胞上皮細胞は肺胞上皮の組織幹細胞であり、分化細胞であるⅠ型肺胞上皮細胞を生み出す能力を持つ。Ⅰ型肺胞上皮細胞は非常に薄く、肺胞内の空気中の酸素と、Ⅰ型肺胞上皮の裏に位置する血管内の二酸化炭素が交換される場を提供している。
4.組織幹細胞
身体のさまざまな組織にもともと存在する未分化な細胞(さまざまな細胞に分化できる能力がある細胞)のこと。組織の維持再生に寄与している。
5.TGFβ
細胞外に分泌され、組織発生・細胞分化・胚発生などにおいて重要な役割を果たす増殖因子。TGFはtransforming growth factorの略。
6.ポジティブフィードバック
ある遺伝子あるいはタンパク質の発現量が増大したとき、その結果を受けてさらに発現量が増大していく状態。
7.肺線維芽細胞、筋線維芽細胞
線維芽細胞は結合組織を構成する主要な細胞で、コラーゲンなどの細胞外マトリックスや増殖因子を大量に分泌するなどの機能がある。肺線維芽細胞が病的な状態に陥ると筋線維芽細胞となり、平滑筋組織で見られる平滑筋アクチンを発現し、細胞が大きく、固くなるとともに、コラーゲンを多く発現する。
8.フローサイトメトリー
蛍光レーザーを利用して、不均一な混合液中の細胞の解析や選別をする技術。
9.レポーター遺伝子
細胞の特徴的な状態をモニターする外来遺伝子。遺伝子工学技術を使って蛍光タンパク質をコードするレポーター遺伝子を導入することで、細胞が放つ蛍光を使った検出を行うことができる。
10.p53シグナル
p53はがん抑制遺伝子が作るタンパク質として同定された。実際にはがん抑制機能以外に細胞分化制御、細胞増殖制御、細胞死の制御、細胞老化など多様な働きをする核内タンパク質であり、細胞が受けるストレスなどの刺激を受けて、さまざまな遺伝子の発現を制御している。ここでは、p53を中心とした細胞応答経路をp53シグナルと表現する。
11.オートクライン
細胞から分泌された因子が、分泌した細胞自身に作用すること。
共同研究グループ
理化学研究所 生命機能科学研究センター 呼吸器形成研究チーム
研究員(研究当時)榎本 泰典(エノモト・ヤスノリ)
(現 客員研究員、浜松医科大学 再生・感染病理学講座 助教)
チームリーダー 森本 充(モリモト・ミツル)
研究員 桂 廣亮(カツラ・ヒロアキ)
客員研究員 藤村 崇(フジムラ・タカシ)
(大塚製薬株式会社 大阪創薬研究センター 創薬モダリティ研究所 研究員)
神戸大学医学部附属病院
呼吸器内科
講師 永野 達也(ナガノ・タツヤ)
助教 羽間 大祐(ハザマ・ダイスケ)
呼吸器外科
教授/病院長 眞庭 謙昌(マニワ・ヨシマサ)
病院准教授 田中 雄悟(タナカ・ユウゴ)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業若手研究「オルガノイド技術を用いて、肺胞上皮細胞老化を標的とした肺線維症新規薬剤を探索する(研究代表者:榎本泰典)」、同挑戦的研究(萌芽)「肺線維症で起こる損傷―再生―炎症―線維化プロセスを再現する肺胞オルガノイドの開発(研究代表者:森本充)」、岡本敏記念肺線維症研究基金助成金(研究代表者:榎本泰典)、理化学研究所基礎科学特別研究員制度(榎本泰典)、G-7奨学財団助成金(研究代表者:森本充)、理研生命機能科学研究センター(BDR)オルガノイドプロジェクト(研究代表者:森本充)による助成を受けて行われました。
原論文情報
Yasunori Enomoto, Hiroaki Katsura, Takashi Fujimura, Akira Ogata, Saori Baba, Akira Yamaoka, Miho Kihara, Takaya Abe, Osamu Nishimura, Mitsutaka Kadota, Daisuke Hazama, Yugo Tanaka, Yoshimasa Maniwa, Tatsuya Nagano, Mitsuru Morimoto, “Autocrine TGF-β-positive feedback in profibrotic AT2-lineage cells plays a crucial role in non-inflammatory lung fibrogenesis”, Nature Communications, 10.1038/s41467-023-40617-y
発表者
理化学研究所
生命機能科学研究センター 呼吸器形成研究チーム
研究員(研究当時)榎本 泰典(エノモト・ヤスノリ)
(現 客員研究員、浜松医科大学 再生・感染病理学講座 助教)
チームリーダー 森本 充(モリモト・ミツル)
神戸大学医学部附属病院 呼吸器内科
講師 永野 達也(ナガノ・タツヤ)
報道担当
理化学研究所 広報室 報道担当
神戸大学 総務部広報課
浜松医科大学 総務課広報室

