2023-11-30 東京大学
山之内 大地(生物科学専攻 博士課程)
木瀬 孔明(生物科学専攻 特任准教授)
濡木 理(生物科学専攻 教授)
糟谷 豪(自治医科大学 助教)
中條 浩一(自治医科大学 教授)
発表のポイント
- 電位・Ca2+依存性カリウムチャネルSlo1とその制御サブユニットγ1の複合体の立体構造を決定した。
- 制御サブユニットγ1がSlo1の電位・Ca2+依存性の両方を制御する機構が構造・電気生理学的解析から明らかになった。
- イオンチャネルを標的とした薬剤開発は副作用の強さから困難とされている。本研究の成果はイオンチャネルと制御サブユニットの理解を深めると同時により副作用の少ないイオンチャネル標的薬剤の開発に貢献できると期待できる。
制御サブユニットによるイオンチャネルの二成分制御
発表概要
東京大学大学院理学系研究科生物科学専攻の山之内大地大学院生、木瀬孔明特任准教授、濡木理教授らは、クライオ電子顕微鏡(注1)を用いて、電位・Ca2+依存性カリウムチャネル(注2)Slo1とその制御サブユニット(注3)であるγ1の複合体立体構造を決定しました。自治医科大学の糟谷豪助教、中條浩一教授らと共同研究のもと、電気生理学的解析を組み合わせることによって制御サブユニットγ1がSlo1の電位・Ca2+依存性の二成分両方を制御するメカニズムを初めて明らかにしました。このような電位とCa2+の二成分制御のメカニズムはこれまでに報告がなく、新規の制御機構になります。本研究成果はイオンチャネルの構造基盤の解明のみならず、チャネル依存の疾患への治療薬の開発などにつながることが期待できます。
発表内容
〈研究の背景〉
多くの電位依存性イオンチャネル(注4)は、制御サブユニットと複合体を形成することで電位依存性やゲートの開閉のキネティクス(注5)に調整(モジュレーション(注6))を受けることでチャネル単独とは異なる活性を示します。イオンチャネルは神経細胞などを中心に生体内で不可欠な役割を担っているため、学術的・医学的に非常に関心の高い研究対象です。このようなモジュレーションのメカニズムの研究は、イオン選択性や電位依存性の研究と比べて進んでおらず、未解明な点の多い分野です。
電位・Ca2+依存性カリウムチャネルSlo1は、興奮性細胞では膜電位・Ca2+濃度の変化に応答してカリウムイオンを放出することで活動電位の再分極(注7)を促します。一方で、上皮分泌細胞などの膜電位が一定の非興奮性細胞では、Slo1はγ1制御サブユニットと複合体を作ることで静止膜電位でCa2+非存在下でも活性化が可能になり生理活性物質の分泌に重要な役割を果たします。γサブユニット・ファミリーが如何にしてSlo1の電位・Ca2+依存性を制御しているのかについてはこれまで不明でした。
〈研究の内容〉
今回、東京大学大学院理学系研究科の濡木理教授らのグループはクライオ電子顕微鏡を用いてSlo1-γ1複合体の立体構造を野生型及びCa2+センサー変異型4種において決定することに成功しました(図1)。さらに、γ1がこれまで報告されていた電位依存性だけではなく、Ca2+依存性も制御することが初めて分かりました。そこで、γ1がSlo1の電位とCa2+両者の依存性を制御する機構を構造と機能から解析しました。
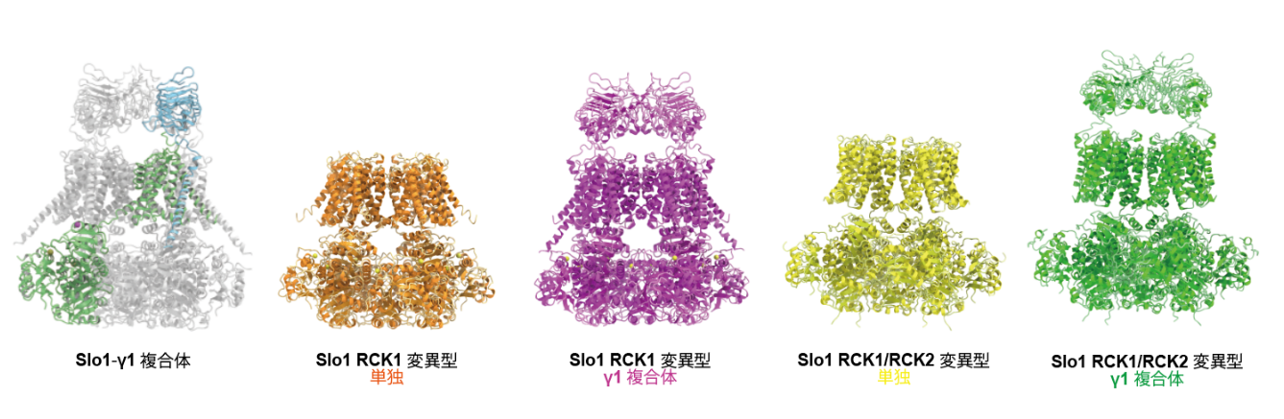
図1: 本研究で決定した野生型・変異型Slo1単独、Slo1-γ1複合体構造。
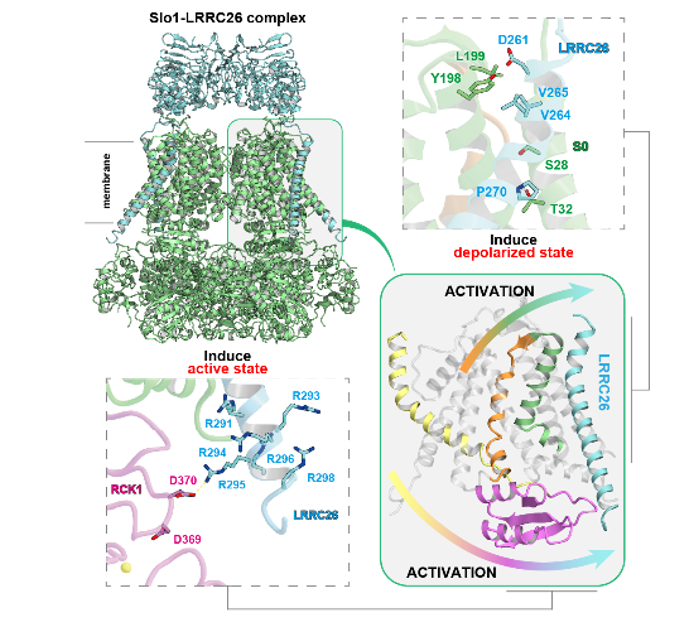
野生型Slo1-γ1複合体構造から、γ1がSlo1の電位依存性を担う膜貫通領域の電位センサードメイン(VSD)とCa2+依存性を担う細胞内Ca2+センサードメイン(RCK1)に相互作用をすること分かりました。膜貫通領域では、電位依存性の中心的役割を持つS4ヘリックスの周辺のS0からS3ヘリックスの構造を安定化し、さらに特にS3との相互作用を介してS4ヘリックスを活性化型状態に誘導することが示唆されました(図2)。
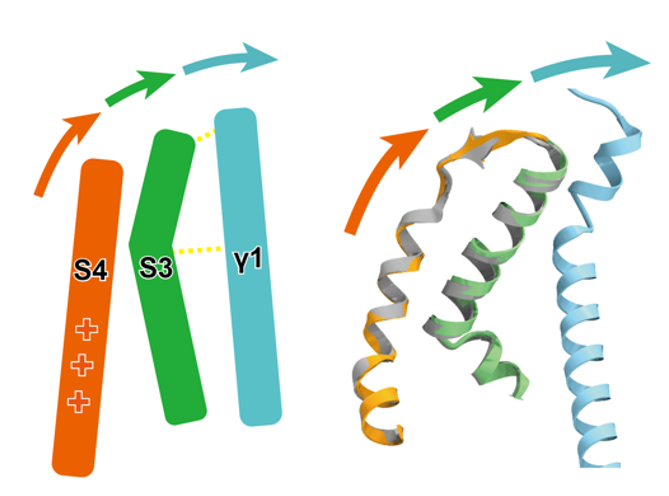
図2: γ1(水色)はS3ヘリックス(緑色)を介してS4ヘリックス(橙色)を 活性化型状態に誘導する。左は模式図
また、細胞内ドメインではγ1の機能に重要なアルギニン・クラスターがSlo1のRCK1のアスパラギン酸残基と相互作用することによってRCK1を活性化状態へと誘導していることが示唆されました(図3 )。
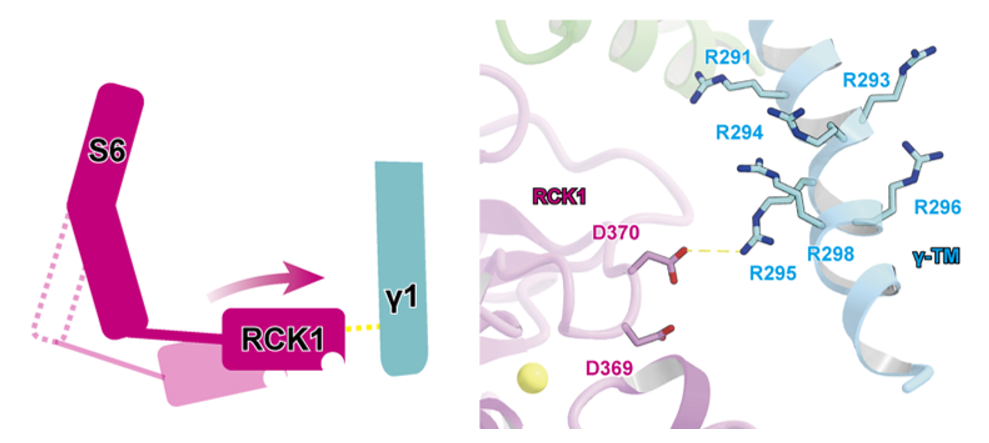
図3: γ1(水色)は細胞内のアルギニン・クラスターによってSlo1のRCK1を 活性化型状態に誘導する。左は模式図。 黄色:Ca2+
実際に、Ca2+結合部位に変異を入れたSlo1のRCK1変異体においては、γ1と複合体を形成した場合にのみ、RCK1ドメインが活性化型状態を取ることが分かりました。さらに、Slo1とγ1の膜および細胞内相互作用部位に変異を導入し、電気生理学的解析を行うことによって、構造情報から可視化されたSlo1とγ1との相互作用が電位およびCa2+依存性の制御に必要であることが、自治医科大学医学部の中條浩一教授、糟谷豪助教との共同研究によって明らかになりました(図4、5)。
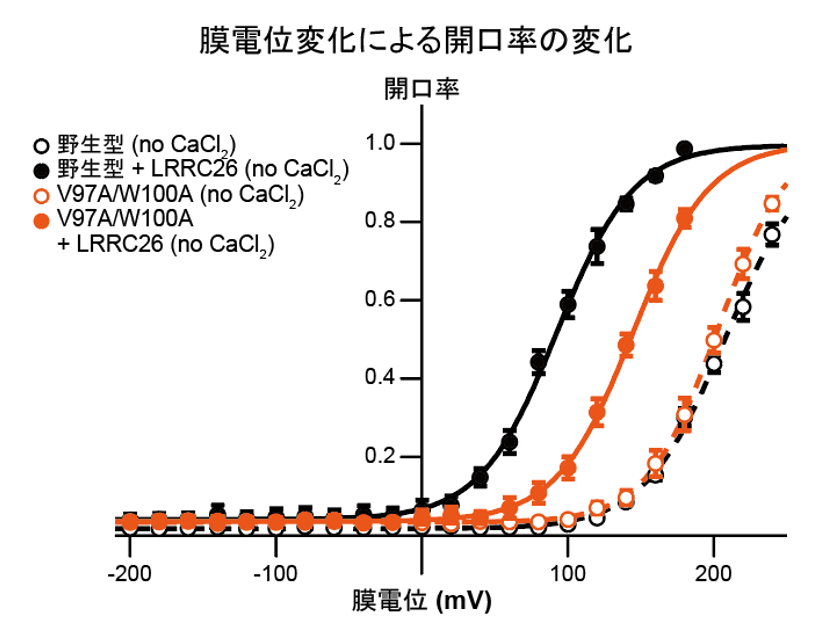
図4:γ1がSlo1と複合体を形成することでより低電位での活性化が可能だが(黒線)、膜貫通領域での相互作用部位に変異を加えるとモジュレーションの影響が減少する(橙線)。
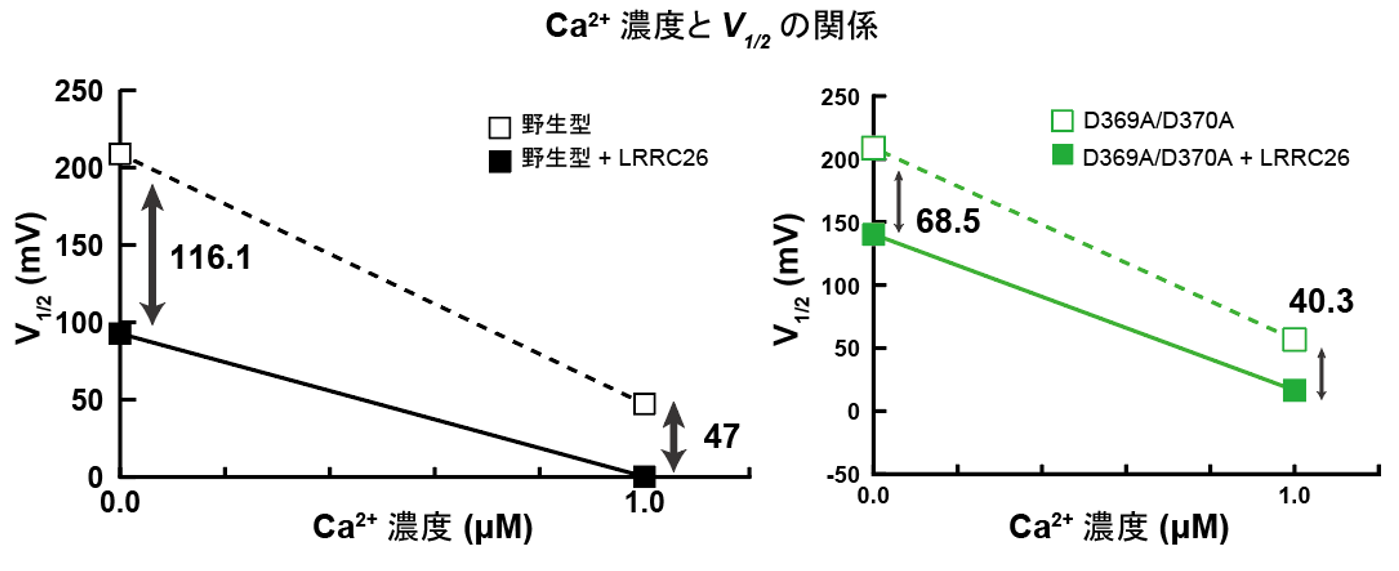
図5:野生型では細胞内にCa2+が存在することで、相乗的にSlo1が活性化される(左図)。一方で変異型Slo1では、Ca2+による活性化の影響が低減していた(右図)。V1/2は電位依存性イオンチャネルの半分が活性化される電位を示す。
本研究は、電位・ Ca2+依存性イオンチャネルのモジュレーション機構を世界で初めて明らかにしました。ひとつの制御サブユニットがイオンチャネルの二成分依存性を制御する機構について、新たなモデルを提示しました。
てんかんや心臓病などに代表される遺伝子疾患の原因遺伝子としてイオンチャネルが多く見出されています。そのため、近年イオンチャネルを標的とした薬剤開発が進められています。しかし、イオンチャネル標的薬剤では副作用の強さが課題となっています。今回の研究成果は、イオンチャネルの構造基盤と制御サブユニットによるモジュレーション機構について新たな知見を与えると同時に、より副作用を抑えたイオンチャネル標的薬剤の開発の一助になると期待できます。
論文情報
- 雑誌名
Molecular Cell論文タイトル
Dual allosteric modulation of voltage- and calcium-sensitivity of Slo1-LRRC channel complex著者
Daichi Yamanouchi*, Go Kasuya*, Koichi Nakajo, Yoshiaki Kise**, and Osamu Nureki**
(*筆頭著者、**責任著者)
研究助成
本研究は、日本学術振興会における科学研究費助成事業の特別推進研究「物理刺激で制御される膜蛋白質の分子機構の解明」(課題番号:16H06294 研究代表者:濡木理)や基盤研究(B)「イオンチャネル巨大複合体のモジュレーション機構」(課題番号:22H02555 研究代表者:木瀬孔明)、「心臓で発現する新規イオンチャネル修飾サブユニットの機能解明とその機能多様性の理解」(課題番号:23H02666 研究代表者:糟谷豪)、CREST「細胞内現象の時空間ダイナミクス」(課題番号:20344981 研究代表者:濡木理)、AMED 「シナプスタンパク質の品質管理と神経変性疾患における破綻機構の解明」(課題番号:JP22gm6410026 研究代表者:木瀬孔明)、JST 次世代研究者挑戦的研究プログラムJPMJSP2108などの一環で行われました。また、本研究は、国立研究開発法人日本医療研究開発機構(AMED)「創薬等ライフサイエンス研究支援基盤事業」の一環として、クライオ電子顕微鏡などの大型施設の外部開放を行うことで優れたライフサイエンス研究の成果を医薬品等の実用化につなげることを目的とした「創薬等先端技術支援基盤プラットフォーム(BINDS)」の支援により行われました。
用語解説
注1 クライオ電子顕微鏡
液体窒素(-196℃)冷却下でタンパク質などの分子に対して電子線を照射し、試料の観察を行うための装置。タンパク質や核酸の立体構造の決定に利用されている。
注2 電位・Ca2+依存性カリウムチャネル
細胞膜内外の電位差(膜電位)の変化と細胞内のCa2+濃度を感知し、イオンの通り道を開閉する膜タンパク質。7本の膜貫通領域(S0-S6)からなり、S0-S4が電位センサードメイン、S5-S6がカリウムイオンを通すゲートとポアドメインを形成する。興奮していない静止状態の細胞では細胞外を0mVとしたときに細胞内は約-70mVの電位差(静止膜電位)がある。静止膜電位付近ではチャネルは閉じているが、細胞が電気信号を受け取り膜電位が正方向に変化すると、電位センサードメインの構造変化が起こる。また、細胞内にはRCK1と呼ばれるCa2+結合領域が存在する。このRCK1へのCa2+の結合と電位変化は相乗的に活性化を誘導する。これらの電位センサードメインとRCK1の活性化によってポアと呼ばれるイオンを通過させる穴が開かれる。
注3 制御サブユニット
イオンチャネルのポアを形成するコアサブユニットと複合体を形成し、イオンチャネルの細胞内局在や、電位依存性、チャネル開閉の速度 などのチャネルの特性を制御するタンパク質。
注4 電位依存性イオンチャネル
細胞膜は脂質二重膜によって構成されており、イオンは透過できない。イオンチャネルは神経や筋細胞を中心に膜電位の変化によって活性化され、イオンの通り道を開閉する膜タンパク質の一種。
注5 キネティクス
ある状態から異なる状態へと移行する速度のこと。例えば、電位依存性イオンチャネルは膜電位に応じて静止状態、活性化状態、不活性化状態を取り、それらの状態間の移行速度のこと。
注6 モジュレーション
イオンチャネルの電位依存性やチャネル開閉のキネティクスを変化させること。
注7 再分極
神経細胞などでは通常、細胞内がマイナスの電荷を帯びている(静止状態)。そこに刺激を受けると陽イオンが細胞内に流入し、細胞内はプラス側に変化する(活性化状態)。Slo1は細胞内のカリウムイオンを細胞内から流出することで活性化状態から静止状態へ回復させる。これを再分極と呼ぶ。