2018-08-31 国立大学法人 熊本大学,国立研究開発法人 日本医療研究開発機構
ポイント
- 腎臓のろ過膜を構成するネフリンに変異をもつ先天性ネフローゼ症候群の患者さんの皮膚からiPS細胞を樹立した。
- 患者さん由来のiPS細胞から誘導した腎臓組織において、ネフリンの細胞表面への移行とろ過膜の形成に異常がみられた。つまりこの先天性腎臓病の初期病態をiPS細胞で再現することに成功した。
- これらの異常は、ネフリンの変異を修復することによって正常化した。よって、この変異が病気を起こす原因であり、それを元に戻すと治療できる可能性を示した。
要旨
熊本大学発生医学研究所の西中村隆一教授らの研究グループは、先天性腎臓病患者さん由来のヒトiPS細胞※1から腎臓組織を誘導することによって、病態を再現することに成功しました。
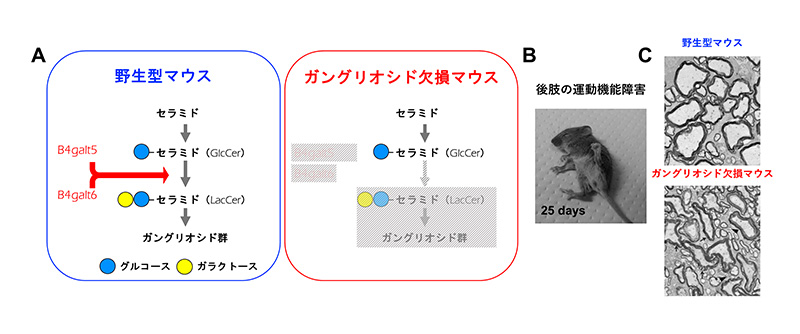
腎臓は血液中の老廃物をろ過して排出する臓器ですが、その際に血液中の蛋白質は尿中には漏れないようになっています(図1参照)。これを司るのが糸球体※2のポドサイト※3に存在するろ過膜(スリット膜)であり、ネフリン※4という物質がその主な構成要素です。そのため、ネフリンに遺伝子変異があると、血液中の蛋白質が尿に大量に漏れ、先天性のネフローゼ症候群※5を呈します。根治的治療は困難であり、ろ過膜を人工的に再現する手法がないことが研究進展のボトルネックになっていました。
西中村隆一教授らの研究グループは2014年に、ヒトiPS細胞から腎臓組織を試験管内で誘導することに成功しました。さらに2016年には、iPS細胞から誘導した糸球体ポドサイトがネフリンを発現していること、誘導の途中にマウスに移植するとポドサイトがより成熟することを証明しました。そこで今回、谷川俊祐助教、Mazharul Islam(マジハール イスラム)さん(大学院生)らが、これらの方法を先天性腎臓病の患者さん由来のiPS細胞に応用しました。
まず、ネフリンに1ヶ所だけ変異をもつ先天性ネフローゼ症候群の患者さんの皮膚からiPS細胞を樹立しました(図2参照)。そこから試験管内で腎臓組織を誘導したところ、本来糸球体ポドサイトの表面に存在すべきネフリンが細胞内に留まり、ろ過膜の前駆体をほとんど作れないことがわかりました(図3 A参照)。誘導の途中でマウスに移植すると、通常はポドサイトの成熟が進んで、ネフリンが血管側に移動してくるのですが、患者さん由来のものではそれも障害されていました(図3 B参照)。つまり、この先天性腎臓病の初期病態をiPS細胞によって再現したことになります。さらに、患者さん由来のiPS細胞でネフリン変異を修復してから腎臓組織に誘導したところ、上記の異常は正常化しました(図4参照)。つまり、このたった1つの変異が病気を起こす原因であり、この変異を修復すると治療ができる可能性を示しました。
本研究は、患者さん由来のiPS細胞を使って糸球体性腎疾患の病態を再現した初めての例であり、病因の解明と創薬開発につながることが期待されます。本研究成果は、米国科学雑誌「Stem Cell Reports」オンライン版に8月30日11:00(アメリカ東部時間)【日本時間の8月31日0:00 AM】に掲載されます。
※本研究は、熊本大学の江良択実教授と仲里仁史教授、順天堂大学の栗原秀剛准教授、琉球大学の中西浩一教授、広島大学の山本卓教授らとの共同研究です。文部科学省科学研究費補助金、日本医療研究開発機構の再生医療実現拠点ネットワークプログラム「疾患特異的iPS細胞を用いた遺伝性腎疾患の病態解明拠点」および再生医療実用化研究事業「外来因子フリー難病由来iPS細胞のライブラリー構築とそれを使った疾患モデルと薬剤開発」の支援を受けました。
研究の背景
腎不全による人工透析患者数は増加傾向がつづき、医療費増大の一因ともなっていますが、腎移植の機会は限られています。一方で腎臓を作ることは極めて困難とされていましたが、熊本大学発生医学研究所の研究グループは2014年に、ヒトiPS細胞から試験管内で腎臓組織の作製に成功しました。これは世界初の報告であり、腎臓の再生医療の新しい扉を開ける成果でした。さらに2016年には、iPS細胞から誘導した糸球体のポドサイトがネフリンを強く発現していること、ポドサイトへの誘導の途中でマウスに移植するとヒト糸球体がマウス血管と繋がり、ポドサイトの成熟が進むことを見出しました。そこで今回は、これらの技術を患者さん由来のiPS細胞に応用することにしました。
先天性ネフローゼ症候群は生後3ヶ月以内に大量の蛋白尿を呈し、血液中の蛋白質の低下によって全身の浮腫が起こり、2-3年内に腎不全となることが多い病気です。この原因の一つにネフリンの異常があります。ネフリンは糸球体ポドサイトの細胞表面に存在する物質で、隣り合った細胞のネフリン同士が組み合って篩(ふるい)を形成しています。これをろ過膜(正式にはスリット膜)と呼びますが、その篩の穴が非常に小さいので、血液中の大きな蛋白質は尿に漏れないようになっています(図1参照)。そのためネフリンが欠損する場合や、一つのアミノ酸配列に異常があるだけでも、ろ過膜の形成が不完全になり、蛋白尿を呈すると考えられています。しかし、出生直後には既に大量の蛋白尿を呈するこの病気が、胎児期のいつからどのように発症するのかははっきりわかっていません。また人間の遺伝子配列には多くの個人差が存在し、ネフリンも例外ではありません。そのため、患者さんのネフリンの配列を解読していくつかの違いを見つけても、そのどれが病気を起こす本当の原因なのか、そしてその変異がどのようなメカニズムで病気を起こすのかを同定することが難しいのです。培養細胞やマウスを使った研究は長年行われてきましたが、ろ過膜を人工的に再現する方法が存在しないことが研究進展の障害になっていました。そこで今回は、ネフリンの一つのアミノ酸に変異をもつ患者さんからiPS細胞を樹立し、発症初期の病態を再現できるか、どういうメカニズムが働いているのか、その変異が本当に病気の原因なのか、だとしたらその変異の修復によって症状が消失するのか、を検討しました。
研究の内容
まず、先天性ネフローゼ症候群の患者さんの中からネフリンに変異をもつ方を見つけ出しました。遺伝子配列解析の結果、1ヶ所だけに変異があり、そのためアミノ酸が1つだけ通常とは異なることがわかりました。この患者さんから皮膚の細胞をいただき、iPS細胞を樹立しました(図2参照)。
患者さん由来のiPS細胞と正常のiPS細胞から、試験管内で約1ヶ月かけて腎臓組織を誘導しました。正常な腎組織では、糸球体ポドサイトの細胞表面にネフリンが存在し、細胞と細胞の間にネフリンが集積したろ過膜の前駆体と思われる点状の構造が認められました。しかし患者さん由来のiPS細胞からの腎組織では、ネフリンは細胞内に留まり、ろ過膜前駆体もほとんど見られませんでした(図3 A参照)。
iPS細胞からの誘導の途中でマウスに移植すると、正常ではネフリンがポドサイトの血管側に集まって線状の構造をとるようになります(図3 B)。それとともにポドサイトの細胞突起が複雑化して、突起と突起の間隔が広がります。これがろ過膜の形成過程を示していると考えられます。しかし、患者さん由来のものではネフリンは相変わらず細胞内に留まりました。突起はできたものの、突起と突起の間隔は狭いままで、ろ過膜の形成が起きないことを示していました。よって、先天性ネフローゼ症候群の患者さんの発症初期の病態を、iPS細胞を使って示すことができたことになります。
さらにゲノム編集という技術を使って、患者さん由来のiPS細胞でネフリンの変異を修復しました。それを腎臓組織に誘導したところ、ろ過膜の前駆体が復活しました(図4参照)。またマウスに移植すると、ポドサイトの突起の間隔が開き、ろ過膜が形成されつつあることがわかりました。つまり、このたった1つの変異が病気を起こす原因であることが証明されたと同時に、これを元に戻すと治療ができる可能性も示されたことになります。本研究は、患者さん由来のiPS細胞を使って糸球体性腎疾患の病態を再現した初めての例です。
今後の展開
先天性ネフローゼ症候群の病態が再現できたことで、このポドサイトを使って治療薬の探索ができる可能性があります。また他のタイプの変異の患者さんからiPS細胞を作れば、それぞれの病気のメカニズムが判明し、それに合わせた薬を探せる可能性もあります。
先天性ネフローゼ症候群は稀な病気ですが、今回の成果の対象はそこに留まりません。小児期のネフローゼはもちろん、成人で腎臓病が発症する場合も蛋白尿で始まることが多く、ろ過膜、つまりネフリンに何らかの障害が生じる可能性が指摘されています。ネフリンの動態を制御する薬がみつかれば、腎臓病に広く効く可能性も出てきます。従って、今回の成果は、ポドサイトに作用して蛋白尿を減らす薬の開発に向けた大きな前進といえます。
参考図
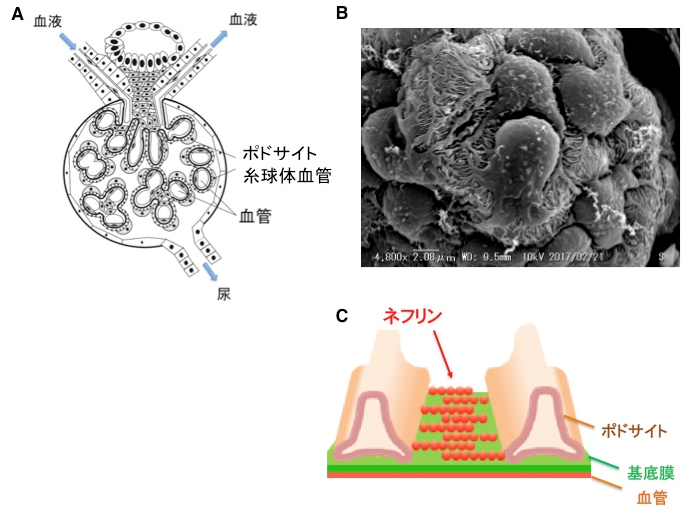
図1.糸球体ポドサイトとろ過膜
A:糸球体の構造
B:ポドサイトの拡大写真。多数の突起をもつ。
C:ポドサイトの突起間に存在するろ過膜の模式図。ろ過膜の主成分であるネフリンが、篩を形成する。
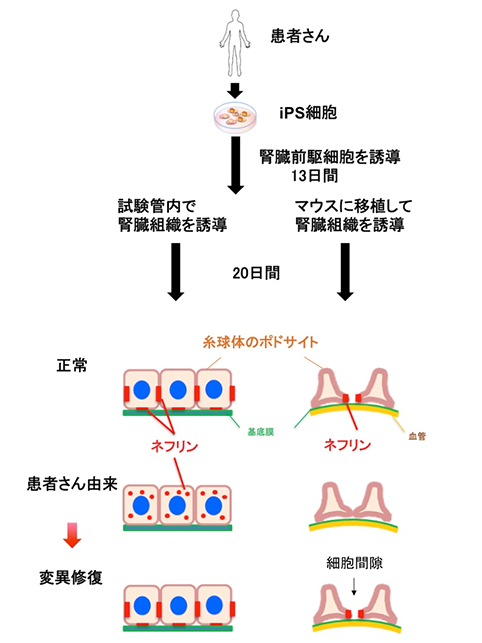
図2.患者さん由来のiPS細胞から誘導されたポドサイトの異常(まとめ)
iPS細胞から腎臓前駆細胞(元になる細胞)を誘導し、さらに試験管内で、あるいは移植して、合計約1ヶ月(13日+20日)かけて腎臓組織を誘導した。
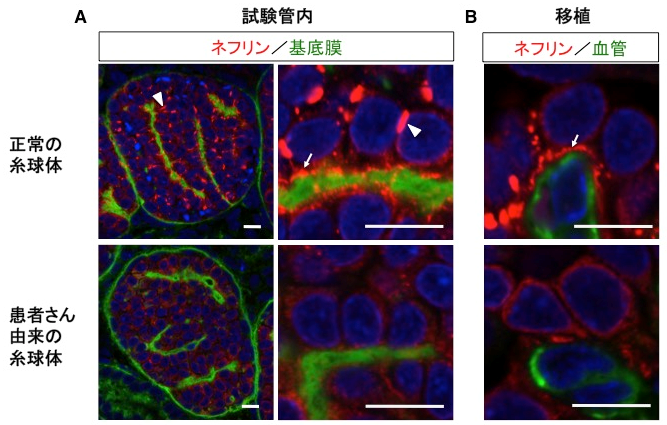
図3.患者さん由来のポドサイトではろ過膜前駆体が減少している
A:試験管内で誘導した糸球体とポドサイト
B:マウス移植後のポドサイト
正常ではポドサイトの側面や底面に存在するろ過膜前駆体(それぞれ矢頭、矢印)が、患者さん由来ではほとんど認められない
スケールバー:10μm
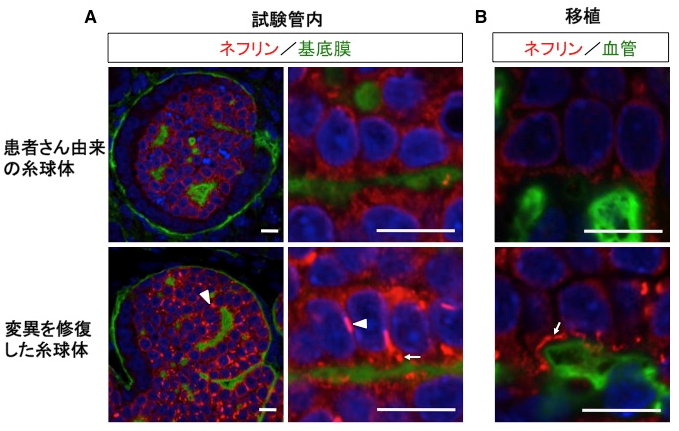
図4.変異の修復によって回復したろ過膜前駆体
A:試験管内で誘導した糸球体とポドサイト
B:マウス移植後のポドサイト
変異を修復したiPS細胞由来の糸球体では、ポドサイトの側面や底面にろ過膜前駆体(矢頭、矢印)が回復する。
スケールバー:10μm
用語解説
- ※1 iPS細胞:
- 皮膚や血液などの体細胞から作られた万能細胞
- ※2 糸球体:
- 腎臓内で血液から尿をろ過する部位
- ※3 ポドサイト:
- 糸球体のろ過機能を司る細胞。複雑な突起と特殊なろ過膜をもつ。
- ※4 ネフリン:
- ポドサイトのろ過膜を構成する主要なタンパク質
- ※5 ネフローゼ症候群:
- 糸球体の異常によって血液中の蛋白質が尿中に漏れ出てしまう病気。先天性の場合は、生後3ヶ月以内に大量の蛋白尿を呈し、血液中の蛋白質の低下によって全身の浮腫が起こり、2-3年内に腎不全となることが多い。ネフリンの変異による先天性ネフローゼ症候群は、フィンランドで特に頻度が高い(8,200人に一人)。
論文
Organoids from nephrotic disease-derived iPSCs identify impaired NEPHRIN localization and slit diaphragm formation in kidney podocytes
Stem Cell Reports on line Aug 30, 2018
Shunsuke Tanigawa, Mazharul Islam, Sazia Sharmin, Hidekazu Naganuma, Yasuhiro Yoshimura, Fahim Haque, Takumi Era, Hitoshi Nakazato, Koichi Nakanishi, Tetsushi Sakuma, Takashi Yamamoto, Hidetake Kurihara, Atsuhiro Taguchi, and Ryuichi Nishinakamura
お問い合わせ先
熊本大学発生医学研究所 腎臓発生分野
教授 西中村 隆一(にしなかむら りゅういち)
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 再生医療研究課