2024-03-01 理化学研究所,東京工業大学
理化学研究所(理研)開拓研究本部 田中生体機能合成化学研究室の田中 克典 主任研究員(東京工業大学 物質理工学院 応用化学系 教授)、アンバラ・プラディプタ 客員研究員(同大学 物質理工学院 応用化学系 助教)、大出 雄大 研修生(同大学 物質理工院 応用化学系 博士後期課程2年)、仁科加速器科学研究センター 核化学研究開発室の羽場 宏光 室長らの共同研究グループは、極小サイズのアジド基をがんの分子接着剤として開発し、マウス内のがんにさまざまな放射性核種[1]を効率的に貼り付け、がんを精密に診断・治療する技術を開発しました。
本研究成果は、放射性核種によってがん細胞を特異的に標識し、検出したがん細胞を即時に治療する、がんの早期診断と治療の併用戦略(ラジオセラノスティクス)に貢献すると期待できます。
ラジオセラノスティクスの実用化に向けては、体内で放射性核種が選択的にがんに送達されない場合、あるいはがんに送達されても放射性核種が十分長い時間がんにとどまらない場合に、正常細胞にも放射線が照射されるため、危篤な副作用につながり得ることが課題でした。
今回、共同研究グループは、がんで大量に生産されるアクロレイン(CH2=CHCHO)と反応するアジド基(-N3)をがんに対する極小サイズの接着剤として開発し、放射性核種をがんに選択的に貼り付けることに成功しました。アジド基を持つ放射性錯体をヒト肺がん細胞移植マウスに注射投与したところ、放射性核種ががんに長時間とどまることを可視化できました。さらに、この結果を基に、マウス内のがんを効率的に放射線治療することができました。
本研究は、科学雑誌『Chemical Communications』オンライン版(2月29日付:日本時間3月1日)に掲載されました。
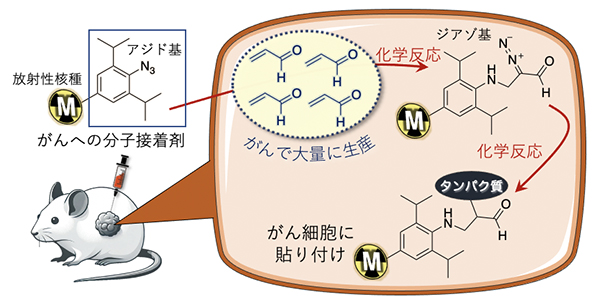
がんへの分子接着剤によるラジオセラノスティクスの概念図
背景
さまざまな放射性核種を用いて、がんを早期に診断し、がんを検出したときには分子特性の近い放射性プローブを使って即時に治療する戦略(ラジオセラノスティクス)が盛んに検討されています。しかし、放射性核種ががん細胞以外に送達されたり、あるいは送達されてもすぐにがん細胞から排出されたりする場合には、正確ながんの診断を行うことができません。また、正常組織が放射線のダメージを受け、さまざまな副作用が引き起こされます。診断精度と治療効果を高め、さらに副作用を低減するために、ラジオセラノスティクスでは放射性核種を高精度かつ迅速にがん細胞に送達することが求められています。
これまでに田中主任研究員らは、がん細胞においてアクロレイン(CH2=CHCHO)が特異的かつ大量に産生されていることを発見しました。さらに、アクロレインとアジド基(-N3)を含む蛍光分子との環化付加から始まるカスケード反応[2]により、がん細胞に目印となる蛍光分子を接着できることを報告しています注1、2)。
そこで本研究では、アジド基をがんへの極小サイズの分子接着剤として活用し、さまざまな放射性核種をがん細胞に結合させることにより、効率的ながんのイメージングと治療、すなわちラジオセラノスティクスの実現を目指しました。
注1)2018年11月28日プレスリリース「有機合成反応で乳がん手術を改革」
注2)2022年1月17日お知らせ「乳がん術中迅速診断多施設臨床研究を行う共同研究を開始」
研究手法と成果
共同研究グループは、極小サイズの分子接着剤として、細胞内でアクロレインと効率的に反応することが分かっている2,6-ジイソプロピルフェニルアジドを用いました注3)。このアジド基を、放射性核種を含む錯体[3]として一般的に用いられるDOTA錯体やDTPA錯体に導入した放射性錯体を開発しました(図1A)。これらの放射性錯体はがん細胞に取り込まれると、がん細胞が産生するアクロレインと化学反応を起こし、ジアゾ基(=N2)を持つジアゾ化合物へと変化します。ジアゾ基が細胞内のタンパク質と速やかに反応し共有結合を形成することで、放射線が長い時間がんにとどまり、がん細胞の検出や殺傷に利用できると予想しました(図1B)。
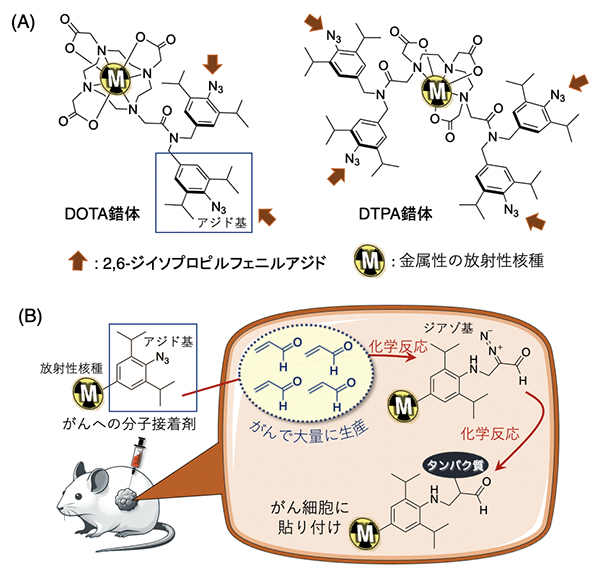
図1 放射性核種を含む錯体の構造とがん細胞への放射性核種の接着機構
(A)DOTA(1,4,7,10-テトラアザシクロドデカン-1,4,7,10-テトラ酢酸)錯体とDTPA(ジエチレントリアミン-N,N,N’,N”,N”-五酢酸)錯体の構造。矢印の箇所に、がん細胞への分子接着剤として機能するアジド基を付加した。
(B)がん細胞内で大量に生産されるアクロレイン(破線内)との化学反応により、錯体に付加したアジド基がジアゾ基に変化する。ジアゾ基とがん細胞内タンパク質が結合することで、放射性核種もがん細胞内に長くとどまる。
この放射性錯体が実際にがんの診断・治療に機能するかを検証するため、ヒト肺がん細胞(A549)を移植したゼノグラフトモデルマウス[4]を用いた実験を行いました。まず、SPECTイメージング[5]に用いられる核種であるインジウム111(111In)を配位させた放射性錯体(アジド基を持たないもの、および二つまたは四つのアジド基を持つもの)を、ゼノグラフトモデルマウスの腫瘍内に投与しました(図2A)。投与の72時間後までイメージングを行った結果、アジド基を持たない放射性錯体は体全体に拡散したのに対して、アジド基の数が多くなるほどがんへの集積が増大することが分かりました。特にアジド基を四つ持つ放射性錯体では、投与の72時間後でも、約50%の放射性錯体ががん組織に残存していました。
これらのイメージングの結果を基に、アジド基を四つ持つ放射性錯体の111Inを、治療用核種であるイットリウム90(90Y)に変えて投与したところ、腫瘍の増大が顕著に抑制され、マウスが長く生存できました(図2B)。治療期間中はマウスの体重が維持され、炎症などの副作用も生じませんでした。
このように、マウス体内のがん細胞にアジド基を用いて放射性核種を貼り付け、精密にがんをイメージングし、治療する効率的なラジオセラノスティクスを実現しました。
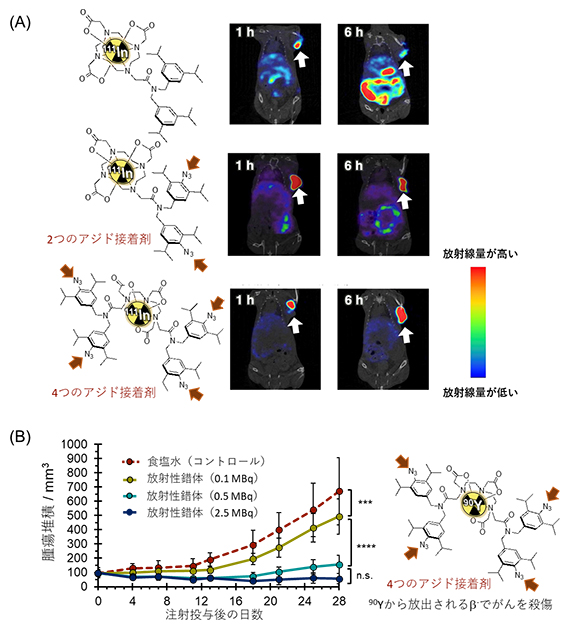
図2 アジド基を接着剤としたがんの放射線イメージングと治療
(A)アジド基なし/アジド基二つ/アジド基四つの111In放射性錯体をそれぞれゼノグラフトモデルマウスのがん部位に注射し、放射線分布をSPECTイメージングで解析した。アジド基を増やすにつれて、がんへの滞留性が向上した。
(B)アジド基を四つ持つ90Y放射性錯体をゼノグラフトモデルマウスに注射し、その抗腫瘍効果を調べた。90Yから放出されるβ–線にはがん殺傷効果がある。放射線の量を上げることにより、高い抗腫瘍効果が得られた。
注3)2021年3月31日プレスリリース「体内での環化付加反応によるがん化学療法」
今後の期待
本研究では、アジド基をがん細胞への極小サイズの分子接着剤として利用し、細胞内での有機合成化学反応を基盤とした、前例のないラジオセラノスティクス手法を開発しました。今回、放射性核種の配位子として用いたDOTAやDTPAには、PETイメージング[5]に使用される銅64(64Cu)やガリウム68(68Ga)、放射線治療に用いられる銅67(67Cu)、α線内用療法への活用が期待されているアクチニウム225(225Ac)も導入できるため、今後、幅広い核種を用いたラジオセラノスティクスへの展開が期待できます。
さらに、アクロレインはあらゆるがんで普遍的に発生しているバイオマーカーです。これまでがん細胞内での滞留性に問題のあったさまざまな診断薬や薬剤に対しても適応可能であり、がん診断・治療を変革する技術になると期待できます。
補足説明
1.放射性核種
物質を構成する原子核には、構造が不安定なために時間とともに放射線を放出しながら崩壊して別の核種になるものがある。このような原子核を持つ同位体を放射性同位体、あるいは放射性核種と呼ぶ。特定の細胞や臓器に集まる化合物に放射性核種を結合させ、生体内部から放出される放射線を捉えることによって腫瘍などを可視化(イメージング)したり、治療したりすることができる。例えば、PETイメージング(補足説明[5]参照)にはフッ素18(18F)、銅64(64Cu)、ガリウム68(68Ga)(β+を放出)、放射線治療には銅67(67Cu)(β–を放出)、あるいはアスタチン211(211At)やアクチニウム225(225Ac)(α線を放出)が使用される。
2.カスケード反応
一つの反応によって別の部分に活性の高い官能基が生成し、さらにそれがドミノ倒しのように次へ次へと反応を起こしていく反応形式の総称。ドミノ反応、タンデム反応とも呼ばれる。本研究では、アクロレインとフェニルアジドが5員環を形成する環化付加反応からスタートする。
3.錯体
金属と非金属の原子が水素結合や配位結合によって形成する分子。
4.ゼノグラフトモデルマウス
ヒト由来のがん細胞を免疫不全マウス(免疫に欠陥があるマウス)へ移植したモデル。
5.SPECTイメージング、PETイメージング
SPECTイメージングは単光子放出断層画像法(Single Photon Emission Computed Tomography)、PETイメージングは陽電子放出断層画像法(Positron Emission Tomography)による画像診断。どちらも、特定の放射性核種を組み込んだ分子を体内に投与し、放射性核種が集積した臓器から出る放射線を測定することで、その分子の体内での分布・動態を見る方法。両者は用いられる放射性核種が異なる。
共同研究グループ
理化学研究所
開拓研究本部 田中生体機能合成化学研究室
主任研究員 田中 克典(タナカ・カツノリ)
(東京工業大学 物質理工学院 応用化学系 教授)
客員研究員 アンバラ・プラディプタ(Ambara Pradipta)
(東京工業大学 物質理工学院 応用化学系 助教)
研修生 大出 雄大(オオデ・ユウダイ)
(東京工業大学 物質理工学院 応用化学系 博士後期課程2年)
専任研究員 石渡 明弘(イシワタ・アキヒロ)
仁科加速器科学研究センター 核化学研究開発室
室長 羽場 宏光(ハバ・ヒロミツ)
生命機能科学研究センター 健康・病態科学研究チーム(研究当時)
研究員(研究当時)水間 広(ミズマ・ヒロシ)
(現 生命機能科学研究センター 分子標的科学研究チーム 客員研究員、量子科学技術研究開発機構 量子生命・医学部門 量子医科学研究所 脳機能イメージング研究部 主幹研究員)
国立がん研究センター 先端医療開発センター 医療機器開発グループ
機能診断開発分野
RI管理者(研究当時)大貫 和信(オオヌキ・カズノブ)
(現 医薬品開発グループ 免疫療法開発分野 特任研究員)
原論文情報
Yudai Ode, Ambara R. Pradipta, Akihiro Ishiwata, Kazunobu Ohnuki, Hiroshi Mizuma, Hiromitsu Haba, and Katsunori Tanaka, “Metallic radionuclide-labeled tetrameric 2,6-diisopropylphenyl azides for cancer treatment”, Chemical Communications, 10.1039/D4CC00048J
発表者
理化学研究所
開拓研究本部 田中生体機能合成化学研究室
主任研究員 田中 克典(タナカ・カツノリ)
(東京工業大学 物質理工学院 応用化学系 教授)
客員研究員 アンバラ・プラディプタ(Ambara Pradipta)
(東京工業大学 物質理工学院 応用化学系 助教)
研修生 大出 雄大(オオデ・ユウダイ)
(東京工業大学 物質理工学院 応用化学系 博士後期課程2年)
仁科加速器科学研究センター 核化学研究開発室
室長 羽場 宏光(ハバ・ヒロミツ)
報道担当
理化学研究所 広報室 報道担当
東京工業大学 総務部 広報課