2024-03-01 東京大学
発表のポイント
- PTSD患者とPTSDマウスモデルの比較から、両者に共通してその発現が低下するcAMP情報伝達経路の負の制御因子であるホスホジエステラーゼ4B(PDE4B)を新たに発見しました。
- PTSD患者ではPDE4Bの発現量が低いほど、すなわち、cAMP情報伝達経路の活性化が高いほど、再体験症状(フラッシュバックなど)が重篤でした。一方、マウスではcAMP情報伝達経路の過活性化により、トラウマ記憶がより強く思い出され、トラウマ記憶が強化され、PTSDの再体験症状とcAMP情報伝達経路の過活性化との関連が明らかとなりました。
- PTSDの分子機構が世界で初めて発見され、cAMP情報伝達を標的としたPTSDの診断方法と治療方法の新規開発の道が開かれました。

概要
東京大学大学院農学生命科学研究科の喜田聡教授、国立精神・神経医療研究センター精神保健研究所金吉晴所長と堀弘明室長らの研究グループは心的外傷後ストレス障害(PTSD;注1)の分子メカニズムを発見しました(図1)。
PTSDのメカニズムの解明は進んでいません。一方で、トラウマ記憶の代表例である恐怖記憶(注2)は動物に普遍的に存在するため、齧歯類を中心とした恐怖記憶の研究の成果をPTSDの治療方法の開発に応用することが試みられています。本研究では、PTSD患者末梢血とマウスPTSDモデル海馬の遺伝子発現を網羅的に比較し、両方で発現低下しているホスホジエステラーゼ4B(PDE4B;注3)遺伝子を発見しました。PDE4Bの発現低下はcAMP情報伝達経路の活性化を導きます。PTSD患者では再体験症状(注4)が重篤であるほどPDE4Bの発現が低く(図4)、再体験症状とcAMP情報伝達経路(注5)の過活性化が関与することが示唆されました。一方、マウスを用いた光遺伝学と薬理学を用いた解析から、cAMP量を人為的に増加させた場合に恐怖記憶がより強く思い出され、その後に恐怖記憶がより強固になりました。以上の研究成果から、PTSD再体験症状の原因としてcAMP情報伝達経路の過活性化が関与することが示唆され、世界で初めてPTSDの分子基盤を明らかにすることに成功しました。本研究の成果はPTSDの新規な診断方法と治療法開発に貢献することが期待されます。
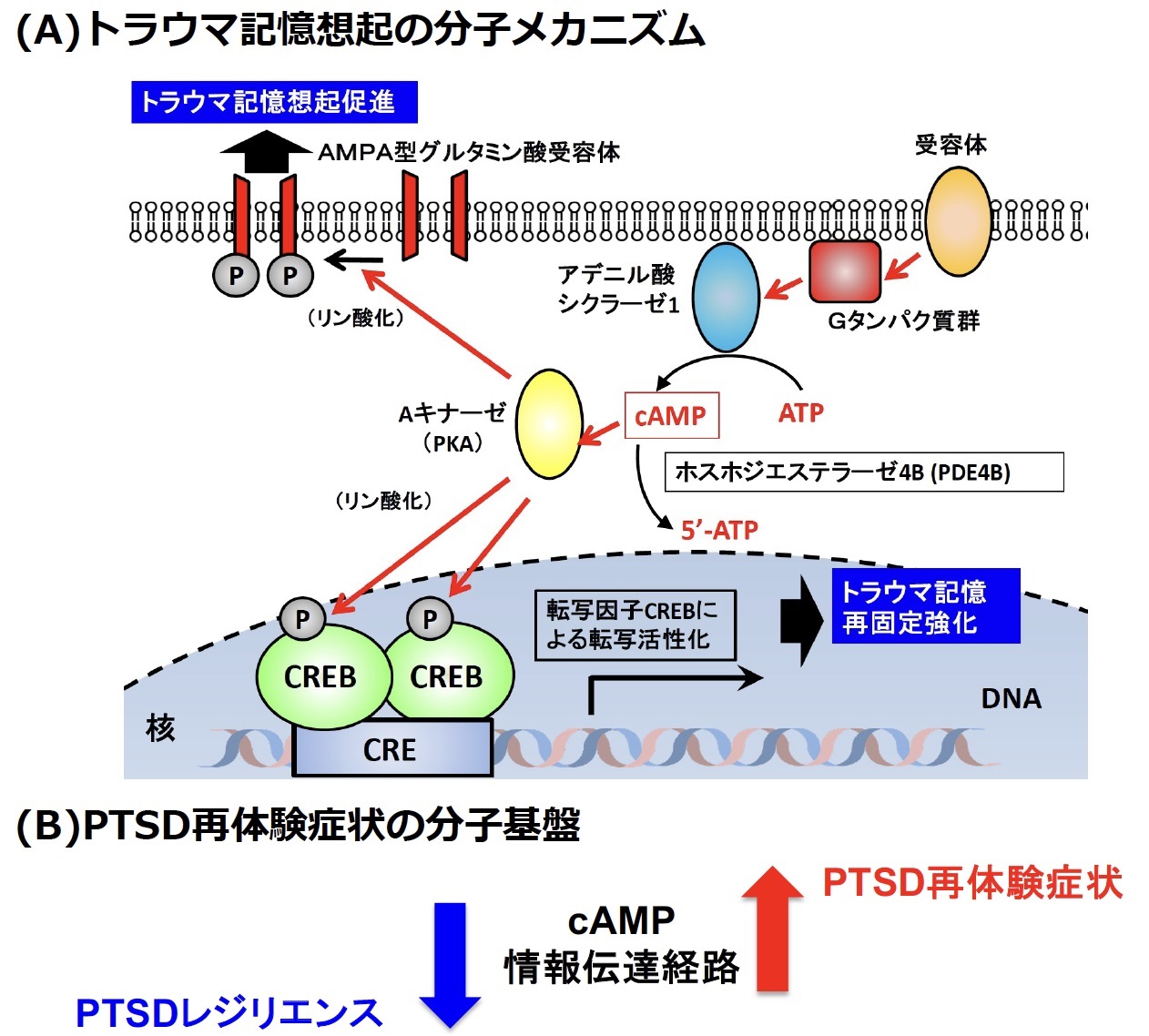
図1:本研究におけるPTSD再体験症状の分子機構
(A)これまでの研究成果(長谷川ら、Nat Commun., 2019)と本研究の成果によるトラウマ記憶想起の分子機構
(B)cAMP情報伝達経路の過活性化によるPTSD再体験症状の発症
発表内容
PTSDは生死に関わるような事故、災害、暴力、戦争などのトラウマ体験の記憶を原因とする精神疾患です。PTSDの主症状は、トラウマ体験の記憶が現実であるかのように自発的に繰り返し思い出される、という再体験症状(フラッシュバックなど)です。しかし、この再体験症状を含めて、PTSDのメカニズムの解明は進んでいません。世界的には、PTSD患者の大規模なゲノム解析も進められ、関連遺伝子候補群が同定されていますが、これら遺伝子群によるPTSD発症と症状のメカニズムは未だ不明です。一方、トラウマ記憶の一つである恐怖記憶はヒトを含めた動物に普遍的に存在する記憶です。そのため、齧歯類における恐怖記憶の制御メカニズムの解明が進められています。世界的にも齧歯類の恐怖記憶をPTSDモデルとして、PTSDのメカニズムの理解とその治療方法開発に応用することが試みられています。
これまでの研究において、喜田のグループではマウスを用いたcAMP情報伝達経路が記憶の思い出し(想起)を正に制御することを明らかにしています(2019年)(図1)。この研究成果に基づき、本論文では、cAMP情報伝達経路の活性化がPTSDにおける再体験症状に関与するのではないかと考え、研究を進めました。
トラウマ(恐怖)記憶とcAMP情報伝達経路との関連性を検証するため、マウスを用いて最新の光遺伝学的手法と薬理学的手法を用いて人為的に海馬のcAMP量を操作して恐怖記憶に及ぼす影響を解析しました。cAMP量を人為的に増加させた場合には恐怖記憶がより強く思い出され(図2)、その後に恐怖記憶がより強固になり、再体験症状様の行動が観察されました。一方で、海馬のcAMP量を低下させた場合には、恐怖記憶の思い出しが抑制され、さらに、その後の恐怖記憶が減弱することが明らかになりました。以上の発見は、cAMP情報伝達経路の活性化により、トラウマ記憶の想起と再固定化(注6)が促進され、トラウマ記憶が強化されることを示唆するものでした。
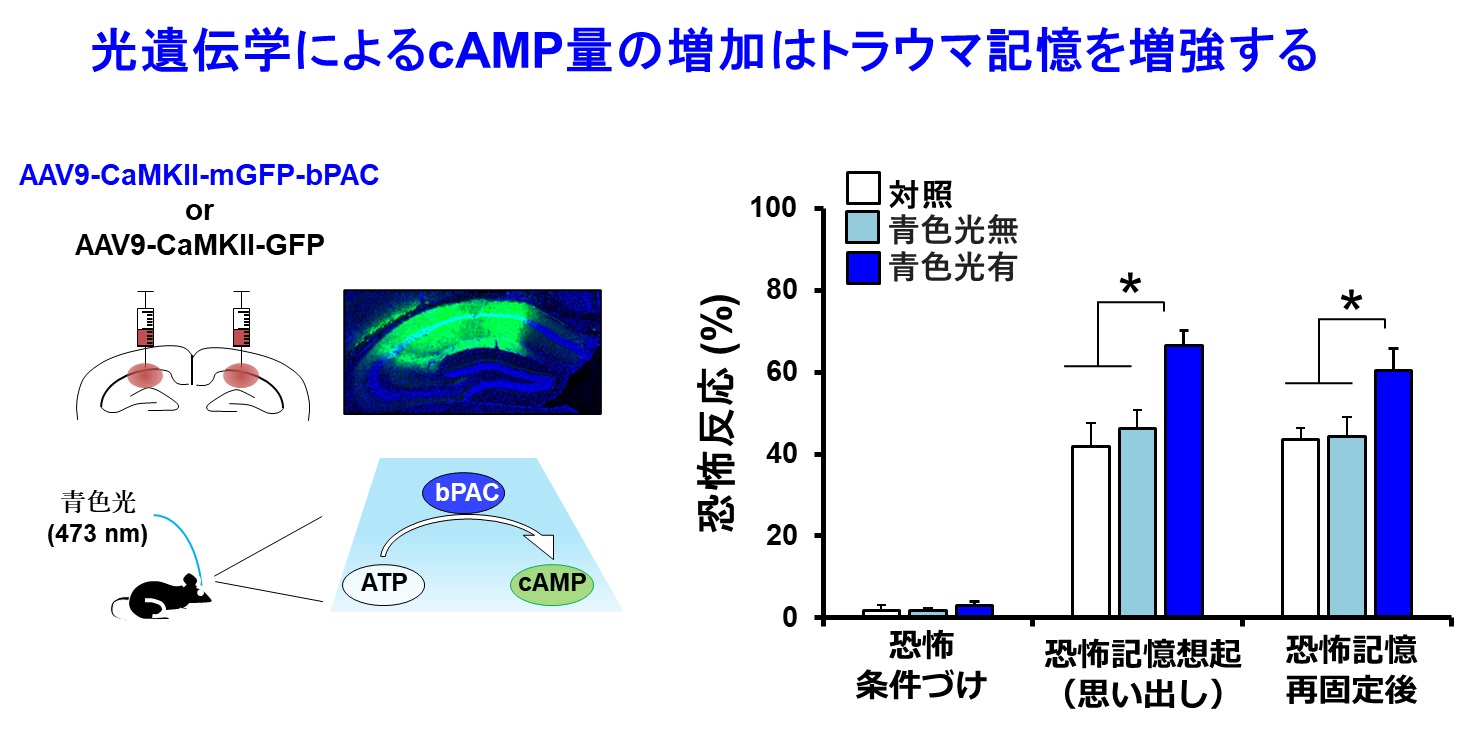
図2:光遺伝学を用いたマウス海馬におけるcAMP量増加後のトラウマ記憶増強
マウス海馬にbPAC(注7)を発現させて青色光によってcAMP量を増加させるとトラウマ記憶が強く思い出(想起)され、その後の再固定化によってトラウマ記憶が増強された。
一方、PTSD患者の末梢血とマウスPTSDモデルにおける恐怖記憶想起時の脳内海馬のmRNA発現を網羅的に比較し、両方で顕著に発現低下している遺伝子としてホスホジエステラーゼ4B(PDE4B)を発見しました(図3)。PDE4Bは細胞内の主要セカンドメッセンジャーであるcAMPを分解する酵素であるため、PDE4Bの発現低下はcAMP情報伝達経路の活性化を導きます。重要な点として、PTSD患者では再体験症状が重篤であるほどPDE4Bの発現が低く、再体験症状と末梢血PDE4B mRNAの間に負の相関があることが明らかとなりました(図4)。すなわち、再体験症状とcAMP情報伝達経路の過活性化が関与することが示唆されました。また、PTSD患者の末梢血のPDE4B遺伝子のDNA修飾(メチル化)もそのmRNA発現量に相関することが示され(図5)、PTSD患者の末梢血におけるPDE4Bの発現低下は一過的なものではなく、その発現が継続して低下していることが強く示唆されました。興味深いことに、マウスPTSDモデルを用いた解析では、恐怖記憶を想起させた(思い出した)後に、海馬ばかりではなく、末梢血においてもPDE4B mRNAの発現量が低下していることが示され(図6)、PTSD患者とマウスPTSDモデルとの相同性が示されました(図7)。以上までの結果は、PTSDの再体験症状とcAMP情報伝達経路の活性化が関連することを強く示唆するものでした。
以上の研究成果をまとめると、cAMP情報伝達経路の過活性化がPTSDの再体験症状と関連し、この過活性化が再体験症状の重症化を導く分子基盤であることが示唆されました。本研究の成果は、世界で初めてPTSDの分子機構、すなわち、PTSDの分子細胞生物学的なメカニズムを説明するものとなりました。
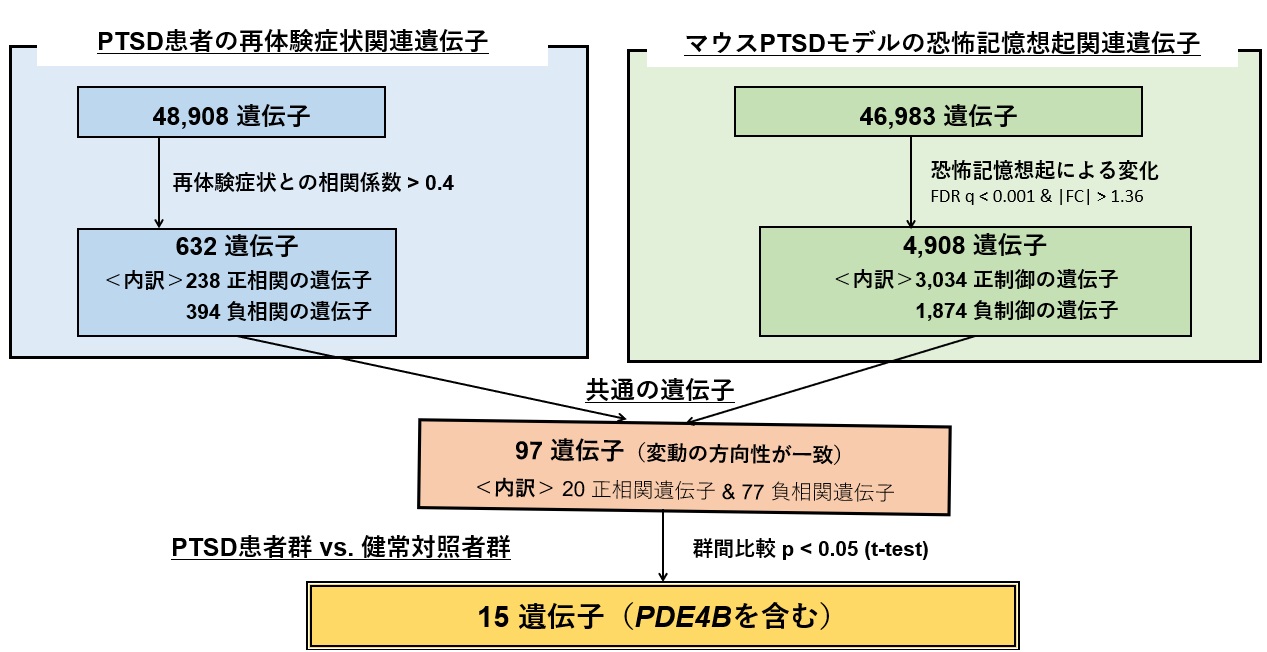
図3:ヒトおよびマウスの統合トランスクリプトーム解析のフロー図
上左および上右のボックスは、それぞれヒトおよびマウスのトランスクリプトームデータ解析の流れを示す。下の2つのボックスは、ヒトとマウスのデータ統合によるさらなる選択過程を示す。
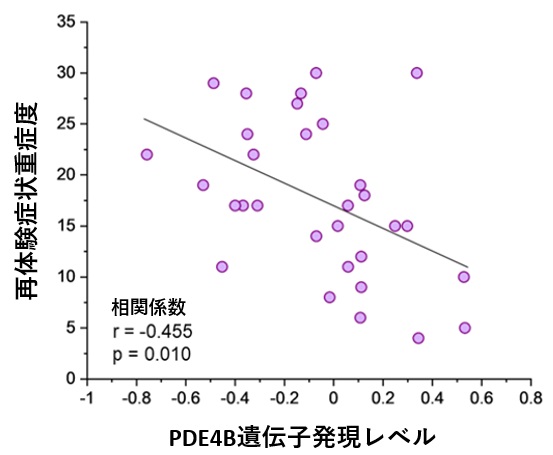
図4:PDE4B遺伝子発現レベルと PTSD再体験症状との相関を示す散布図
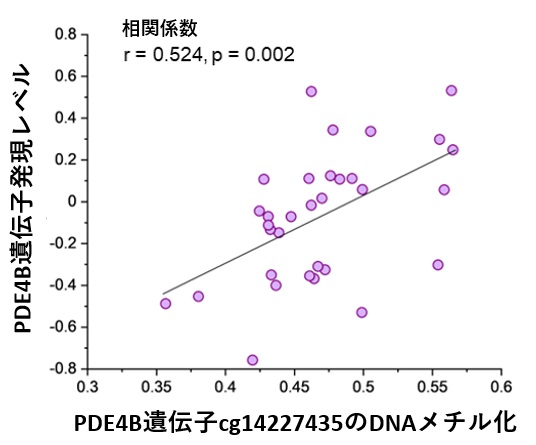
図5:PDE4B遺伝子のDNAメチル化と発現レベルとの相関を示す散布図
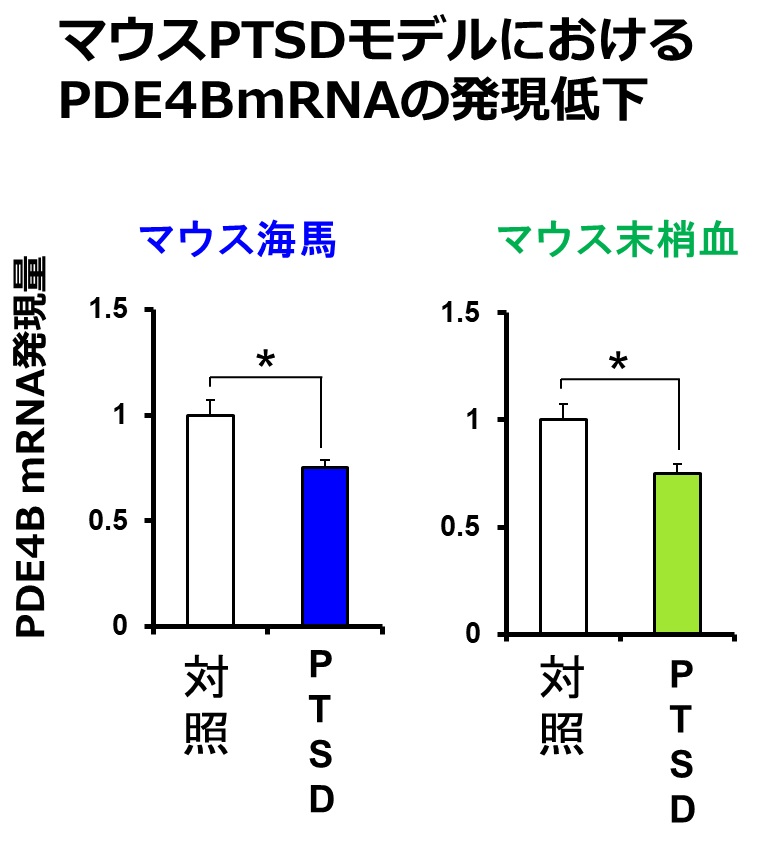
図6:マウスPTSDモデルにおけるPDE4B発現量の低下
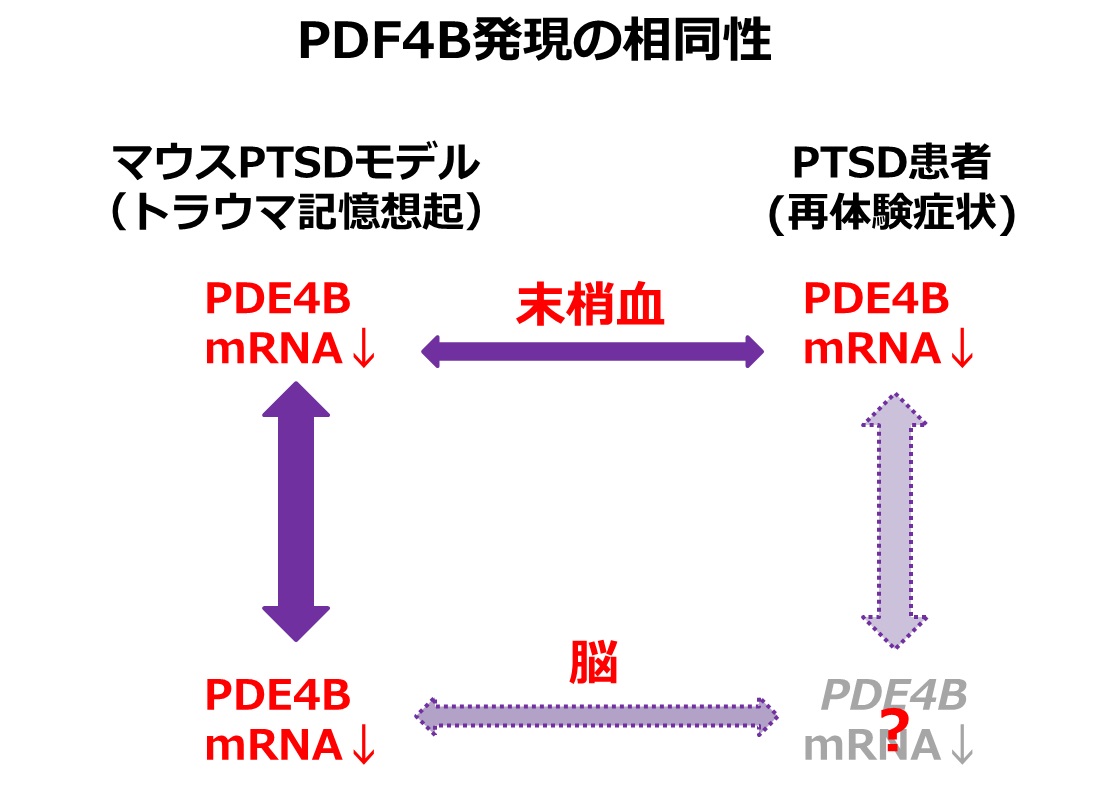
図7:PTSD患者とマウスPTSDモデルにおけるPDE4B発現の相同性
再体験症状を示すPTSD患者とトラウマ記憶想起後のマウスPTSDモデルでは末梢血におけるPDE4B mRNAが発現低下を示し、マウスモデルでは海馬でもその発現量が低下していた。
また、以上の成果から、cAMP情報伝達経路には数多い遺伝子群(分子群)が存在するため、これら遺伝子群の異常によるcAMP情報伝達経路の過活性化がPTSDの症状と関連することが考えられます。このことは、これまでPTSDの原因が単一の遺伝子に収束してこなかった理由とも考えられます。さらに、本研究の成果から、cAMP情報伝達経路の不活性化を導くことでPTSDの新規治療薬の開発に繋がる可能性も示唆されました。実際には、本研究で用いられたNB001(注8)はcAMP量を抑制する薬剤であり、PTSD治療薬の候補です。本研究の成果により、cAMP情報伝達経路を標的としてPTSDの発症と病態の理解と治療方法開発を進める道が開け、今後のPTSDの治療薬開発が加速することが期待されます。
本研究は国内の基礎研究者と臨床研究者との有機的な連携研究の大きな成果であり、基礎と臨床のタッグがなければ成し得ないトランスレーショナル研究であることを明記致します。本研究は東京大学大学院農学生命科学研究科、国立精神・神経医療研究センター、東京農業大学、トロント大学、マウントサイナイ病院(トロント)の共同研究として行われました。
〇関連情報:
「記憶を思い出すには体内時計の働きが必要である -脳内の体内時計が記憶を思い出させることの発見とその分子機構の解明」(2019/12/19)
https://www.a.u-tokyo.ac.jp/topics/topics_20191219-1.html
https://www.nature.com/articles/s41467-019-13554-y
発表者・研究者等情報
東京大学大学院農学生命科学研究科
喜田 聡 教授
石川 理絵 助教
長葭 大海 特任研究員(研究当時)
国立研究開発法人国立精神・神経医療研究センター精神保健研究所
金 吉晴 所長
行動医学研究部
堀 弘明 室長
吉田 冬子 研究員
東京農業大学生命科学部
福島 穂高 准教授
トロント大学
Min Zhuo(ミン ズオウ)教授
マウントサイナイ病院・トロント大学
岡本 健一 准教授
帝京大学医学部精神神経科学講座
功刀 浩 主任教授
発表雑誌
- 雑誌
- Molecular Psychiatry
- 題名
- Fear memory regulation by the cAMP signaling pathway as an index of reexperiencing symptoms in posttraumatic stress disorder
- 著者
- Hiroaki Hori*, Hotaka Fukushima, Taikai Nagayoshi, Rie Ishikawa, Min Zhuo, Fuyuko Yoshida, Hiroshi Kunugi, Kenichi Okamoto, Yoshiharu Kim*, Satoshi Kida*
- DOI
- 10.1038/s41380-024-02453-4
- URL
- https://www.nature.com/articles/s41380-024-02453-4
研究助成
本研究は、科研費基盤研究A「PTSDの恐怖記憶と情動反応の分子基盤の解明と治療(22H00469)」、「記憶エングラムアップデート制御基盤の解明と脳疾患改善方法への応用(22H00358)」、「生物時計による脳機能制御基盤の解明と脳疾患改善への応用(18H03944)」、文科省新学術領域・マイクロ精神病態「環境要因が導く精神疾患モデルを用いたマイクロエンドフェノタイプ同定と分子基盤解明(24116008)」、マルチスケール脳「シナプス操作によるPTSDの構成的理解」(18H05434)」、適応回路シフト「恐怖から消去への回路シフトのスイッチ機構の解明(17H05581)」、学術変革領域・適応回路センサス「記憶エングラムセンサスによる再固定化から消去への動的な回路遷移の分子基盤の解明(22H05486)」、科研費挑戦的研究「海馬記憶機能を標的とした記憶操作による新規脳疾患治療戦略の確立(17K19464)」、内閣府ムーンショット目標9「食の心理メカニズムを司る食嗜好性変容制御基盤の解明」(JPMJMS2298)、国立精神・神経医療研究センター精神・神経疾患研究開発費(2-2、5-2)などの支援により実施されました。
用語解説
注1 心的外傷後ストレス障害(PTSD)
生死に関わるような自然災害や事故、暴力、または性被害などのトラウマ体験を経験した後、再体験、回避、過覚醒、認知、感情の否定的変化を主とする症状が出現し、大きな心理的苦痛や社会機能障害を来す精神疾患。12ヵ月有病率は0.7%と報告されており、これは、日本の成人人口をおおよそ1億人とした場合、約70万人にのぼることから、社会経済的損失も非常に大きい。
注2 恐怖記憶
恐怖体験の記憶であり、ヒトを含めた動物に普遍的に観察される恐怖条件づけとしても知られる。齧歯類では恐怖条件づけをPTSDモデルとして、恐怖記憶の制御基盤の解明が進んでいる。本研究では、齧歯類において認知症用薬であるメマンチンが恐怖記憶の忘却を促進することを明らかにして、メマンチンによるPTSD治療の臨床試験を行なっており、良好な結果が得られている。
注3 ホスホジエステラーゼ4B
cAMPを分解する酵素である。この酵素の活性化はcAMP量の低下を導き、cAMP情報伝達経路を不活性化する。この酵素を不活性化する抗炎症薬であるロリプラムはcAMP情報伝達経路の活性化剤として用いられており、本研究では、マウスに対するロリプラム投与によるcAMP情報伝達経路の活性化により恐怖記憶の想起が促進され、恐怖記憶が強固になることが示された。
注4 再体験症状
トラウマ体験の記憶がフラッシュバックや悪夢などの形で突然、意図せずに繰り返し蘇ってくるという、PTSDの中核症状。侵入症状とも呼ばれる。再体験症状はトラウマ記憶への恐怖条件づけと捉えることが可能であり、そういった条件づけは動物にも生じるという事実に基づいて齧歯類のPTSDモデルが確立されている。
注5 cAMP情報伝達経路
cAMPとは環状アデノシン一リン酸のことであり、細胞内情報伝達における代表的なセカンドメッセンジャーである。cAMPはアデニル酸シクラーゼによってATPから産生され、リン酸化酵素であるAキナーゼを活性化する。cAMP情報伝達経路は脳(神経細胞)内の主要な細胞内情報伝達経路である。これまでの研究では、この情報伝達経路が記憶形成や記憶想起に重要な役割を果たすことが明らかにされている。喜田のグループでは、cAMP情報伝達経路の下流に存在する転写因子CREBの活性により記憶能力が高まること(2011年)、また、この情報伝達経路の活性化が記憶想起を促進すること(2019年)を明らかにしており、これらの研究成果が本研究における発見の基となった。
注6 再固定化
記憶を貯蔵するプロセスは「固定化」であり、これに対して、思い出(想起)した記憶を再貯蔵するプロセスが「再固定化」である。どちらも、遺伝子発現を必要とする記憶プロセスである。喜田のグループでは、記憶の再固定化の役割の一つが記憶を強化することであることをマウスPTSDモデルを開発して明らかにした(福島ら、eLife, 3, e02736, 2014)。
注7 bPAC(photoactivatable adenylyl cyclase)
岡本健一博士が開発した青色光によってcAMP産生酵素が活性化される光遺伝学ツール。
注8 NB001
脳で発現するアデニル酸シクラーゼIを不活性化する薬剤である。本研究の共著者であるMin Zhuo教授がNB001を慢性疼痛の治療薬として開発した。現在、NB001は臨床試験の過程にあり、PTSDの治療薬としても期待される。
問い合わせ先
(研究内容については発表者にお問合せください)
東京大学大学院農学生命科学研究科応用生命化学専攻
教授 喜田 聡(きだ さとし)
国立精神・神経医療研究センター精神保健研究所 所長 金 吉晴
Tel:042-341-2711 E-mail:kim[アット]ncnp.go.jp
国立精神・神経医療研究センター精神保健研究所行動医学研究部
室長 堀 弘明
東京大学大学院農学生命科学研究科・農学部
事務部 総務課総務チーム 総務・広報情報担当(広報情報担当)