2024-03-07 名古屋大学
東海国立大学機構 名古屋大学大学院医学系研究科 統合生理学分野の大屋愛実 助教、中村佳子 講師、中村和弘 教授の研究グループは、大阪大学医学部附属動物実験施設の宮坂佳樹助教、東京大学医科学研究所の真下知士 教授、名古屋大学環境医学研究所の田中都 講師、菅波孝祥 教授との共同研究により、加齢性肥満(中年太り)の原因となる脳の仕組みを世界に先駆けてラットで発見しました。
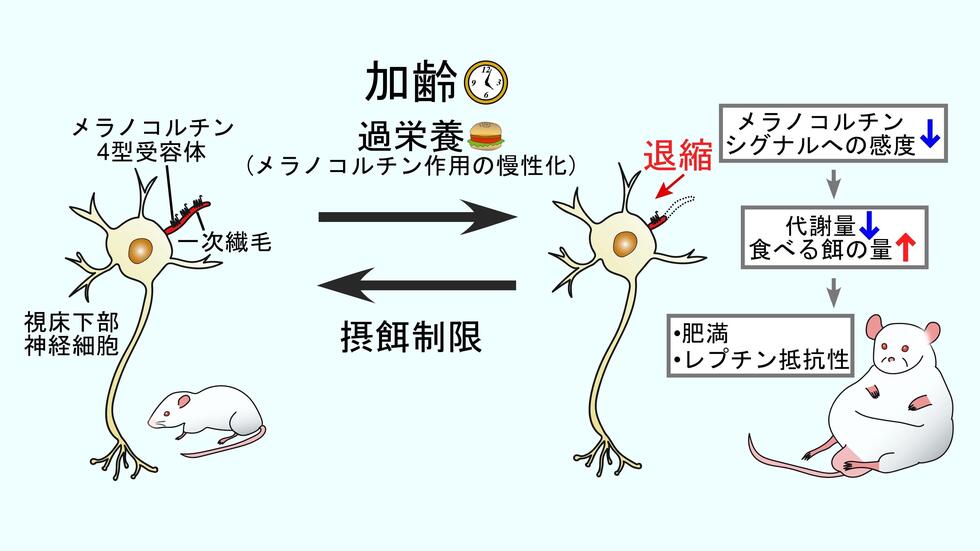
加齢に伴い太りやすくなりますが、そのメカニズムは不明でした。同研究グループは、代謝や摂食を調節する脳の視床下部のニューロン(神経細胞)に着目し、抗肥満機能を持つメラノコルチン4型受容体(MC4R)*1 の細胞内局在が、ラットの加齢に伴ってどのように変わるかを調べました。MC4R を可視化できる世界初の信頼性の高い抗体を作製して調べたところ、MC4Rが視床下部ニューロンの一次繊毛*2 というアンテナ構造に局在し、その一次繊毛が加齢に伴い退縮することを発見しました。MC4R 局在一次繊毛の退縮は過栄養状態で促進され、摂餌量を制限すると抑制されました。
遺伝子技術を使って、若いラットの MC4R 局在一次繊毛を強制的に退縮させると、摂餌量が増えるとともに代謝量が低下し、肥満になりました。また、肥満患者で起こるレプチン抵抗性*3を示しました。逆に、加齢に伴う MC4R 局在一次繊毛の退縮を人為的に抑制すると体重増加が抑制されました。
これらの結果から同研究グループは、加齢に伴って視床下部ニューロンの MC4R 局在一次繊毛が退縮することによる MC4R の減少が加齢性肥満の原因であることを突き止めました。この研究成果は肥満の根本的な原因に迫るものであり、肥満に起因する糖尿病などの様々な生活習慣病の未病段階での予防法や画期的な治療法の開発につながることが期待されます。
本研究成果は、2024 年 3 月 6 日付(日本時間 3 月 7 日午前 1 時)米国科学誌『Cell Metabolism』に掲載されました。
【ポイント】
・抗肥満機能を持つメラノコルチン 4 型受容体(MC4R)が脳の視床下部の神経細胞の一次繊毛に局在し、加齢に伴ってその一次繊毛が退縮することをラットで発見しました。
・MC4R 局在一次繊毛を退縮させると、代謝が低下するとともに摂餌が増えて肥満になりました。
・MC4R 局在一次繊毛の長さが「痩せやすさ」を決定しており、それが加齢や過栄養(飽食)によって短くなることが加齢性肥満(中年太り)の原因になることを解明しました。
・本研究成果は、生活習慣病の未病段階での予防法や画期的な治療法の開発につながることが期待されます。
◆詳細(プレスリリース本文)はこちら
【用語説明】
*1 メラノコルチン 4 型受容体(MC4R)
遺伝性肥満の原因遺伝子として知られる受容体。MC4R は、飽食シグナルの伝達分子であるメラノコルチンを受容すると、自らが発現するニューロンの神経伝達活動を活性化することで神経回路を作動させ、全身の代謝や熱産生を促進するとともに食欲を抑制し、抗肥満作用を生み出す。
*2 一次繊毛
細胞外に突き出ている不動性の繊毛。がん細胞や血球以外のほとんど全ての正常細胞に存在する。近年、ニューロンが一次繊毛を持つことが知られるようになった。各ニューロンが1本ずつ持ち、アンテナとして機能する一次繊毛には様々な受容体が存在し、脳内を流れる多様な液性因子を受容していると考えられている。
*3 レプチン抵抗性
体内の白色脂肪細胞からレプチンが血中に分泌されているにもかかわらず、標的臓器でのレプチンの作用が低下している状態のこと。レプチンの抗肥満作用が得られないため、肥満が進行し、様々な生活習慣病につながるリスクが高まる。レプチン抵抗性は肥満治療における大きな問題だが、それが生じるメカニズムは不明であった。
【論文情報】
雑誌名:Cell Metabolism
論文タイトル:Age-related ciliopathy: obesogenic shortening of melanocortin-4 receptor-bearing neuronal primary cilia
著者名・所属名:Manami Oya,1 Yoshiki Miyasaka,2 Yoshiko Nakamura,1 Miyako Tanaka,3,4,5 Takayoshi Suganami,3,4,5,6 Tomoji Mashimo,2,7,8 and Kazuhiro Nakamura1
1Department of Integrative Physiology, Nagoya University Graduate School of Medicine(名古屋大学大学院医学系研究科・統合生理学分野)
2Institute of Experimental Animal Sciences, Graduate School of Medicine, Osaka University(大阪大学医学部・附属動物実験施設)
3Department of Molecular Medicine and Metabolism, Research Institute of Environmental Medicine, Nagoya University(名古屋大学環境医学研究所・分子代謝医学分野)
4Department of Immunometabolism, Nagoya University Graduate School of Medicine(名古屋大学大学院医学系研究科・免疫代謝学)
5Institute of Nano-Life-Systems, Institutes of Innovation for Future Society, Nagoya University(名古屋大学ナノライフシステム研究所・未来社会創造機構)
6Center for One Medicine Innovative Translational Research (COMIT), Nagoya University(名古屋大学 One Medicine 創薬シーズ開発・育成研究教育拠点)
7Division of Animal Genetics, Laboratory Animal Research Center, The Institute of Medical Science, The University of Tokyo(東京大学医科学研究所実験動物研究施設・先進動物ゲノム研究分野)
8Division of Genome Engineering, Center for Experimental Medicine and Systems Biology, The Institute of Medical Science, The University of Tokyo(東京大学医科学研究所システム疾患モデル研究センター・ゲノム編集研究分野)
DOI: 10.1016/j.cmet.2024.02.010
English ver.
https://www.med.nagoya-u.ac.jp/medical_E/research/pdf/Cel_240307en.pdf
【研究代表者】
大学院医学系研究科 中村 和弘 教授