2024-03-08 神戸大学
神戸大学大学院医学研究科生理学分野の貝塚剛志特命助教 (現英国エディンバラ大学臨床脳科学センター博士研究員)、内匠透教授 (理化学研究所生命機能科学研究センター客員主管研究員)、京都大学大学院医学研究科システム神経薬理学分野の林康紀教授らの国際共同研究グループは、プロテオーム※1のデータ分析により、シナプスに局在する主要なタンパク質のひとつとして「FAM81A」を発見しました。詳細な解析の結果、FAM81Aは液-液相分離※2によって細胞内で液滴状の構造を形成し、シナプスの分子を集積させる性質を持っていることがわかりました。
この研究成果は、3月7日 (英国時間) に、「PLOS Biology」に掲載されました。
ポイント
- プロテオームのデータ群を分析することで、主要なシナプスタンパク質FAM81Aを見出した。
- FAM81Aは他の主要な後シナプスタンパク質と相互作用し、液滴状の凝縮構造を形成する。
- FAM81Aはシナプスの大きさと神経細胞の活動を正に制御する。
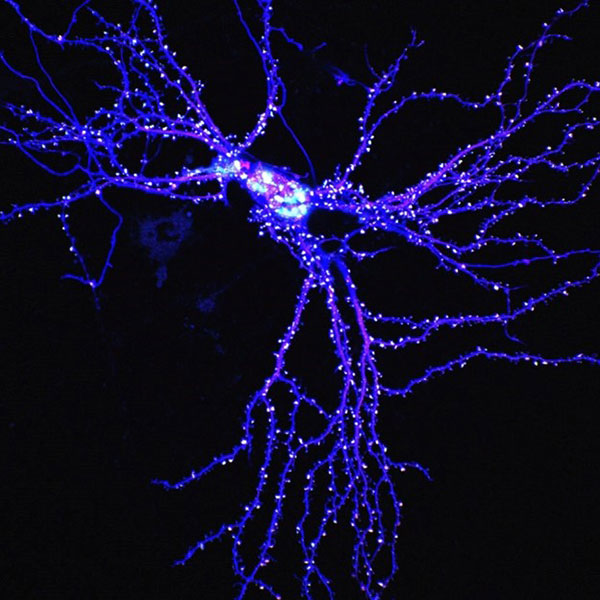
図:マウスの海馬ニューロンでPSD-95-mCherry (赤) およびBFP (青) と共発現したFAM81A-GFP (緑) の画像 樹状突起スパインの先端と細胞質内に、FAM81AとPSD-95からなる液滴が見られる。
研究の背景
私たちの脳の中では多数の神経細胞がシナプスと呼ばれる接続部分を介して巨大な情報処理ネットワークを形成しています。興奮性シナプスの後部には、多数のタンパク質が集積したシナプス後肥厚 (PSD) ※3と呼ばれる構造体が形成されており、ここには神経伝達物質受容体や足場タンパク質、酵素など、シナプスの機能において重要なタンパク質が局在しています。これまで、プロテオーム解析によってPSDに局在するタンパク質が1,000種類以上報告されています。本研究では、PSDに局在するタンパク質の中で「主要ではあるが機能未知の分子」の探索を行いました。すなわち、これまでの様々な解析で何度も存在が報告されていますが、そのシナプスにおける役割がわかっていない分子に注目し、その詳しい解析を行いました。
研究の内容
はじめに、PSDに局在するタンパク質のプロテオーム解析を行った論文を検索し、それぞれのデータセットで検出されているタンパク質のリストを作成しました。各リストのタンパク質を共通のIDに変換して整理したところ、どのデータセットでも共通して検出されているタンパク質と、そうでないタンパク質があることがわかりました (図1A, B)。
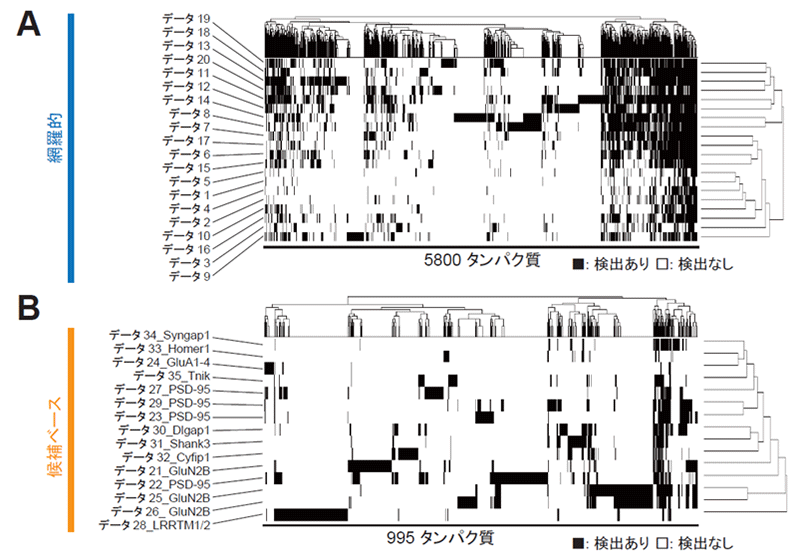 図1. 異なるプロテオームデータセット間での検出されているタンパク質の比較 過去に報告されている35個のデータセットにおいて、検出されているタンパク質群の重複を分析した。
図1. 異なるプロテオームデータセット間での検出されているタンパク質の比較 過去に報告されている35個のデータセットにおいて、検出されているタンパク質群の重複を分析した。
(A) 生化学的に精製したPSD画分を分析した20データセットの比較。
(B) 主要なPSDタンパク質に結合する因子を分析した15データセットの比較。データ番号の後ろの文字列は当該データで標的とされているタンパク質名。
次に、検出頻度の高いタンパク質のうち、まだほとんど研究がなされていないタンパク質を探索しました。通常、タンパク質はその機能が明らかになった際に、何らかの名称がつけられる (改名される) ため、まだ誰も名前を付けていない (改名されていない) タンパク質をリストアップしました。それらのうち、検出頻度最上位のタンパク質が「FAM81A」でした。複数の実験手法により、私たちはFAM81AがPSDに局在することを確認しました。さらに解析を進めたところ、FAM81Aは細胞内において液滴状の構造体を形成すること、そしてこれがタンパク質の液-液相分離によって形成されていることがわかりました。また、FAM81Aは培養細胞内および試験管内において、他の主要な後シナプスタンパク質であるPSD-95※4, SynGAP※5, GluN2B ※6と相互作用し、液滴を形成することがわかりました (図2A,B)。
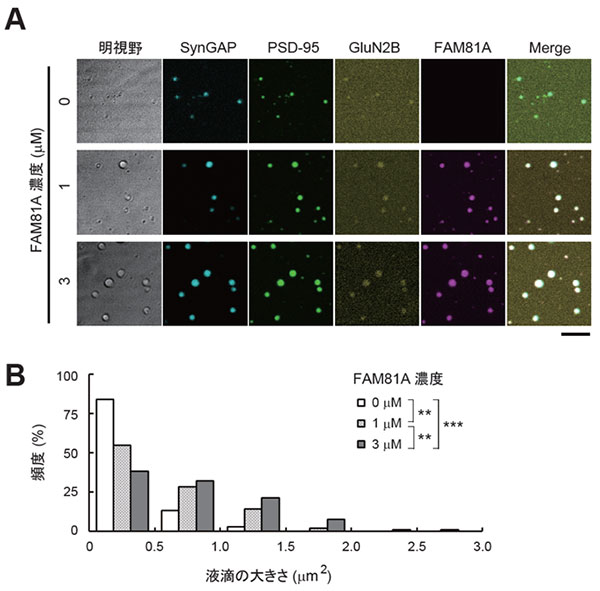
図2. FAM81Aは他の主要タンパク質とともに液滴を形成し、その液滴の増大に寄与する 精製した後シナプスタンパク質に蛍光色素を付加して試験管内で混合し、タンパク質の液滴形成を評価した。
(A) SynGAP, PSD-95, およびGluN2Bの細胞質ドメインの混合物に0~3 µMのFAM81Aを添加し、顕微鏡観察を行った。
(B) 液滴のサイズを計測し、ヒストグラムを作成した。
*統計的有意差あり (**P < 0.01, ***P < 0.001)
次に、このFAM81Aがシナプスにおいて果たす役割を明らかにするため、培養神経細胞において、FAM81Aの発現を抑制する実験を行いました。レンチウイルスベクター※7を用いてshRNA※8を導入することでFAM81Aの発現を抑制したところ、PSDが縮小することが観察されました (図3A,B)。さらに多電極アレイを用いて神経細胞の電気的活動を分析したところ、FAM81Aを抑制した細胞では神経活動が低下することがわかりました (図3C,D)。これらの結果は、FAM81AがPSDにおいて後シナプスタンパク質を集積させることでシナプスの強度を正に制御していることを示唆しています。
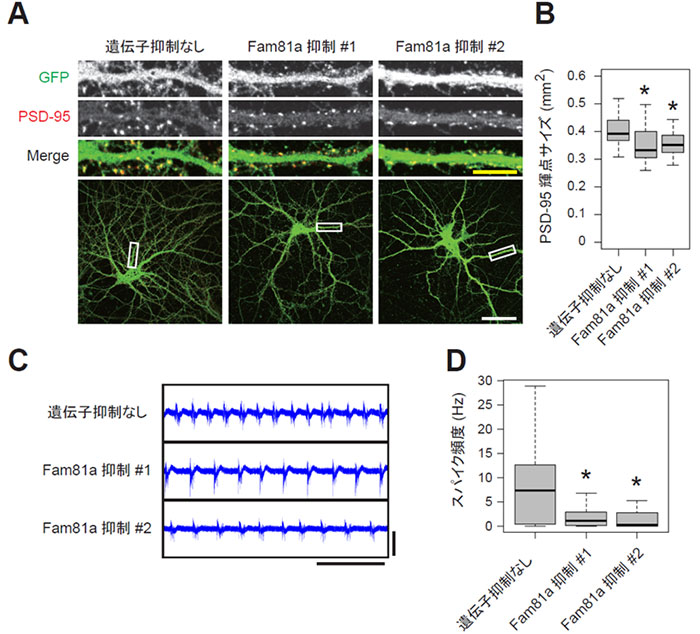
図3. FAM81A発現抑制によるPSDの縮小および神経活動の低下マウスの胎児から採取した海馬神経細胞を培養し、レンチウイルスを用いてshRNAを導入することでFam81aの遺伝子発現を抑制した。
A, B. PSD-95 を免疫染色した培養21日目の神経細胞。代表的な顕微鏡写真 (A) およびPSD-95の輝点のサイズ (B) を示した。
C, D. 培養21日目の神経細胞の電気的活動を多電極アレイで分析した。代表的なプロット (C) および平均スパイク頻度 (D) を示す。
*統計的有意差あり (P < 0.05)
以上から、FAM81Aはシナプス後部のタンパク質の集積と神経細胞の活動に影響を及ぼす、主要なシナプスタンパク質であることが明らかとなりました。
今後の展開
今後、動物を用いた実験によりFAM81Aが生体内で生理的条件下においてどのようにシナプスに影響しているかを研究することで、シナプスの機能や可塑性の分子メカニズムの理解が深まると考えられます。また今回のように複数のプロテオームのデータを統合して分析する手法は、シナプスあるいは他の場所に局在するタンパク質を探索する上で有効な手法であると考えられます。
用語解説
- ※1 プロテオーム解析
目的のサンプルに含まれるタンパク質を網羅的に検出する実験。サンプルに含まれるタンパク質を消化酵素で断片化してその質量を測定し、得られたデータをタンパク質のアミノ酸配列データと比較することでタンパク質を同定する。 - ※2 液-液相分離
2つの液体が混ざり合わずに互いに排除しあうことで2相に分離する現象のこと。細胞内においては、タンパク質やmRNAなどの生体分子がこの現象により液滴状の構造を形成することがある。特に近年、シナプス後部にタンパク質が集積する仕組みにも液-液相分離が関与していることが報告されている。
(参考文献)
Zeng M, Chen X, Guan D, Xu J, Wu H, Tong P, et al. Reconstituted Postsynaptic Density as a Molecular Platform for Understanding Synapse Formation and Plasticity. Cell [Internet]. 2018;174(5):1172-1187.e16. Available from: 10.1016/j.cell.2018.06.047 - ※3 シナプス後肥厚 (PSD)
シナプス後部の細胞膜の直下に存在する、多数のタンパク質が集積した構造体。神経伝達物質受容体、足場タンパク質、シグナル伝達酵素など、1,000種類以上のタンパク質から構成されている。 - ※4 PSD-95 (postsynaptic density protein 95)
シナプス後部において最も豊富に存在するタンパク質のひとつ。 - ※5 SynGAP (Synaptic Ras GTPase Activating Protein)
シナプス後部において最も豊富に存在するタンパク質のひとつ。 - ※6 GluN2B
神経伝達物質のグルタミン酸の受容体の一種 (NMDA受容体) を構成するタンパク質。 - ※7 レンチウイルス (レンチウイルス発現ベクター)
哺乳類細胞にshRNAなどを導入し、 安定発現させるためのツールとして用いられるウイルス。 - ※8 shRNA (short hairpin RNA)
短いヘアピン状構造を形成するRNA。細胞内の標的mRNAを分解、翻訳阻害することで目的遺伝子の機能を抑える。
謝辞
本研究は、日本学術振興会科学研究費補助金 (学術変革領域研究 (A) 臨界期生物学、基盤研究 (S)) 、科学技術振興機構ムーンショット型研究開発事業・目標9、JST-CREST、Human Frontier Science Progaramme、武田科学振興財団特定研究助成などによる支援を受けて行いました。
論文情報
- タイトル
- “FAM81A is a postsynaptic protein that regulates the condensation of postsynaptic proteins via liquid-liquid phase separation”
- DOI
- 10.1371/journal.pbio.3002006
- 著者
- Takeshi Kaizuka1,2,3, Taisei Hirouchi4, Takeo Saneyoshi4, Toshihiko Shirafuji2, Mark O. Collins5,6, Seth G.N. Grant3,7, Yasunori Hayashi4, Toru Takumi1,2,8*
1 RIKEN Brain Science Institute
2 Department of Physiology and Cell Biology, Kobe University School of Medicine
3 Centre for Clinical Brain Sciences, Chancellor’s Building, Edinburgh BioQuarter, University of Edinburgh
4 Department of Pharmacology, Kyoto University Graduate School of Medicine
5 School of Biosciences, University of Sheffield
6 biOMICS facility, Mass Spectrometry Centre, University of Sheffield
7 Simons Initiative for the Developing Brain (SIDB), Centre for Discovery Brain Sciences, University of Edinburgh
8 RIKEN Center for Biosystems Dynamics Research
*Corresponding author - 掲載誌
- PLOS Biology
研究者
貝塚 剛志
医学研究科
内匠 透・教授
医学研究科
白藤 俊彦・助教
医学研究科