先天性骨軟骨形成異常症の病態解明へ向けた発見
2018-08-24 産総研,東京医科歯科大学,日本医科大学医学部整形外科学,慶應義塾大学医学部整形外科学
ポイント
- SOX9は、性分化や軟骨細胞の分化に必須の役割を持つ転写因子であり、そのSOX9遺伝子もしくはそのエンハンサーの突然変異により、先天性骨軟骨形成異常症 (キャンポメリックディスプラシア)が引き起こされることがわかっていました。
- 今回研究チームは、CRISPR/Cas9を用いたゲノム編集技術を複数の研究手法(クロマチン免疫沈降 (ChIP)と次世代シークエンサーおよび質量分析、エピジェネティックスな編集制御、エンハンサーのノックアウトマウスの作成・解析)と組み合わせることによって、マウスの肋軟骨部位に特異的なエンハンサー (Rib Cage Specific Enhancer: RCSE) がSox9遺伝子から遠く離れた1Mb付近に存在し、これが転写因子Stat3によって制御されることをつきとめました。
- この発見は、キャンポメリックディスプラシアやアキャンポメリックディスプラシアといった先天性骨軟骨形成異常症の病態解明へとつながる可能性があります。
東京医科歯科大学大学院医歯学総合研究科システム発生再生医学分野の淺原弘嗣教授と日本医科大学医学部整形外科学大学院生ならびに東京医科歯科大学大学院医歯学総合研究科システム発生再生医学分野特別研究学生の望月祐輔大学院生は、日本医科大学医学部整形外科学、慶應義塾大学医学部整形外科学、産業技術総合研究所創薬分子プロファイリング研究センターらのグループとの共同研究で、Sox9遺伝子から遠く離れた1Mb付近に存在するエンハンサーとそこに結合するStat3という転写因子が、肋軟骨におけるSox9遺伝子の作動を制御する発現システムであることを見出しました。この研究成果は、先天性骨形成異常症キャンポメリックディスプラシアの原因の解明に寄与する可能性があります。この研究は、文部科学省科学研究費補助金(基盤研究)ならびに日本医療研究開発機構(AMED)革新的先端研究開発支援事業(AMED-CREST)「メカノバイオロジー機構の解明による革新的医療機器及び医療技術の創出」研究開発領域における研究開発課題「腱・靱帯をモデルとした細胞内・外メカノシグナルの解明とその応用によるバイオ靱帯の創出」(研究開発代表者:淺原弘嗣)、の支援のもとでおこなわれたもので、その研究成果は、国際科学誌Developmental Cell (デベロップメンタル・セル)に、2018年8月23日午前11時(米国東部時間)にオンライン版で発表されます。
研究の背景
軟骨細胞の分化や発生に必須の役割を持つ転写因子としてSOX9 (SRY-box9) が挙げられます。このSOX9遺伝子もしくはその周辺の突然変異により骨軟骨の異形成と性分化異常を主徴とする、重篤な先天性骨形成異常症 (キャンポメリックディスプラシア, アキャンポメリックディスプラシア)を引き起こすことが知られておりましたが、SOX9の遺伝子のスイッチ部分(エンハンサー)は、非常に長い距離(約2Mb)のどこかに存在するといった特殊なものであるため、現在まで解明されていませんでした。
研究成果の概要
近年、遺伝子改変を可能とするCRISPR (clustered regularly interspaced short palindromic repeats) /Cas systemを用いて、 エンハンサーの同定やエピジェネティックス制御の戦略が報告がされています。我々はこれらシステムを組み合わせることで、未だ明らかでないSox9の軟骨特異的なエンハンサーの同定を試みました。まず、Sox9の近傍に設計したCRISPR/Cas systemをレトロウイルスによりマウスの初代肋軟骨細胞に対し導入後、クロマチン免疫沈降とシークエンス(ChIP-seq)によってSox9から約1Mb離れたところに軟骨エンハンサー(RCSE)の候補を見出しました(図1)。
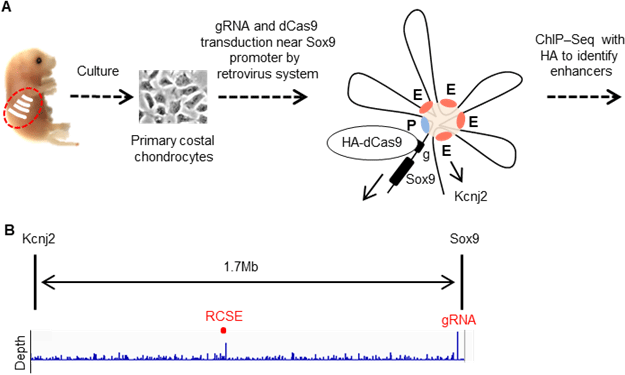
図1 Sox9上流1Mb付近に存在する肋軟骨特異的エンハンサー (RCSE) を同定するまでの模式図
A. 胎児マウスの初代肋軟骨細胞を採取し、レトロウイルスを用いてSox9プロモーター領域付近のguide RNA (gRNA)とdeactivated Cas9 (dCas9)を遺伝子導入後、HA抗体にてChIP-seqを施行した模式図。
B. ChIP-seqの結果。gRNA領域に強いピークを認める他に、Sox9遺伝子から約1Mb離れた箇所に有意なピーク (RCSE)を認めました。
肋軟骨細胞において、この軟骨エンハンサーの候補領域に遺伝子の作動をストップする機能のあるエピジェネティックシステムを誘導すると、Sox9の遺伝子の作動が弱まることが確認されたため、遺伝子スイッチとして機能することが示唆されました。
また、このRCSEが作動する部位で青く染まるLacZ-トランスジェニックマウスを作成したところ、肋骨の軟骨に青い染色が見られたため、RCSEは肋軟骨においてのみSox9を作動させるスイッチであることがわかりました(図2)。
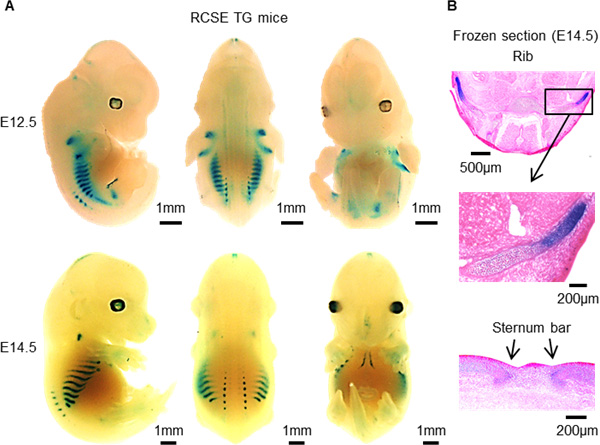
図2 RCSE領域をSox9プロモーターにつなぎLacZ配列を含んだベクターを用いたトランスジェニックマウスの作成
A. E12.5ならびにE14.5のトランスジェニックマウスでX-gal染色を行った全体像。E12.5およびE14.5両方で肋軟骨特異的な染色を認めており、E14.5では胸骨部分にも染色を認めました。
B. E14.5のトランスジェニックマウスの切片。肋軟骨、および胸骨に染色を確認できます。
さらに、この軟骨スイッチRCSEをCRISPR/Cas9を用いて欠失させたノックアウトマウスを解析したところ、肋軟骨を含んだ胸郭のみの低形成・狭小化を認めました(図3)。また切片では肋軟骨のみで増殖軟骨細胞層の狭小化、および肥大軟骨細胞層の増大を認めました。これによって、このスイッチが肋軟骨におけるSox9遺伝子の作動に必要不可欠であることが証明されました。
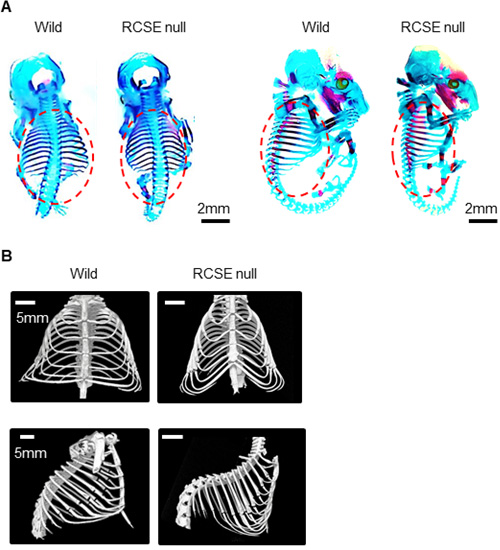
図3 RCSE領域を欠失させたノックアウトマウスの作成
A. E16.5の骨格標本。RCSEノックアウトマウスでは肋軟骨を含んだ胸郭のみの狭小化・低形成を認めました。
B. 生後10週のマイクロCT画像。骨格標本と同様、RCSEノックアウトマウスで胸郭のみの狭小化・低形成を認めています。
最後に、このRCSEに結合するタンパクを質量分析装置をもちいて解析したところ、Sox9のスイッチを押す転写因子としてStat3 (Signal transducer and activator of transcription 3)が同定されました。このStat3遺伝子を欠損させると、Sox9が作動しなくなり、軟骨発生が抑制されました。
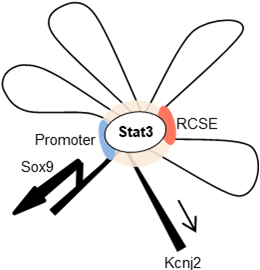
図4 転写因子Stat3が肋軟骨特異的エンハンサーであるRCSE領域を介してSox9の発現を制御している模式図
研究成果の意義
現在、ゲノムの機能を解析するための様々な手法が開発されていますが、それぞれ一長一短があり、まだまだ、未解明の先天性疾患や難病が多く残されています。
本研究では、最近までに報告されてきた複数のCRISPR/Cas9を用いた研究手法を組み合わせることによって、初めて肋軟骨におけるSox9遺伝子のスイッチ機構を明らかにすることができました。これらの結果は、先天性骨軟骨形成異常症(キャンポメリックディスプラシア)の疾患メカニズムの解明につながるものであり、本研究で用いられた手法は他の疾患の研究にも生かされることが期待されます。
論文情報
掲載誌: Developmental Cell
論文タイトル: Combinatorial CRISPR/Cas9 approach to elucidate a far-upstream enhancer complex for tissue-specific Sox9 expression