024-04-23 理化学研究所,京都大学iPS細胞研究所,関西医科大学,京都大学,国立遺伝学研究所,埼玉医科大学
理化学研究所(理研)バイオリソース研究センター iPS創薬基盤開発チームの大塚 悠生 研修生(京都大学大学院 医学研究科 眼科学講座 大学院生(いずれも研究当時))、今村 恵子 客員研究員(京都大学iPS細胞研究所 特定拠点講師)、井上 治久 チームリーダー(京都大学iPS細胞研究所 教授)、関西医科大学 医学部 iPS・幹細胞応用医学講座の六車 恵子 教授、京都大学大学院 医学研究科 眼科学講座の辻川 明孝 教授、国立遺伝学研究所 発生遺伝学研究室の川上 浩一 教授、埼玉医科大学 医学部 ゲノム応用医学の三谷 幸之介 教授らの共同研究グループは、患者由来の人工多能性幹細胞(iPS細胞)[1]から3次元網膜オルガノイド[2]を作製およびゼブラフィッシュeys変異を作製して解析することにより、光刺激による視細胞[3]の細胞死がEYS関連網膜変性疾患[4]の病態に重要な役割を果たしていることを発見しました。本研究成果は、未知であったEYS関連網膜変性疾患の病態メカニズムを明らかにするとともに、特定の波長光への暴露を遮断することが治療の選択肢の一つになる可能性を示唆しています。
日本を含む多くの国では、遺伝性網膜変性疾患(Inherited retinal dystrophies:IRD)の最も多い原因としてEyes shut homolog(EYS)遺伝子の変異が知られています。ただし、EYSはマウス、ラットなどにおいては喪失しており、哺乳類における研究モデルがないという課題がありました。
今回、共同研究グループは、健常者と網膜変性疾患患者それぞれのiPS細胞から網膜オルガノイドを作製し、病態解析を行いました。健常者由来オルガノイドの視細胞においてEYSタンパク質は結合線毛[5]や外節[6]領域に局在していたのに対し、患者由来オルガノイドではこれらの領域での局在量が低下し、細胞質内に局在異常を生じていました。EYSは視細胞外節で働くタンパクの一つであるG-protein-coupled receptor kinase(GRK7)という分子と直接結合し、その外節への輸送に関与していることを発見し、患者由来オルガノイドでは外節へのGRK7の輸送量が低下していることを見いだしました。また、患者由来オルガノイドでは光刺激後に視細胞の細胞死が誘導されることが分かりました。さらに、ゼブラフィッシュeys遺伝子変異体を作製し解析を行い、ゼブラフィッシュモデルにおいても光刺激により視細胞の細胞死が誘導されることを明らかにしました。
本研究は、科学雑誌『JCI Insight』オンライン版(4月22日付:日本時間4月23日)に掲載されました。
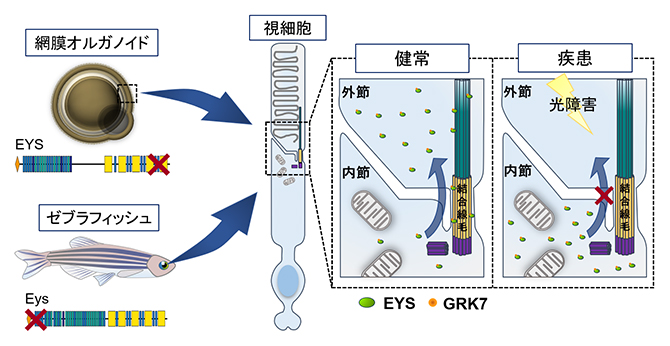
本研究に基づくEYS関連網膜変性疾患の病態の概略図
背景
網膜は複数種の神経細胞によって構成されています。眼に入ってきた光刺激は視細胞によって受容され、電気信号に変換されます。視細胞の構造と機能を図1に示します。
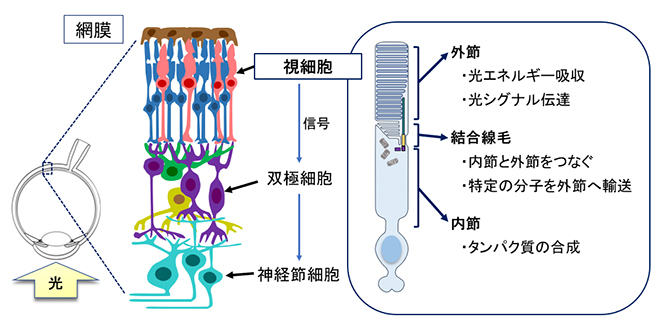
図1 ヒトの網膜と視細胞の基本構造
視細胞は、網膜の最も内側に位置する光刺激を初めに受容する細胞である。視細胞の構造は内節、結合線毛、外節に大きく分けられる。タンパク質はすべて内節において合成され、結合線毛を介して外節へと輸送され、光エネルギー吸収や光シグナル伝達に使用される。
遺伝性網膜変性疾患(Inherited retinal dystrophies:IRD)は、視細胞が障害され徐々に脱落してしまう進行性の疾患群であり、不可逆的な視力低下を引き起こします。IRDの原因として280以上の遺伝子が報告されていますが、Eyes shut homolog(EYS)は、日本を含むさまざまな国で最も頻度の高い原因遺伝子です。しかし、マウスにおいてはEYS遺伝子が欠損しているなどの理由から哺乳類モデルが存在せず、EYS遺伝子変異によるIRDの病態は十分に解明されていませんでした。これまでEYSの研究にはゼブラフィッシュが一般的に使用されてきましたが、ヒトと遠縁な種であり、ヒト由来のサンプルを用いた研究が望ましいと考えられていました。一方、近年ヒトiPS細胞から作製した3次元網膜オルガノイドを利用して、いくつかのIRD原因遺伝子の分子病態が調べられており、網膜オルガノイドのヒト由来の疾患モデルとしての有用性が報告されています。
研究手法と成果
共同研究グループは、健常者とEYS関連網膜変性疾患の患者から作製したiPS細胞を使用し、180日間分化誘導させることで生体に近い構造を持つ3次元網膜オルガノイドを作製しました。どちらのiPS細胞から作製したオルガノイドも表層部分に視細胞層が形成され、視細胞の内部には内節、結合線毛、外節の微細構造が形成されました。その形成過程において、健常者由来オルガノイドと患者由来オルガノイドに構造上の差異は認められませんでした(図2)。
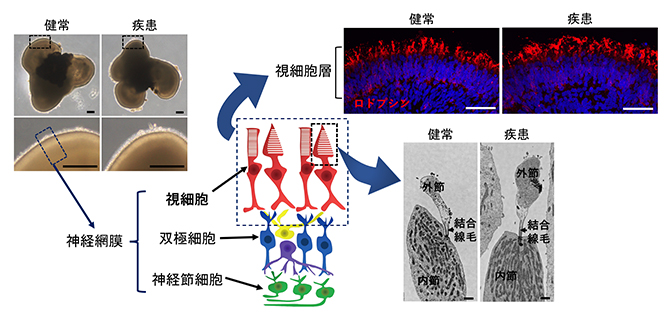
図2 ヒトiPS細胞からの網膜オルガノイドの作製
左上)180日間培養した網膜オルガノイドの代表的な明視野の画像。神経網膜が表層部分に層状に形成されている。スケールバーは200マイクロメートル(μm、1μmは1,000分の1ミリメートル)。
右上)網膜オルガノイドを視細胞に特異的なマーカー(ロドプシン、赤)で染色した画像。オルガノイドの表層に視細胞層が形成されているのが確認できる。スケールバーは50μm。
右下)網膜オルガノイドの視細胞の内部構造を電子顕微鏡で観察した画像。視細胞内部に見られる微細構造の内節、外節、結合線毛がすでに発達している。スケールバーは1μm。
健常者由来オルガノイド、患者由来オルガノイドにおいてEYSタンパク質の発現量に差は認められませんでしたが、EYSの細胞内の局在が異なっていました。すなわち、健常者視細胞ではEYSは結合線毛や外節領域に有意に局在していたのに対し、患者視細胞ではこれらの領域の局在量が低下し、細胞質内に局在異常を来していました(図3)。
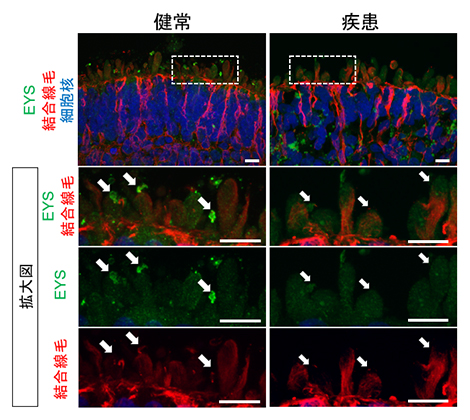
図3 視細胞内でのEYSの局在評価
180日目の網膜オルガノイドにおいてEYSを染色した画像。健常者視細胞(左)においてはEYS(緑)が結合線毛(赤、白矢印)領域に局在していた。一方、患者視細胞(右)においてはEYSが結合線毛の領域に認められていない。スケールバーは10μm。
結合線毛は外節で働くタンパク質の輸送に重要な構造であるため、EYSは特定のタンパク質の内節から外節への輸送に関与していると予想しました。そこでEYSと同様に夜行性哺乳類で喪失を認めるG-protein-coupled receptor kinase(GRK7)という分子に注目し評価を行いました。GRK7は視細胞外節で光シグナル伝達を遮断することで、順応や光障害からの保護に関与している分子です。免疫沈降法[7]によりEYSとGRK7は複合体を形成すること、そして患者由来オルガノイドにおいてGRK7の外節への輸送量が低下していることを見いだしました(図4)。
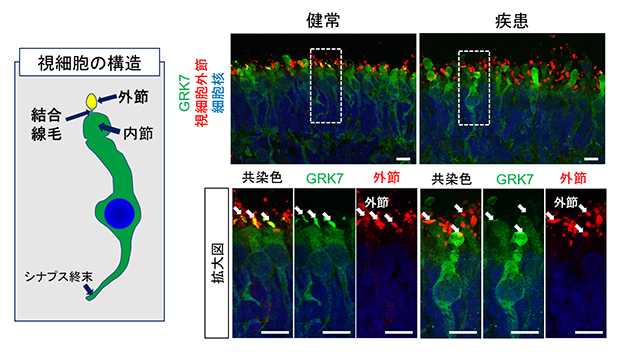
図4 網膜オルガノイドにおけるGRK7の局在評価
左)網膜オルガノイド内に形成される視細胞構造の概略。外節や結合線毛は視細胞の最も上部(オルガノイドの外側方向)に形成される。
右)180日目の網膜オルガノイドにおいてGRK7を染色した画像。健常者視細胞において、GRK7(緑)は視細胞内に全体的に均一に染色されているが、一部、外接領域(赤、白矢印)に多く局在していた。一方、患者視細胞においては、GRK7は外節領域の染色が乏しい。スケールバーは10μm。
GRK7は視細胞外節において光保護に関与しているため、GRK7の外節への輸送量の低下は光障害を引き起こす可能性があると考えました。そこで網膜オルガノイドに白色のLED光源で光暴露を行いました。その結果、患者由来オルガノイドでは活性酸素[8]が産生され、視細胞の細胞死が誘導されました(図5)。GRK7の局在異常や光暴露後の視細胞の細胞死はeysノックアウトゼブラフィッシュ[9]でも同様に確認されました。
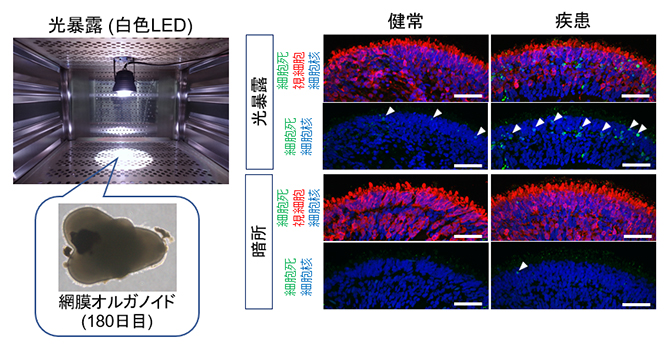
図5 網膜オルガノイドにおける光誘導性の視細胞死評価
左)180日目の網膜オルガノイドに対して白色LED光源を用いて24時間の光暴露を行った。
右)光暴露後と通常の暗所培養後の網膜オルガノイドにおいて細胞死を表すマーカー(緑)を染色した画像。視細胞は赤色で標識されている。細胞死マーカー陽性細胞(白矢頭)は健常者由来オルガノイドや暗所培養した患者由来オルガノイドではほぼ検出しないが、光暴露後の患者由来オルガノイドで多数観察された。スケールバーは50μm。
さらに、より波長域を限局した光源(青、緑、赤色光)を健常者由来と患者由来のオルガノイドに照射して細胞死の程度を評価すると、同じ照度下では青色光が患者由来オルガノイドで最も光誘導性の視細胞死を引き起こしやすいことが分かりました(図6)。
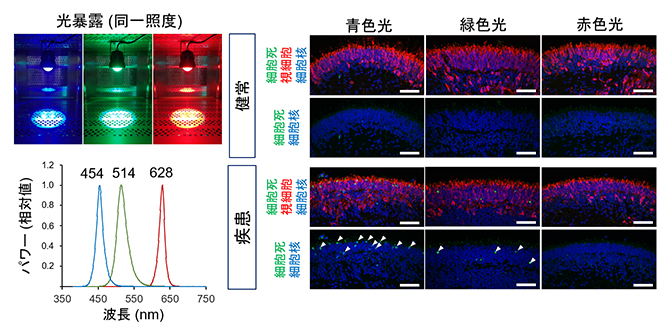
図6 網膜オルガノイドにおける各波長光の視細胞死へ与える影響
左)180日目の網膜オルガノイドに同一照度の各波長光のLED光源(青色光、緑色光、赤色光;ピーク波長はそれぞれ、454ナノメートル(nm、1nmは10億分の1メートル)、514nm、628nm)を24時間暴露した。
右)各波長の光源での光暴露後の網膜オルガノイドを使用して、細胞死を表すマーカー(緑)で染色した画像。視細胞は赤色で標識されている。細胞死マーカー陽性細胞(白矢頭)は青色光暴露後の患者由来オルガノイドで最も多く観察された。スケールバーは50μm。
これらの結果から、患者由来iPS細胞から作製したEYS変異モデルにおいて、光誘導性の細胞傷害が、EYS関連網膜変性疾患の病態に重要である可能性が示されました。
今後の期待
本研究では、EYS関連網膜変性疾患患者のiPS細胞から網膜オルガノイドを作製することで、光刺激による視細胞死がEYS関連網膜変性疾患の病態に関与していることを示しました。本研究で得られた知見をもとに、今後、EYS関連網膜変性疾患において、特定の波長光への暴露を減じるなど新たな治療法の開発に役立つことが期待されます。
補足説明
1.人工多能性幹細胞(iPS細胞)
体を構成するほぼ全ての種類の細胞へ変化(分化)する能力を多能性といい、脊椎動物の初期胚などに見られる。多能性を持ち、試験管内で培養して無限に増やすことができる細胞を多能性幹細胞という。iPS細胞は、成人の血液や皮膚などの体細胞にOct3、Sox2、Klf4遺伝子などを導入して人工的に作製した多能性を持つ幹細胞である。
2.オルガノイド
試験管の中で幹細胞から作るミニチュアの臓器。幹細胞の持つ自己複製能と分化能を利用して、自己組織化させることで3次元的な組織様構造体として形成される。
3.視細胞
網膜を構成する細胞の一種で、光を受容し、その信号を網膜内の別の神経細胞へ伝達する重要な役割を担っている。視細胞は大きく分けて、錐体(すいたい)視細胞と杆体(かんたい)視細胞の2種類が存在する。錐体視細胞は明るいところ、杆体視細胞は暗いところで物を見るときにそれぞれ使われる。
4.網膜変性疾患
失明を含む強度の視力障害に至る重篤な疾患で、網膜を構成する細胞のうち、光受容体である視細胞が加齢や遺伝的原因などで変性し脱落するために起こる。代表的なものに網膜色素変性がある。
5.結合線毛
視細胞の内部に見られる構造の一つ。視細胞の構造は内節、結合線毛、外節に大きく分けられる。結合線毛は内節と外節を空間的に分断し、内節から外節への分子の輸送に重要な構造である。結合線毛においては、特定の分子が1分間に何千個も外節へ運ばれることで外節の恒常性を維持している。
6.外節
視細胞の内部に見られる構造の一つ。視細胞外節においてはロドプシンやオプシンといった光受容分子が光エネルギーを吸収することで、光シグナル伝達を行っている。
7.免疫沈降法
ある特定の物質へ結合する抗体を用いて、特定の分子を混合物の中から選択的に単離する方法。電気泳動などの他の手法と組み合わせることで、タンパク質同士の相互作用などの解析が可能となる。
8.活性酸素
呼吸によって体内に取り込まれた酸素分子の一部が、より反応性の高い化合物に変化したものの総称。体内の代謝過程においていろいろな成分と反応し、過剰になると細胞傷害をもたらす。
9.ノックアウトゼブラフィッシュ
遺伝子操作により特定の遺伝子を人為的に欠損させたゼブラフィッシュ。
研究支援
本研究の一部は、国立研究開発法人日本医療研究開発機構(AMED)再生・細胞医療・遺伝子治療研究中核拠点(課題番号JP23bm1323001)の助成により行われました。また、本研究には理研バイオリソース研究センターから提供されたバイオリソース(ヒトiPS細胞株HPS3920、HPS5234、HPS3933、HPS3927、HPS0063、HPS1042)が使用されました。
原論文情報
Yuki Otsuka, Keiko Imamura, Akio Oishi, Kazuhide Asakawa, Takayuki Kondo, Risako Nakai, Mika Suga, Ikuyo Inoue, Yukako Sagara, Kayoko Tsukita, Kaori Teranaka, Yu Nishimura, Akira Watanabe, Kazuhiro Umeyama, Nanako Okushima, Kohnosuke Mitani, Hiroshi Nagashima, Koichi Kawakami, Keiko Muguruma, Akitaka Tsujikawa, Haruhisa Inoue, “Phototoxicity avoidance is a potential therapeutic approach for retinal dystrophy caused by EYS dysfunction”, JCI Insight, 10.1172/jci.insight.174179
発表者
理化学研究所
バイオリソース研究センター iPS創薬基盤開発チーム
チームリーダー 井上 治久(イノウエ・ハルヒサ)
(京都大学iPS細胞研究所 教授)
客員研究員 今村 恵子(イマムラ・ケイコ)
(京都大学iPS細胞研究所 特定拠点講師)
研修生(研究当時)大塚 悠生(オオツカ・ユウキ)
(京都大学大学院 医学研究科 眼科学講座 大学院生(研究当時))
関西医科大学医学部 iPS・幹細胞応用医学講座
教授 六車 恵子(ムグルマ・ケイコ)
京都大学大学院 医学研究科 眼科学講座
教授 辻川 明孝(ツジカワ・アキタカ)
国立遺伝学研究所 発生遺伝学研究室
教授 川上 浩一(カワカミ・コウイチ)
埼玉医科大学 医学部 ゲノム応用医学
教授 三谷 幸之介(ミタニ・コウノスケ)
報道担当
理化学研究所 広報室 報道担当
京都大学iPS細胞研究所(CiRA)国際広報室
関西医科大学広報戦略室
京都大学医学研究科総務企画課 企画広報掛
国立遺伝学研究所 リサーチ・アドミニストレーター室 広報チーム
埼玉医科大学 広報室