2024-08-12 理化学研究所,京都大学
理化学研究所(理研)バイオリソース研究センター 遺伝工学基盤技術室の廣瀬 美智子 テクニカルスタッフⅡ、小倉 淳郎 室長、マウス表現型解析技術室の田村 勝 室長、京都大学大学院 医学研究科 糖尿病・内分泌・栄養内科学の村上 隆亮 助教、稲垣 暢也 名誉教授らの共同研究グループは、ハムスターの遺伝子を改変することにより、やせ型糖尿病モデル動物の開発に成功しました。
本研究成果は、やせ型糖尿病の発症機構の解明や治療法の開発に用いられることが期待されます。
今回、共同研究グループは、糖質や脂質の代謝がヒトに類似しているといわれているゴールデンハムスター[1]を用いて、卵管内ゲノム編集法(i-GONAD法)[2]により糖尿病の原因遺伝子の一つであるIRS2(インスリン受容体基質タンパク質2)遺伝子を働かないようにすることで、やせ型糖尿病モデルハムスターの開発に成功しました。日本の糖尿病患者数は予備軍含めて推計2,000万人以上といわれており、その多くは東アジア特有のやせ型糖尿病です。今回開発したハムスターは、日本における糖尿病の発症機構の解明や治療法の開発に用いることができる貴重な実験モデルといえます。
本研究は、科学雑誌『Scientific Reports』オンライン版(8月12日付:日本時間8月12日)に掲載されました。
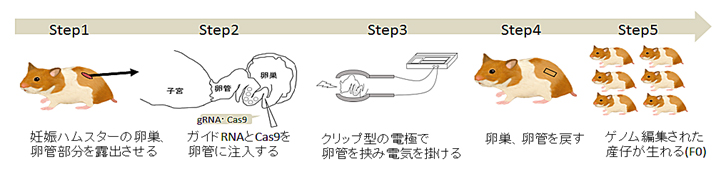
卵管内ゲノム編集法によるやせ型糖尿病モデルハムスターの作出
背景
糖尿病は、全世界で増え続けている全身性の疾患で、その合併症により多くの人命が失われています。日本でも予備軍含めて推計国内患者2,000万人以上が罹患している注)とされ、その多くが腎不全に移行し、人工透析治療が必要になります。糖尿病には1型と2型があり、2型糖尿病は食生活などの環境因子と体質(遺伝)の組み合わせで起こる最も一般的な糖尿病です。西欧では肥満型の2型糖尿病が多い一方で、日本を含む東アジアではやせ型の2型糖尿病が多数を占めることが知られています。
インスリン[3]の細胞内伝達調節因子であるIRS2(インスリン受容体基質タンパク質2)は、糖尿病の関連因子の一つとして知られています。そこで、共同研究グループは、糖代謝がヒトに類似しているといわれているゴールデンハムスターを用いて、IRS2ノックアウト(KO)[4]ハムスターを作出し、糖尿病モデル動物の開発を試みました。
注1)厚生労働省のホームページ「糖尿病患者数の状況」
研究手法と成果
共同研究グループは、卵管内ゲノム編集法(i-GONAD法)を用いてIRS2 KOハムスターの作出を試みました。その結果、1匹のKOハムスターの作出に成功し、そのKO個体を用いた交配によりIRS2 KO系統を樹立しました。ホモ型KO[5]ハムスターは、ヘテロ型KO[5]および野生型[6]ハムスターに比べ、生後から継続的に低体重を示しました(図1左)。またホモ型KOハムスターは、血糖値および過去1~2カ月の血糖値を反映するといわれているHbA1c(ヘモグロビン・エーワンシー)が野生型に比べて有意に高くなっていました(図1右)。
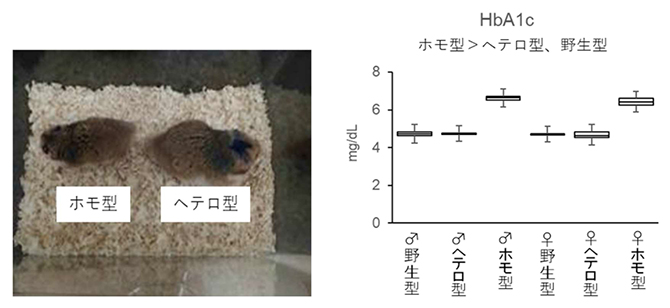
図1 ホモ型KOハムスターの体重減少とHbA1cの高値
ホモ型KOハムスターは生後から継続的に低体重を示した。ホモ型KOハムスターはヘテロ型KOに比べ体が小さい(左)。ホモ型KOハムスターは、ヘテロ型KOおよび野生型ハムスターに比べ有意に高いHbA1c値を示した(右)。
さらに、体内のグルコース(ブドウ糖)代謝を見るために三つの体内グルコース代謝試験を行いました。まずグルコース負荷試験を行うと、ホモ型KOハムスターはヘテロ型KOや野生型ハムスターに比べ血中のグルコース値の上昇が有意に高くなり、ブドウ糖を投与してから120分後まで高値で推移しました(図2左上)。一方、インスリン耐性試験では、ホモ型KOハムスターはインスリン投与に対して正常に反応しました(図2右上)。グルコース投与によるインスリン分泌試験では、ホモ型KOハムスターはインスリンレベルが上昇しないことが分かりました(図2左下)。これらの結果から、ホモ型KOハムスターではインスリンを分泌する膵臓(すいぞう)β細胞の機能が不十分であることが示唆されました。
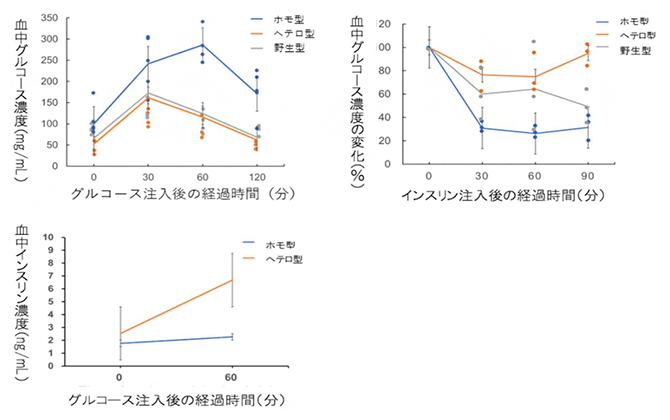
図2 体内のブドウ糖代謝試験
グルコース負荷試験では、ホモ型KOハムスターはブドウ糖を投与して120分後も血糖値(グルコース)は高いままであった(左上)。インスリン耐性試験では、ホモ型KOハムスターはインスリンに対して正常に反応した(右上)。血清インスリン量を見ると、ホモ型KOハムスターはグルコースを投与後も血中のインスリン量に変化はなかった(左下)。
そこで、組織免疫染色でインスリンを分泌する膵臓β細胞を調べると、ホモ型KOハムスターではインスリン陽性細胞の相対的面積が有意に減少しており、β細胞を含む膵島(すいとう)[7]もヘテロ型KOハムスターに比べ小さくなっていました(図3)。
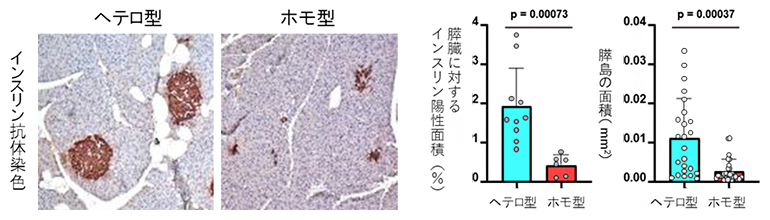
図3 KOハムスターの膵臓のインスリン分泌細胞の観察
ホモ型KOハムスターでは、ヘテロ型KOハムスターに比べインスリン陽性細胞が減少している。
最後に膵臓から膵島を分離し、インスリン分泌試験を行いました。ホモ型KOハムスターの膵島当たりのインスリン分泌量は有意に低く、インスリン含有量も低いことが分かりました(図4)。また、ホモ型KOハムスターでは膵島細胞当たりのインスリン分泌量とインスリン含有量も低下していました。これらの結果は、ホモ型KOハムスターのβ細胞機能不全を示すものであり、体内グルコース代謝試験の結果を裏付けています。
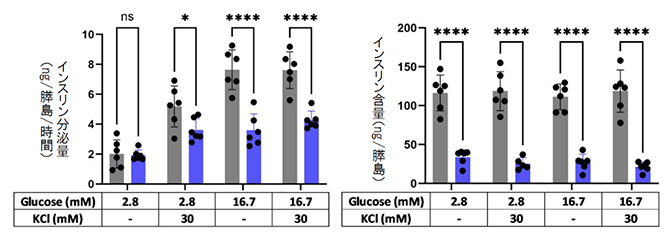
図4 膵島のインスリン分泌および含有量試験
膵島当たりのインスリン分泌量(左)と含有量(右)が、野生型ハムスター(灰色)に比べ、ホモ型KOハムスター(青色)で大きく低下していた。インスリン分泌は、グルコース単独あるいは塩化カリウム(KCl)との併用で誘導し、それぞれの投与の有無における試験結果を示している。
ns:統計学的に有意差なし、*:P < 0.05、****:P < 0.0001。
今後の期待
2型糖尿病の発症機構の解明と治療方法の開発には、糖尿病モデル動物の使用は欠かせません。これまで糖尿病モデル動物の多くは、肥満型の糖尿病モデル動物であったため、日本を含む東アジアに多いやせ型糖尿病の研究に適切なモデル動物はいませんでした。
今回作出されたやせ型糖尿病モデルハムスターは、一つの遺伝子機能が失われているだけですので、野生型ハムスターを実験対照(コントロール)として用いることで、信頼性の高い実験が実施可能です。このモデルの欠点として、胎児の時から全身で遺伝子機能が欠損しているために、出生前後に死んでしまう個体が多いということがあります。今後、遺伝子改変の工夫により発症を遅らせたり、遺伝子機能の欠損を特定の臓器に限定したりすることで、さらに研究開発に適した糖尿病モデルに改良されることが期待されます。
補足説明
1.ゴールデンハムスター
キヌゲネズミ科ゴールデンハムスター属に分類される齧歯(げっし)類。1930年にシリアで捕獲された野生個体3匹(同腹の雄1、雌2)の子孫が実験動物として世界中で広く用いられるようになった(このため、シリアンハムスターとも呼ばれる)。
2.卵管内ゲノム編集法(i-GONAD法)
受精卵を体外に取り出すことなく遺伝子の編集を行う体内電気穿孔(せんこう)法。胚操作技術がなくてもゲノム編集を行えるシンプルな手法として、東海大学の大塚正人教授らが開発した。i-GONADはimproved-Genome editing via Oviductal Nucleic Acids Delivery methodの略。
3.インスリン
膵臓から分泌されるホルモンの一種。膵島([7]参照)のβ細胞で産出される。グルコース(ブドウ糖)の代謝を調節し、血糖値を一定に保つ働きを持つ。
4.ノックアウト(KO)
特定の遺伝子を欠損(あるいは変異)させて、機能しないようにすること。
5.ホモ型KO、ヘテロ型KO
通常の常染色体(性染色体以外)上の遺伝子は、二つの相同染色体上にそれぞれ一つずつの遺伝子座がある。このため、遺伝子の完全な機能消失のためには、両遺伝子座が欠失している必要がある。これをホモ型KOと呼ぶ。一方、片側の遺伝子座のみが欠失している場合はヘテロ型KOと呼ぶ。ヘテロ型IRS2 KOハムスターはほぼ正常であった。
6.野生型
遺伝子改変をしていない基本的な遺伝子型。
7.膵島(すいとう)
膵臓に存在する内分泌腺。α細胞、β細胞、δ細胞の三つがある。ランゲルハンス島ともいう。
共同研究グループ
理化学研究所 バイオリソース研究センター
遺伝工学基盤技術室
テクニカルスタッフⅡ 廣瀬 美智子(ヒロセ・ミチコ)
専任研究員 井上 貴美子(イノウエ・キミコ)
専任研究員 的場 章悟(マトバ・ショウゴ)
大学院生リサーチ・アソシエイト 建部 貴輝(タテベ・タカキ)
大学院生リサーチ・アソシエイト 時田 駿(トキタ・シュン)
研究パートタイマーⅡ 百々 由希子(ドド・ユキコ)
テクニカルスタッフⅡ 冨島 俊子(トミシマ・トシコ)
テクニカルスタッフⅡ 長谷川 歩未(ハセガワ・アユミ)
室長 小倉 淳郎(オグラ・アツオ)
(開拓研究本部 小倉発生遺伝工学研究室 主任研究員、筑波大学大学院 生命環境科学研究科 教授)
マウス表現型解析技術室
テクニカルスタッフⅡ 尾崎 真央(オザキ・マオ)
テクニカルスタッフⅡ 篠木 晶子(シノギ・アキコ)
人材派遣 栁沢 僚子(ヤナギサワ・リョウコ)
室長 田村 勝(タムラ・マサル)
自治医科大学 先端医療技術開発センター 動物資源ラボラトリー
教授 本多 新(ホンダ・アラタ)
京都大学大学院 医学研究科 糖尿病・内分泌・栄養内科学
助教 村上 隆亮(ムラカミ・タカアキ)
研究員 ムハンマド・ファウジ(Muhammad Fauzi)
名誉教授 稲垣 暢也(イナガキ・ノブヤ)
(公益財団法人田附興風会 医学研究所北野病院 理事長)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業基盤研究(B)「ゴールデンハムスターを用いた新たな遺伝子改変モデルプラットフォームの確立(研究代表者:小倉淳郎)」「ゴールデンハムスターを用いた遺伝子改変モデルプラットフォームの高度化(研究代表者:小倉淳郎)」による助成を受けて行われました。
原論文情報
Michiko Hirose, Kimiko Inoue, Shogo Matoba, Takaki Tatebe, Syun Tokita, Yukiko Dodo, Toshiko Tomishima, Ayumi Hasegawa, Arata Honda, Mao Ozaki, Akiko Shinogi, Ryoko Yanagisawa, Muhammad Fauzi, Takaaki Murakami, Nobuya Inagaki, Masaru Tamura, Atsuo Ogura, “Disruption of insulin receptor substrate 2 (IRS2) causes non-obese type 2 diabetes with β-cell dysfunction in the golden (Syrian) hamster”, Scientific Reports, 10.1038/s41598-024-67513-9
発表者
理化学研究所
バイオリソース研究センター 遺伝工学基盤技術室
テクニカルスタッフⅡ 廣瀬 美智子(ヒロセ・ミチコ)
室長 小倉 淳郎(オグラ・アツオ)
マウス表現型解析技術室
室長 田村 勝(タムラ・マサル)
京都大学大学院 医学研究科 糖尿病・内分泌・栄養内科学
助教 村上 隆亮(ムラカミ・タカアキ)
名誉教授 稲垣 暢也(イナガキ・ノブヤ)
報道担当
理化学研究所 広報室 報道担当
京都大学 渉外・産官学連携部広報課国際広報室