2018-09-19 理化学研究所,広島大学
理化学研究所(理研)開拓研究本部佐甲細胞情報研究室の柳川正隆研究員、阿部充宏専任研究員、佐甲靖志主任研究員、生命機能科学研究センター細胞シグナル動態研究チームの廣島通夫上級研究員、上田昌宏チームリーダーらの共同研究グループ※は、細胞の膜にある「Gタンパク質共役型受容体(GPCR)[1]」が薬を受けて活性化されると、動きが遅くなることを発見しました。
本研究成果は、1分子レベルで薬の作用機序を理解する1分子薬理学の発展や、1分子イメージングを用いたGPCR標的化合物の薬効評価という新たなドラッグスクリーニング手法の開発に貢献すると期待できます。
今回、共同研究グループは、全反射蛍光顕微鏡[2]を用いて、生きた培養細胞中で蛍光標識した9種類のGPCRの動画を撮影し、個々の受容体分子の動きを追跡することで、薬による受容体分子の振る舞いの変化を解析しました。その結果、9種のGPCRは、いずれも活性化すると動きが遅くなることが分かりました。また、代謝型グルタミン酸受容体(mGluR)[3]について、受容体の動きと機能の関係を2色同時1分子イメージングなどにより詳しく解析しました。その結果、Gタンパク質[4]と相互作用中の受容体は動きが速いものが多いのに対し、クラスリン[5]と相互作用中の受容体は動きが止まったものが多いことを明らかにしました。受容体の動きと機能の関係は多くのGPCRに共通しているため、動きを見ることで新規化合物がGPCRにどのような作用を及ぼすか推定できるようになると考えられます。
本研究は、米国の科学雑誌『Science Signaling』(9月18日号)に掲載されます。
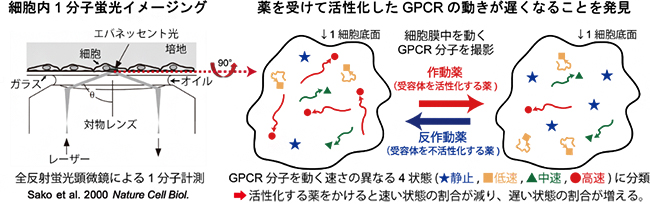
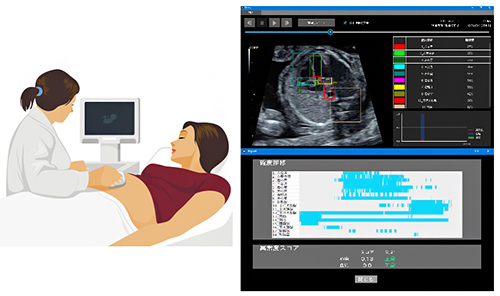
図 全反射蛍光顕微鏡を用いて生細胞膜中のGPCR1分子の動きを見て薬効を評価
※研究グループ
理化学研究所
開拓研究本部 佐甲細胞情報研究室
研究員 柳川 正隆(やながわ まさたか)
専任研究員 阿部 充宏(あべみ つひろ)
主任研究員 佐甲 靖志(さこう やすし)
生命機能科学研究センター
細胞シグナル動態研究チーム
上級研究員 廣島 通夫(ひろしま みちお)
チームリーダー 上田 昌宏(うえだ まさひろ)
広島大学大学院 理学研究科
准教授 冨樫 祐一(とがし ゆういち)
京都大学大学院 理学研究科
助教 山下 高廣(やました たかひろ)
教授(研究当時) 七田 芳則(しちだ よりのり)
(立命館大学 総合科学技術研究機構教授)
東京大学大学院 総合文化研究科
教授 村田 昌之(むらた まさゆき)
※研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金若手研究B「GPCRの1分子動態・機能連関の比較解析(領域代表者:柳川正隆)」、同新学術領域研究「生命分子システムにおける動的秩序形成と高次機能発現」の研究課題「細胞膜受容体の動的会合体形成と分子認識反応(領域代表者:佐甲靖志)」をはじめ、基盤研究A「情報蛋白質のリン酸化による細胞記憶の新たな分子機構(領域代表者:佐甲靖志)」、基盤研究B「細胞膜情報処理装置の再構成(領域代表者:佐甲靖志)」、若手研究B「Gタンパク質共役型受容体のヘテロ多量体配置転換の解析(領域代表者:柳川正隆)」による支援を受けて行われました。
背景
「Gタンパク質共役型受容体(GPCR)」は、光・匂い・味・神経伝達物質・ホルモンなど細胞外のさまざまな刺激を受けGタンパク質を活性化することで、細胞内へと情報を伝える膜タンパク質の総称です。GPCRは薬の標的分子として主要な位置を占めており、米国食品医薬品局(FDA)承認薬の約34%がGPCRを標的としています注1)。現状、薬の標的として利用されているGPCRは、ヒトが持つ約800種のうち100種程度であり、まだ高い潜在性を持っています。このため、生きた細胞においてGPCRの活性を定量する手法の開発は、薬理学・創薬にとって基盤的な課題といえます。
従来は、細胞中のGPCRの活性を評価する場合、GPCR自体を見るのではなく、GPCRが薬を受けたときに引き起こすカルシウムイオン(Ca2+)や環状アデノシン一リン酸(cAMP)[6]の増減などの細胞応答を計測することが一般的でした。しかし、GPCRにより活性化されるGタンパク質の種類により、GPCRが引き起こす細胞応答は異なるため、全てのGPCRの活性を一つの手法で定量することは困難です。
また、細胞には活性化されたGPCRを不活性化する機構が備わっており、不活性化の過程を定量することも薬効を評価する上で重要です。GPCRが薬を受けると、Gタンパク質共役受容体キナーゼ(GRK)によってGPCRのC末端部位がリン酸化されます。このリン酸化部位を認識してアレスチン[7]が結合することで、GPCRはGタンパク質と結合できなくなります。GPCRと結合したアレスチンはさまざまなタンパク質と相互作用することが知られていますが、その代表的な分子がクラスリンです。クラスリンが細胞膜上で重合して形成されるクラスリン被覆ピット(直径100-200nmのくぼみ)は、GPCRを細胞内へと輸送し、リサイクル・分解する機構を担うことが知られています。
このようにGPCRは細胞膜上のさまざまな分子と相互作用することが知られていますが、一連の過程を単一細胞で同時に定量することはできていません。そこで、共同研究グループは、GPCRが引き起こす特定の細胞応答を測るのではなく、薬が結合することでGPCR分子自体に生じる振る舞いの変化から薬効を評価することができないか、生細胞内1分子蛍光イメージング注2)を用いて検証しました。
注1)Hauser et al. “Trends in GPCR drug discovery: new agents, targets and indications”, Nature Reviews Drug Discovery16:829–842 (2017)
注2)Sako Y, Minoguchi S, and Yanagida T., “Single-molecule imaging of EGFR signaling on the surface of living cells”, Nature Cell Biology 2:168–172 (2000)
研究手法と成果
共同研究グループは、まず、モデルケースとしてクラスCのGPCRの一つである代謝型グルタミン酸受容体(mGluR3)を用いた検証を行いました。ヒト胎児腎細胞由来のHEK293細胞において、mGluR3を蛍光色素で標識して全反射蛍光顕微鏡で観察しました(図1a)。撮影した動画の各mGluR3の輝点を追跡して軌跡を解析することで、受容体が細胞膜中を動く速さ(拡散係数)を定量できます(図1b)。さまざまな薬剤条件下で1分子イメージングを行い、拡散係数の平均値を比較したところ、mGluR3が活性すると動きが遅くなることが明らかになりました。
さらに、統計解析を行い、拡散係数に基づいてmGluR3の状態で分類したところ、速さの異なる四つの拡散状態に分類できました(図1c)。mGluR3を不活性化する薬をかけると動きの速い分子の割合が増え、遅い分子の割合が減ります(図1d左)。一方、mGluR3を活性化する薬をかけると動きの速い分子の割合が減り、遅い分子の割合が増えます(図1d右)。
しかし、mGluR3の動きだけを見ていても、どのような下流分子との相互作用がどの拡散状態と関連しているのかは分かりません。そこで、Gタンパク質と相互作用中のmGluR3の拡散状態を調べるために、Gタンパク質をmGluR3とは異なる色の蛍光分子で染色し、2色同時1分子イメージングを行いました。2色の輝点が重なった領域を抽出してmGluR3の拡散状態を定量した結果、Gタンパク質と相互作用中のmGluR3は速く動いているものが多いことが示されました。さらに、百日咳毒素[8]を用いてGタンパク質とmGluR3の相互作用を阻害した際には、Gタンパク質と相互作用するmGluR3分子の割合が確かに減少し、速く動くmGluR3分子の割合が減ることも明らかになりました。
一方、クラスリンとmGluR3についても、同様の2色同時1分子イメージング解析を行ったところ、クラスリンと相互作用中のmGluR3は静止しているものが多いことが明らかになりました。また、mGluR3を活性化する薬剤の添加とともに、クラスリンと相互作用する受容体の割合が増え、相互作用時間も延びることが分かり、mGluR3分子の動きが薬による刺激依存的に変化した理由の一端が明らかになりました(図2)。
Gタンパク質やクラスリンとの相互作用はmGluR3だけではなく、多くのGPCRに共通して細胞膜上で生じる反応です。したがって、活性化に伴い細胞膜中での動きが遅くなるという現象は、他のGPCRに共通しているのではないかと推測されました。実際に、mGluR3とはアミノ酸配列の相同性がほとんどなく、活性化するGタンパク質の種類も様々な8種のGPCRについて同様の1分子イメージングを行ったところ、リガンド刺激依存的に拡散が遅くなることが共通して確認されました(図3)。
今後の期待
ヒトが持つ約800種のGPCRのうち、嗅覚受容体を除く340種程度が創薬の標的分子になり得ると考えられていますが、この中に内因性リガンド[9]が同定されていないオーファン受容体[9]が80種以上存在しています。これらのオーファン受容体は、活性化した際にどのような細胞応答が引き起こされるのかについても不明なものが多く、単一の細胞応答を指標とした化合物スクリーニング手法の選択が難しい場合があります。
本研究では、1分子イメージングを用いて生細胞膜中のGPCR分子の動きと機能の関係を明らかにしました。相互作用するGタンパク質の種類を問わず、活性化したGPCRの動きは遅くなるため、オーファン受容体であっても、分子の動きの変化を見ることで薬効を評価することが可能になると期待できます。 また、1種類のGPCRが複数種類の細胞応答を引き起こす場合も多いのですが、現状、単一の計測で複数の細胞応答を同時に計測することはできません。このため、一つの化合物の薬効を評価するためには、複数の手法でそれぞれの細胞応答を計測した結果から包括的に判断する必要があります。
一方、1分子イメージングでは、細胞膜中の全てのGPCR分子を見ることができます。今後、さまざまなGPCRで動きと機能状態の対応関係の情報をより多く集積すれば、動きを見るだけでGPCR分子がどのような機能状態にあるのかをある程度は推定可能になると考えられます。
本研究の手法を化合物スクリーニングに応用する場合、1分子イメージングの計測効率を大幅に向上させることが求められます。今後は、細胞シグナル動態研究チーム及び佐甲細胞情報研究室が共同開発した細胞内1分子イメージング自動解析システム(AiSIS)注3)を活用することで、実現を図りたいと考えています。
注3)Yasui et al. “Automated single-molecule imaging in living cells”, Nature Communicationsvolume 9: 3061 (2018)
原論文情報
Masataka Yanagawa, Michio Hiroshima, Yuichi Togashi, Mitsuhiro Abe, Takahiro Yamashita, Yoshinori Shichida, Masayuki Murata, Masahiro Ueda, Yasushi Sako, “Single-molecule diffusion-based estimation of ligand effects on G protein–coupled receptors”, Science Signaling, 10.1126/scisignal.aao1917
発表者
理化学研究所
主任研究員研究室 佐甲細胞情報研究室
主任研究員 佐甲 靖志(さこう やすし)
研究員 柳川 正隆(やながわ まさたか)
専任研究員 阿部 充宏 (あべ みつひろ)
生命機能科学研究センター 細胞シグナル動態研究チーム
チームリーダー 上田 昌宏
上級研究員 廣島 通夫(ひろしま みちお)
広島大学大学院 理学研究科
准教授 冨樫 祐一(とがし ゆういち)
報道担当
理化学研究所 広報室 報道担当
広島大学 財務・総務室 広報部 広報グループ
補足説明
-
- Gタンパク質共役型受容体(GPCR)
- 細胞膜をαヘリックスが7回貫通するという共通の構造モチーフ(7回膜貫通領域)を持つ膜受容体タンパク質の総称。ヒトが持つ約800種のGPCRは、アミノ酸配列の相同性に基づき、クラスA(ロドプシンファミリー)、クラスB1(セクレチンファミリー)、クラスB2(接着GPCRファミリー)、クラスC(グルタミン酸ファミリー)、クラスF(フリズルドファミリー)の五つのクラスに分類される。
-
- 全反射蛍光顕微鏡
- 細胞を培養している溶液とカバーガラスの界面で全反射するようにレーザーを加工し、ガラスから染み出るエバネッセント光で蛍光分子を励起して観察する顕微鏡。全反射照明を用いることで、カバーガラス上に培養した細胞の底面から約200ナノメートル(nm、1nmは10億分の1m)の領域を選択的に励起して観察することができる。これにより、細胞内の蛍光色素からのバックグラウンドを下げてS/N比よく検出できるため、細胞膜近傍の蛍光標識した分子の密度が低い場合は、蛍光色素1分子からの蛍光を検出できる。
-
- 代謝型グルタミン酸受容体(mGluR)
- mGluRは脳神経系に広く局在しており、主要な神経伝達物質であるグルタミン酸を受容し、神経細胞間の情報伝達を担うクラスC GPCR。ヒトは8種類のmGluRを持ち、本研究でモデルとして用いたmGluR3は統合失調症との関連が示唆される分子の一つである。mGluRは細胞外に大きなリガンド結合領域を持っており、ニつの細胞外領域が共有結合によってつながれて、常に二量体として機能するという構造的な特徴を持つ。
-
- Gタンパク質
- 細胞内においてさまざまなシグナル伝達に関わるグアニンヌクレオチド結合タンパク質の総称。GPCRはα、β、γの三つのサブユニットからなる3量体Gタンパク質のGDP-GTP交換反応を促進することでGタンパク質を活性化する。活性化したGタンパク質は、種類によりに異なるシグナル伝達経路を活性化する。例えば、Gsはアデニル酸シクラーゼを活性化しcAMP濃度を上昇させる一方、Giはアデニル酸シクラーゼを抑制しcAMP濃度を低下させる。また、GqはホスホリパーゼCを活性化し細胞質中のCa2+濃度を上昇させる。
-
- クラスリン
- 細胞膜にある膜タンパク質や細胞外マトリクスを細胞内に取り込む際に形成されるクラスリン被覆ピット・小胞の主要な構成分子。GPCRの細胞膜から細胞内小器官(エンドソーム)への輸送は、クラスリン被覆小胞を介して行われることが多い。
-
- 環状アデノシン一リン酸(cAMP)
- 細胞内でのエネルギー伝達体であるATPから合成される。種々の外界情報を細胞内の標的分子に伝える細胞内シグナル伝達のセカンドメッセンジャーとして働き、cAMP依存性タンパク質リン酸化酵素を活性化して多くのタンパク質をリン酸化するほか、糖や脂質の分解などの多くの生物学的過程を制御する。
-
- アレスチン
- 活性状態のGPCRに結合し、Gタンパク質とGPCRの相互作用を阻害する細胞内のタンパク質。アレスチンはGPCRを不活性化する役割を担うだけでなく、細胞内シグナル伝達に関わる様々な分子と相互作用し、Gタンパク質とは異なる持続的な細胞応答を引き起こす。
-
- 百日咳毒素
- 3量体Gタンパク質の1グループであるGi/oのαサブユニットのC末端を選択的にADPリボシル化することでGi/oとGPCRの結合を阻害する毒素。なお、mGluR3はGi/oグループのGタンパク質と選択的に相互作用することが知られている。
-
- 内因性リガンド、オーファン受容体
- 生体内で合成され、受容体に結合して活性を制御するリガンド。これに対し、体外から取り込まれて受容体の活性を制御する化合物を外因性リガンドと呼ぶ。また、内因性リガンドが同定されていない生理機能未知の受容体をオーファン受容体と呼ぶ。
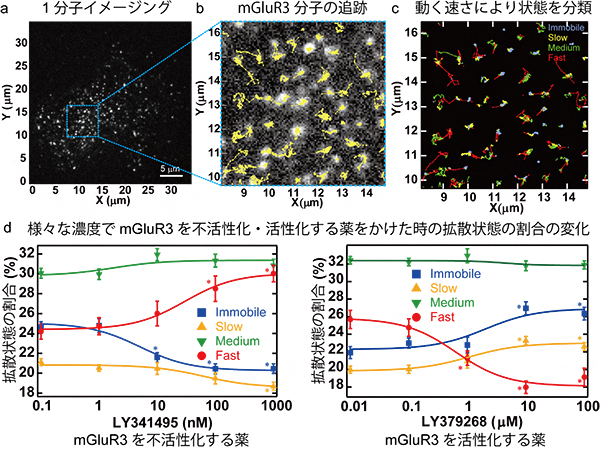
図1 代謝型グルタミン酸受容体(mGluR3)の1分子イメージングの解析
a)mGluR3に蛍光標識をしたHEK293細胞の全反射蛍光顕微鏡像。図全体が1細胞で、各輝点がmGluR3の分子。
b)各輝点の軌跡を表示した像。a)の四角領域の拡大し、約3秒間のmGluR3分子の軌跡を黄色で示した。
c)軌跡の情報を統計解析し、動く速さの異なる四つの状態にmGluR3分子を分類した。
d)mGluR3を不活性化(左図)・活性化(右図)する薬を、さまざまな濃度でかけたときに生じる4状態の割合の変化。左図:mGluR3が不活性化すると速く動く状態(赤線)の割合が増え、静止状態の割合(青線)が減る。右図:mGluR3が活性化すると速く動く状態の割合が減り、静止状態の割合が増える。
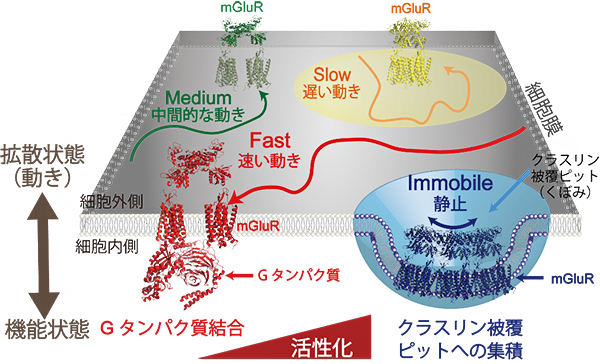
図2 mGluR3の生細胞膜中の動きと機能状態の関係
2色同時1分子イメージングと阻害実験により、Gタンパク質と相互作用中のmGluR3は速く動くものが多く、クラスリンと相互作用中のmGluR3は静止したものが多いことが明らかになった。薬をかけた際に生じるmGluR3の動きの変化は、これらの機能状態の割合が変化することが反映したものと考えられる。
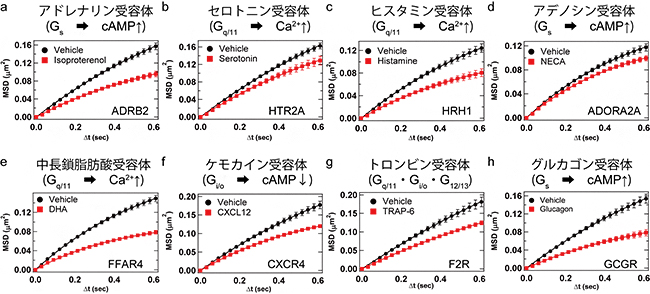
図3 他のGPCRの薬刺激による拡散範囲の平均値の変化
mGluR3とは異なるファミリーに属する8種のGPCRの動きを、1分子イメージングにより定量した結果を示す。a)アドレナリンB2受容体、b)セロトニン2A受容体、c)ヒスタミンH1受容体、d)アデノシンA2A受容体、e)遊離脂肪酸受容体4、f)ケモカインCXCR4受容体、g)トロンビンPAR1受容体はクラスA、h)グルカゴン受容体はクラスBのGPCRである。各GPCRが主に活性化するGタンパク質を括弧内に示す。各輝点の軌跡の情報を解析し、時間Δtの間に受容体分子が初期位置からどれだけ遠くまで拡散するか(拡散範囲:MSD)の平均値をプロットしている。薬をかけたとき(赤)は薬がないとき(黒)に比べて、同じ時間Δtの間に拡散する範囲が狭くなることが分かる。