2024-09-11 理化学研究所,京都大学,東京都健康長寿医療センター
理化学研究所(理研)開拓研究本部 渡邉分子生理学研究室の渡邉 力也 主任研究員、飯田 龍也 テクニカルスタッフⅠ、京都大学 医生物学研究所の野田 岳志 教授、東京都健康長寿医療センターの豊田 雅士 研究副部長らの共同研究グループは、新型コロナウイルス(SARS-CoV-2)やインフルエンザなどのウイルス遺伝子を「1分子」レベルで識別し、世界最速で検出できるポータブル遺伝子検査装置を開発することに成功しました。
本研究成果は、臨床現場での即時検査に対応した、次世代の遺伝子検査装置として、多種感染症の層別化・早期診断などの医療現場のニーズに即した実用化が期待されます。
今回、共同研究グループは、2022年に開発した「COWFISH」をさらに小型化・低コスト化したポータブル遺伝子検査装置「COWFISH2」を開発しました。COWFISH2は、従来のCOWFISHと比較して、設置面積比で約5分の1以下、重量比で約6分の1以下まで小型化し、構成部品の総額を80万円程度と約3分の2以下まで低コスト化することに成功しました。また、急性呼吸器感染症を例として、SARS-CoV-2に加えて、インフルエンザA型/B型を同時に検出できる多項目遺伝子検査を実現するとともに、臨床検体を用いた実証実験では、感度[1]94%、特異度[2]98%を達成しました。
本研究は、科学雑誌『iScience』オンライン版(9月1日付)に掲載されました。

ポータブル遺伝子検査装置(COWFISH2)の外観
背景
現在、ウイルス感染症の感染診断では、主にウイルスのタンパク質抗原を検出する方法(抗原検査法)とウイルスRNAを増幅して検出する方法(PCR検査法[3])が利用されており、それぞれスクリーニング、確定診断などの用途に応じて使い分けられています。抗原検査法は30分間程度で迅速かつ簡便にウイルスを検出できるため、スクリーニングには適していますが、検出感度や特異度の低さに起因する検出エラーの多さが問題になっています。一方、PCR検査法は感度が優れ、確定診断に適していますが、検出の前処理に最短で1時間程度かかるため、大量の検体を迅速に解析し、診断につなげることが困難です。そのため、PCR検査法の「感度の高さ」と、抗原検査法の「迅速・簡便さ」を両立させた新しい検査法の開発が期待されています。
この背景を踏まえ、渡邉 主任研究員らは2021年に世界最速・非増幅遺伝子検査法「SATORI法」注1)を(図1)、2022年にはSATORI法を実装した全自動遺伝子検査装置「opn-SATORI」注2)、および小型装置「COWFISH」注3)を開発しました。これらの検査装置では、CRISPR-Cas13a[4]と呼ばれる酵素と微小試験管を集積したマイクロチップを用いることで、ウイルスの遺伝子を「1分子」レベルで識別し、9分程度の世界最速の迅速検出が可能となります(図1)。検出限界値は1.4コピー/マイクロリットル(μL、1μLは100万分の1リットル)で、PCR検査法とほぼ同等であり、新型コロナウイルス感染症(COVID-19)の臨床検体を用いた検証実験では、陽性判定および変異株判定において感度・特異度は共に95%以上を達成しており、従来技術と検出原理の異なる革新的な検査装置でした。
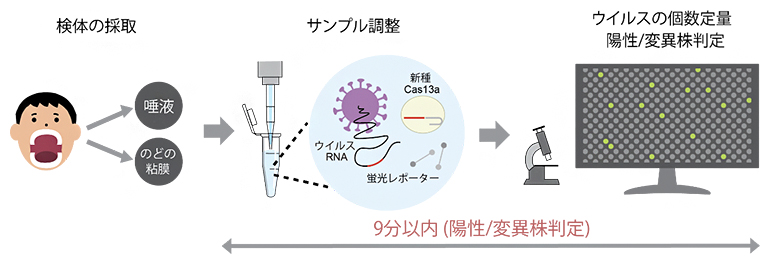
図1 独自のウイルス感染症の世界最速遺伝子検査法(SATORI法)
感染症の非増幅遺伝子検査の模式図。サンプル調製、蛍光観察、ウイルスの個数定量、陽性/変異株判定の全ての工程を9分程度で完結できる。
しかし、開発した装置は最小サイズで横幅35cm、奥行45cm、重さ20kgのため、臨床現場へ持ち運び、即時検査へ対応することが困難な状況でした。そのため、装置のさらなる小型化・軽量化により、ポータブルなSATORI法による検査装置の開発が期待されていました。
注1)2021年4月19日プレスリリース「新型コロナウイルスの超高感度・世界最速検出技術を開発」
注2)2022年5月26日プレスリリース「新型コロナウイルスの超高感度・全自動迅速検出装置の開発」
注3)2022年10月27日プレスリリース「新型コロナウイルス世界最速検出装置の小型化・低コスト化」
研究手法と成果
共同研究グループは、SATORI法の小型装置「Compact Wide-field Femtoliter-chamber Imaging System for High-speed digital bioanalysis:COWFISH」をさらに小型化・軽量化したポータブル装置「COWFISH2」を開発しました(図2)。COWFISH2は、COWFISHの蛍光検出/電子制御パーツなどを一から再設計することで、COWFISHと比較して、大幅な小型化・軽量化に成功しました。また、電動ステージを実装することで、複数の感染症を対象とした多項目遺伝子検査が可能になりました。詳しい改善点は以下の通りです。
1)大幅な小型化・軽量化を実現(設置面積比:COWFISHの約5分の1以下、重量比:COWFISHの約6分の1以下)
(横幅14cm、奥行22cm、高さ14cm、重さ4kg)
2)装置の低コスト化を実現(COWFISHの約3分の2以下)
(構成部品の総額は80万円程度)
3)電動ステージを実装
(最大4項目の遺伝子検査を実施可能、実施例:COVID-19、インフルエンザA型/B型などの急性呼吸器感染症の同時迅速検査)
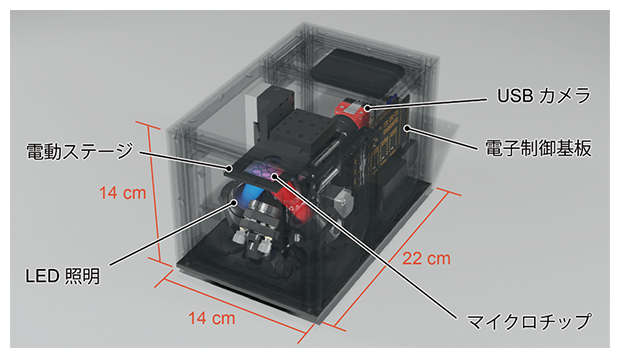
図2 COWFISH2の仕様
横幅14cm、奥行22cm、高さ14cm、重さ4kg。新たに電動ステージを実装した。
従来装置と同様に、COWFISH2はウイルスの遺伝子を1個ずつ識別し、検体中の個数を定量できます。さらに、電動ステージを実装したことで、急性呼吸器感染症を例として、多項目遺伝子検査を実施することが可能となりました。また、臨床現場即時検査として、COWFISH2を東京都健康長寿医療センターへ持ち込み(図3A)、COVID-19、インフルエンザA型などの臨床検体を用いた検証実験を行ったところ、陽性判定において感度94%、特異度98%を達成しました。(図3B、C)。
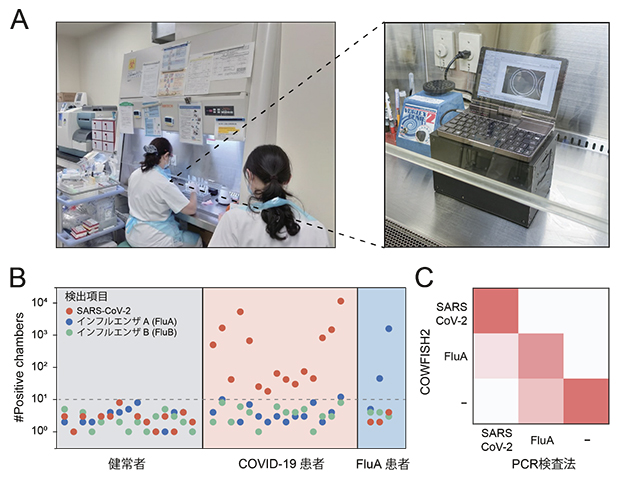
図3 COWFISH2による急性呼吸器感染症の多項目遺伝子検査
(A)東京都健康長寿医療センターに設置したCOWFISH2の写真。安全キャビネット内に設置可能。
(B)臨床検体(COVID-19、インフルエンザA型(FluA))を用いたときの光っている微小試験管の数。
(C)臨床検体を用いた陽性判定(感度94%、特異度98%)。
今後の期待
COWFISH2は、ウイルスの遺伝子を1分子レベルで識別して世界最高速度で定量し、さらには、陽性判定へとつなげることができるポータブルな遺伝子検査装置です。また、実証実験として東京都内の病院に設置し、急性呼吸器感染症を例として、安価で素早く多種のウイルス感染症を正確に診断できることが証明されました。今後は、検出できる遺伝子のレパートリーを増やすことで、感染症から基礎疾患に至るあらゆる疾患を対象とした、次世代の遺伝子検査装置としての実用化が期待され、国内外の研究機関・民間企業との共同研究を推進しています(図4)。
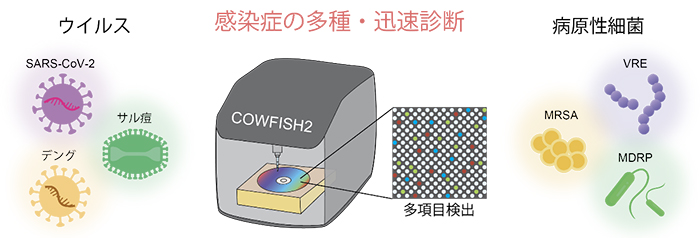
図4 感染症診断におけるCOWFISH2の将来展望
補足説明
1.感度
検査の性能を表す指標の一つ。陽性のものを正しく陽性と判定した割合。
2.特異度
検査の性能を表す指標の一つ。陰性のものを正しく陰性と判定した割合。
3.PCR検査法
ポリメラーゼ連鎖反応法(PCR法)によってウイルスに特徴的な塩基配列を増幅してウイルスの有無を検出する方法。最初に、増幅対象のDNA、DNA合成酵素(DNAポリメラーゼ)、大量のプライマーと呼ばれるオリゴヌクレオチドを混合して、反応液を作る。反応液を加熱すると、2本鎖DNAが変性して1本鎖DNAになる。次に急速冷却すると、結合(アニーリング)したプライマーの3端を起点としてDNAポリメラーゼが働き、1本鎖部分と相補的な2本鎖DNAが合成される。これで2倍量のDNAができ、再び高温にしてDNA変性から繰り返す。このように、PCR法は、DNA鎖長の違いによる変性とアニーリングの違いを利用して、温度の上下を繰り返すだけでDNA合成を繰り返し、DNAを2倍、4倍、8倍、16倍……と増幅する。SARS-CoV-2のようなRNAウイルスを検出する場合は、ウイルスRNAの塩基配列をDNAに写し取ってからPCR法で増幅する。PCRはpolymerase chain reactionの略。
4.CRISPR-Cas13a
多くの細菌は、「CRISPR-Casシステム」と呼ばれる獲得免疫システムを備えている。VI型CRISPR-Casシステムに関与するCRISPR-Cas13aは、ガイドRNAと複合体を形成し、ガイドRNAと相補的な1本鎖RNAと結合すると活性化し、1本鎖RNAを切断するRNA依存性RNA切断酵素である。
共同研究グループ
理化学研究所 開拓研究本部 渡邉分子生理学研究室
主任研究員 渡邉 力也(ワタナベ・リキヤ)
研究員 安藤 潤(アンドウ・ジュン)
研究員 篠田 肇(シノダ・ハジメ)
テクニカルスタッフⅠ 飯田 龍也(イイダ・タツヤ)
テクニカルスタッフⅠ 牧野 麻美(マキノ・アサミ)
テクニカルスタッフⅠ 吉村 麻実(ヨシムラ・マミ)
コーディネーター 向後 泰司(コウゴ・ヤスシ)
京都大学 医生物学研究所
教授 野田 岳志(ノダ・タケシ)
助教 中野 雅博(ナカノ・マサヒロ)
東京都健康長寿医療センター
研究副部長 豊田 雅士(トヨダ・マサシ)
研究支援
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業CREST「細胞外微粒子に起因する生命現象の解明とその制御に向けた基盤技術の創出(研究総括:馬場嘉信、JPMJCR19H5)」、三菱財団自然科学研究特別助成「新型コロナウイルス等感染症に関する学術研究助成」、日本学術振興会(JSPS)科学研究費助成事業学術変革領域研究(A)「未開拓タンパク質の1分子計測技術・デバイス開発(研究代表者:渡邉力也、20H05931)」、同基盤研究(A)「デジタル検出技術を基盤としたウイルスの新規感染診断法の開発(研究代表者:渡邉力也、21H04645)」、日本医療研究開発機構(AMED)新興・再興感染症に対する革新的医薬品等開発推進研究事業(研究代表者:渡邉力也、JP22fk0108542)、官民による若手研究者発掘支援事業(研究代表者:渡邉力也、JP22he0422018)をはじめとする諸機関からの支援によって行われました。
原論文情報
Tatsuya Iida, Jun Ando, Mami Yoshimura, Asami Makino, Masahiro Nakano, Yasushi Kogo, Hajime Shinoda, Masashi Toyoda, Takeshi Noda and Rikiya Watanabe, “Portable wide-field femtoliter-chamber imaging system for point-of-care digital bioanalysis”, iScience,DOI 10.1016/j.isci.2024.110868
発表者
理化学研究所
開拓研究本部 渡邉分子生理学研究室
主任研究員 渡邉 力也(ワタナベ・リキヤ)
テクニカルスタッフⅠ 飯田 龍也(イイダ・タツヤ)
京都大学 医生物学研究所
教授 野田 岳志(ノダ・タケシ)
東京都健康長寿医療センター
研究副部長 豊田 雅士(トヨダ・マサシ)
報道担当
理化学研究所 広報室 報道担当
京都大学 渉外・産官学連携部広報課国際広報室
東京都健康長寿医療センター 総務課総務係広報担当