2024-10-07 京都大学iPS細胞研究所
ポイント
- ウルリッヒ型先天性筋ジストロフィー注1)に間葉系間質細胞(MSCs)注2)の移植が治療効果を発揮すると期待されている
- 脂肪や骨髄から作られたMSCsとiPS細胞由来のMSCsとの細胞治療効果を比較した
- iPS細胞由来のMSCsが他のMSCsと比較して安全かつ効果的だった
1. 要旨
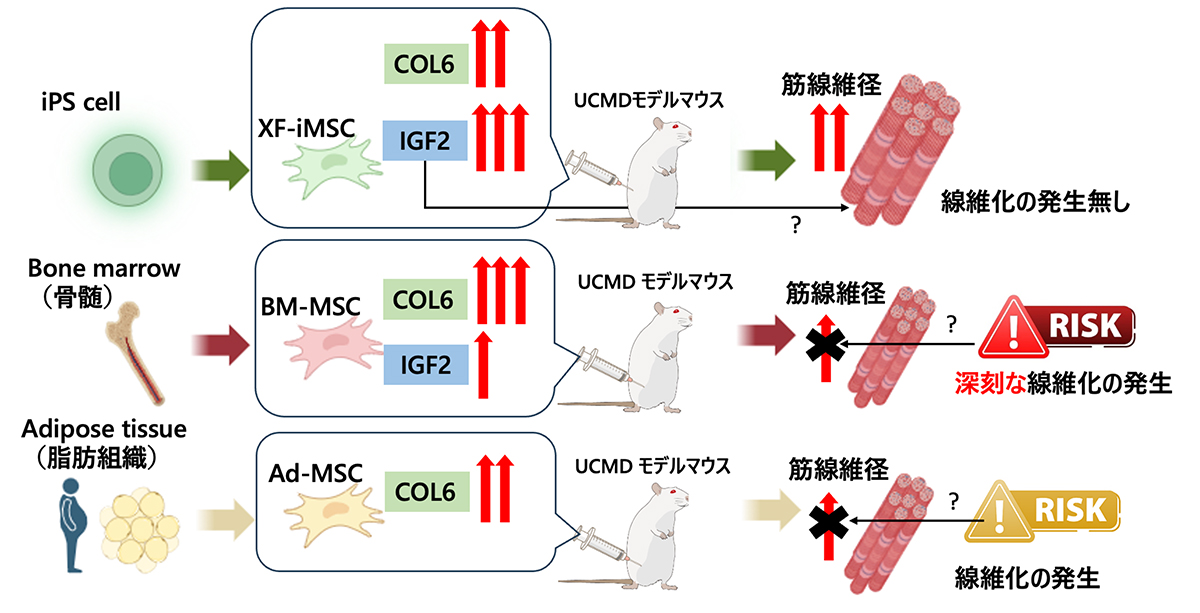
櫻井英俊 准教授、竹中(蜷川)菜々 研究員、後藤萌 研究員(CiRA臨床応用研究部門)らの研究グループは、筋ジストロフィーモデルマウスに対して、脂肪・骨髄・iPS細胞由来の間葉系間質細胞(MSCs)の細胞治療効果を比較し、池谷真 准教授(CiRA臨床応用研究部門)らが作製したiPS細胞由来の間葉系間質細胞(XF-iMSCs)がもっとも安全かつ効果的な候補となりうることを明らかにしました。
ウルリッヒ型先天性筋ジストロフィー(UCMD)は、遺伝子変異により6型コラーゲン(COL6)が欠乏し、細胞外マトリックス注3)の構造と特性が変化し、ミトコンドリアの欠陥や筋再生の障害を引き起こします。したがって、COL6を分泌するMSCsは、細胞治療の素材として注目されています。さまざまな組織由来のMSCsがすでに臨床応用され、種々の疾患において治療効果を発揮しますが、UCMDモデルマウスにおいて異なる由来のMSCsによる治療効果の違いを比較検討した報告はありません。
研究グループは、どのMSCsがUCMDに対して最高の治療効果を持つかを評価するために、UCMDモデルマウスへMSCsを移植するin vivo実験および骨格筋幹細胞とMSCsを共培養するin vitro実験を行いました。MSCsには、脂肪組織由来のMSCs(Ad-MSCs)、骨髄由来のMSCs(BM-MSCs)、およびiPS細胞由来のMSCs(XF-iMSCs)を用いました。
UCMDモデルマウスに対する移植実験では、XF-iMSCsを移植したグループが他のグループと比較して移植後1週間で筋線維再生が著しく向上しました。移植後12週間で、XF-iMSCs移植グループのみが他のグループと比較して有意に大きな筋線維直径を示し、他の移植グループで観察された線維化は見られませんでした。同様に、共培養実験では、XF-iMSCsが他のMSCsよりも効果的にUCMDモデルマウス由来の骨格筋幹細胞の融合と分化を促進することが分かりました。さらに、in vitroノックダウンおよび補完実験は、XF-iMSCsが分泌するIGF2が骨格筋幹細胞の分化を促進することを示唆しました。
XF-iMSCsは筋再生を促進し、線維化を回避する有望な候補となり、他の潜在的な治療法よりも安全で効果的な治療アプローチを提供します。
この研究成果は10月7日に「Stem Cell Research & Therapy」で公開されました。
2. 研究の背景
UCMDは、幼少期に発症する進行性の病気で、筋肉の弱さ、関節の過伸展性、および進行性の関節拘縮が特徴です。この病気はCOL6の遺伝子COL6A1、COL6A2、またはCOL6A3の変異が原因で、筋肉の細胞外マトリックスにおけるCOL6の欠乏または機能不全を引き起こします。現在、UCMDの有効な治療法は確立されていません。
MSCsは筋肉の恒常性を維持し、病的な骨格筋組織においては脂肪細胞や線維芽細胞に分化することが示されています。特に、Col6a1欠損マウスは異常なMSCを持ち、線維化が進行します。そのためMSCはUCMDの治療標的として期待されています。
これまでの研究で、iPS細胞から誘導されたMSC(iMSCs)がCOL6を発現し、Col6a1欠損マウスに投与することで筋肉の再生を促進することを確認しました(CiRAニュース2021年8月24日、2021年11月29日)。また、動物由来成分を含まない条件下(Xeno-Free)でのiMSCsの誘導を確立し、細胞治療への応用が進められています(CiRAニュース 2022年9月15日)。この研究では、HLA編集されたiPS細胞から誘導されたxeno-free MSC(XF-iMSC)を使用しました。
他のグループの研究から、Ad-MSCの移植が6型コラーゲン欠損マウスにおいてCOL6を補充することを報告しており、Ad-MSCはその他の疾患においてすでに多くの臨床応用が進んでいます。Ad-MSC以外にも、さまざまな組織から分離されたMSCも他の病気に対する治療法として臨床で利用されていますが、iMSCと既存のMSC(Ad-MSCやBM-MSC)の違いを比較した研究はありません。この研究では、他の病気で臨床応用されているMSC(Ad-MSCおよびBM-MSC)とXF-iMSCを比較し、UCMDの治療において最も効果的で安全なMSCを特定することを目指しました。
3. 研究結果
1. BM-MSCが最も多くコラーゲン6を補充した
UCMDモデルマウスの前脛骨筋に、3種類のMSC(Ad-MSCs、BM-MSCs、XF-iMSCs)をそれぞれ移植しました。移植の1週間後、すべてのMSCで生着が認められ、COL6が補充されました。筋肉の総面積に対するCOL6陽性領域の割合は、BM-MSCを移植した群で、他の2種類の細胞を移植した群よりも有意に高くなりました(Fig. 1)。
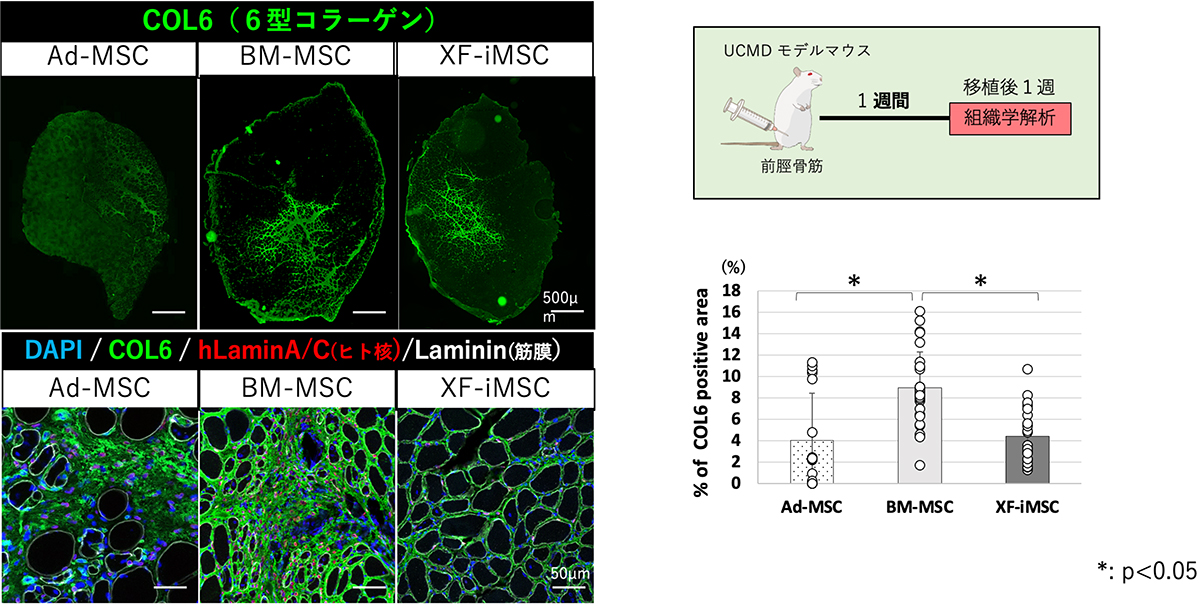
Fig. 1 移植1週間後の免疫蛍光染色像とCOL6陽性領域の割合
2. XF-iMSCが最も筋線維の再生を促した
移植から1週間後の筋線維の再生を比較しました。骨格筋再生時に一過性に発現するeMHCは、コントロール群では非常に小径の線維(Fig. 2、黃矢頭)に限られており、筋の成熟が不完全であることが示されました。XF-iMSCを移植した群では、過去の報告と同様に、多核再生筋線維数の増加(Fig. 2、白矢頭)と筋線維径の増大が認められました。一方、Ad-MSCs移植群およびBM-MSCs移植群では、白矢頭で示した多核筋線維は観察されたものの、多くの再生筋線維は単核のままでした(Fig. 2、黄矢頭)。
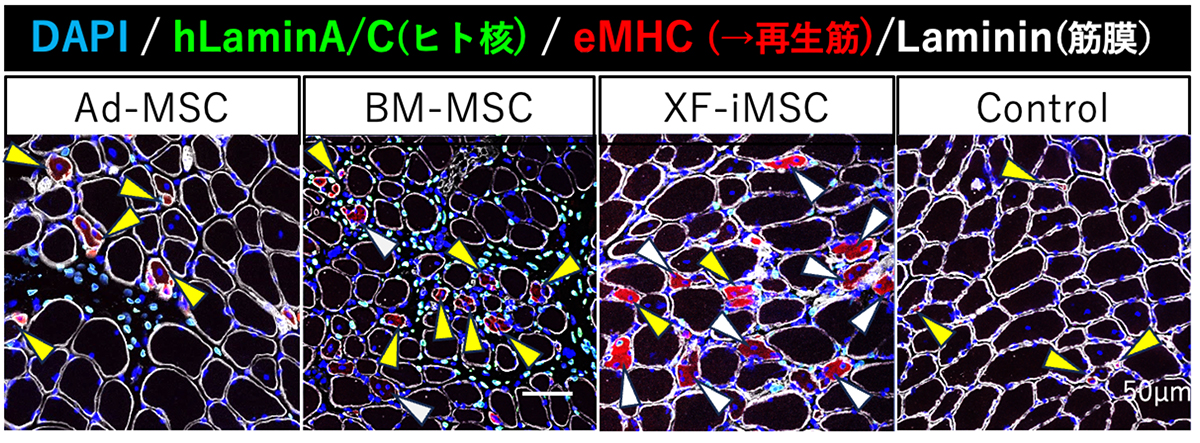
Fig. 2 移植された筋肉の組織標本に対する免疫蛍光染色像
3. BM-MSCは間質の拡大を伴う顕著な線維化を引き起こした
移植した細胞が筋肉の病的な線維化に悪影響を及ぼしたかどうかを確認するため、移植12週間後にシリウスレッド染色を行いました。BM-MSCs移植群では、間質の拡大を伴う顕著な異所性線維化が認められました(Fig. 3)。
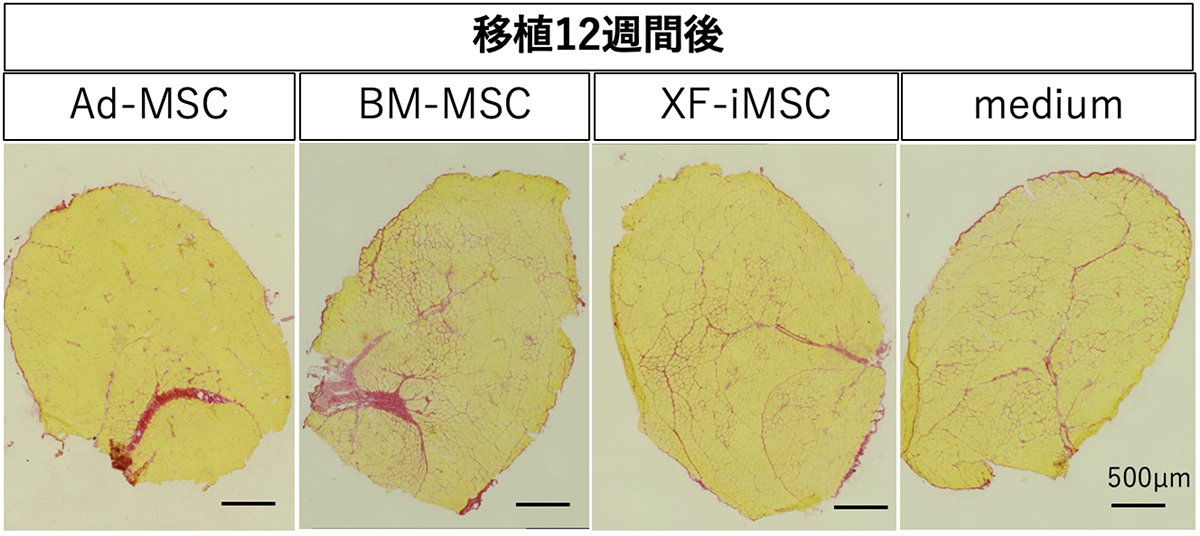
Fig. 3 移植された筋肉の組織標本に対するシリウスレッド染色像
4. XF-iMSCではIGF2を介して筋分化が促進される
UCMDモデルマウスから取り出した骨格筋幹細胞と各種MSCsを共培養し、筋分化を観察しました。その結果、XF-iMSCsが最もmyotubeの形成を促進することが分かりました。さらに、XF-iMSCsで高く発現しているIGF2がその形成を促す因子であることに着目しました。IGF2の発現をノックダウンしたXF-iMSCs(XF-iMSC-KD)を作成し、無処理のXF-iMSCと比較しました。その結果、IGF2をノックダウンしたXF-iMSCではミオシン重鎖陽性の面積が減少し、4つ以上の核を持つmyotubeの形成が抑制されました(Fig. 4)。
XF-iMSCではIGF2を介して筋分化が促進されていると考えられます。
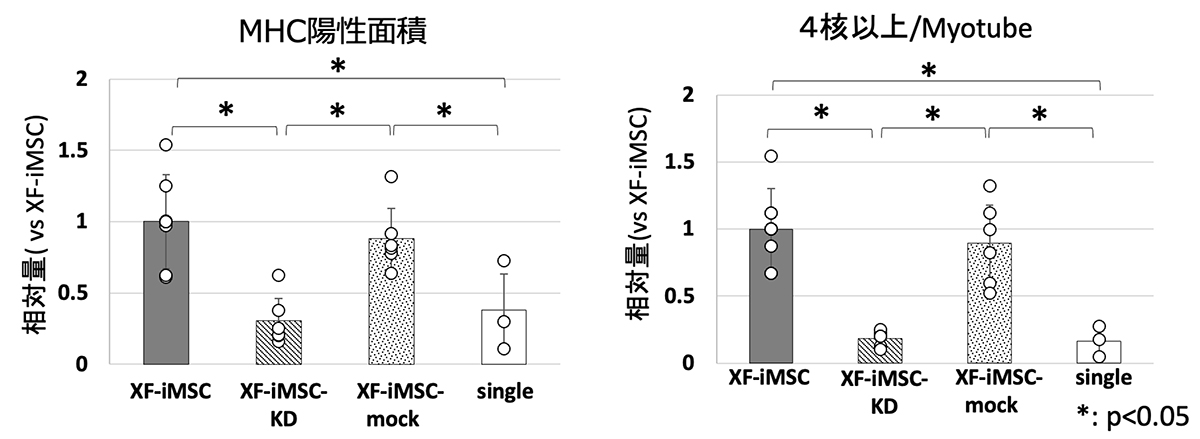
Fig. 4 MuSCsとXF-iMSCsを共培養6日後の筋分化の様子
4. まとめと展望
臨床応用されている従来の組織由来のMSCと比べて、XF-iMSCは筋線維の再生と成熟を有意に促進し、UCMDの病態改善に寄与することが示されました。BM-MSCが深刻な線維化を引き起こしたのに対し、XF-iMSCは移植後24週間でも線維化が認められず、安全性が確認されました。
さらに、XF-iMSCから分泌されるIGF2が骨格筋幹細胞の分化を促進する可能性が示唆されました。また、BM-MSCでは線維化マーカーの発現が多く、線維化が筋の再生を妨げるとの報告もあります。これにより、BM-MSCが治療効果を阻害する可能性が示唆されました。
以上のことから、XF-iMSCsは筋再生を促進し、線維化を回避する有望な細胞治療の候補であり、他の治療法に比べても安全で効果的なアプローチであると考えられます。
5. 論文名と著者
- 論文名
Distinct muscle regenerative capacity of human induced pluripotent stem cell-derived mesenchymal stromal cells in Ullrich congenital muscular dystrophy model mice - ジャーナル名
Stem Cell Research & Therapy - 著者
Megumi Goto1, Nana Takenaka-Ninagawa1,2*, Chengzhu Zhao1, Clémence Kiho Yoshioka Bourgeois1,3, Mayuho Miki1,3, Souta Motoike1, Yoshiko Inada1, Denise Zujur1,6, William Theoputra1, Yonghui Jin4, Junya Toguchida1,4, Makoto Ikeya1, Hidetoshi Sakurai1*
*責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 名古屋市立大学大学院医学研究科
- 京都大学医学研究科人間健康科学専攻
- 京都大学医生物学研究所
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 日本学術振興会 科学研究費補助金 若手研究(JP21K15418)
- 日本学術振興会科研費(JP23K057809)
- 日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム- 技術開発個別課題(#JP19bm0404044)- iPS 細胞研究中核拠点(#JP13bm0104001)
7. 用語説明
注1)ウルリッヒ型先天性筋ジストロフィー(UCMD: Ullrich congenital muscular dystrophy)
6型コラーゲンの遺伝子の変異が原因。生まれた直後から筋力が低く、筋萎縮の状態になる。肘・肩・膝 などの関節が正常な範囲で動かなくなったり、手足の関節が過剰に伸びた状態になる。
注2)間葉系間質細胞(MSC: Mesenchymal stromal cells)
骨・脂肪・軟骨などへと分化する能力をもつ幹細胞の一種。体内にもともと存在している。
注3)細胞外マトリックス
細胞間の隙間を埋める生体高分子(コラーゲンやプロテオグリカンなど)の集合体。骨・軟骨、歯、皮膚な どに多く含まれ、組織を支えてメカニカル(クッション・伸び縮みなど)な機能を果たしている。
