2024-10-21 理化学研究所
理化学研究所(理研)環境資源科学研究センター 植物免疫研究グループの白須 賢 グループディレクター(環境資源科学研究センター 副センター長)、後藤 幸久 特別研究員(研究当時)、門田 康弘 専任研究員らの国際共同研究グループは、病原細菌が植物の感染感知能力を無効化する機構を解明しました。
本研究成果により、病原性の高い細菌が植物免疫受容体による認識を巧みに回避して感染する仕組みが分子レベルで明らかになりました。
今回、国際共同研究グループは植物の細胞膜局在型の免疫受容体[1]と複合体を形成する因子を探索し、受容体様リン酸化酵素[2]QSK1を発見しました。このQSK1は免疫受容体の量を減少させる機能を持っていました。さらに興味深いことに、病原細菌Pseudomonas syringae pv. tomato (Pto) DC3000の病原性因子[3]HopF2PtoはQSK1と結合すると植物細胞内で安定化し、免疫受容体の量を劇的に減少させました。また、HopF2Ptoはさまざまな免疫受容体の発現とともに、免疫反応を増強する分子であるファイトサイトカイン[4]、およびファイトサイトカイン受容体の発現も抑制しました。このように、HopF2Ptoは植物免疫の機能を低下させる因子QSK1を用いて植物の感染感知能力を無効化していることが明らかになりました。
本研究は、科学雑誌『The Plant Cell』オンライン版(10月21日付:日本時間10月21日)に掲載され、同誌の特集記事「Hijacking QSK1: How pathogens turn a plant defense guardian into an accomplice」で重要論文として紹介されました。
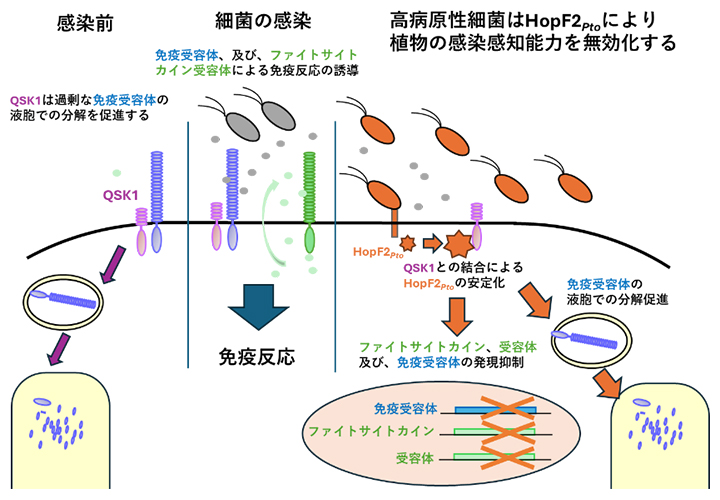
HopF2PtoはQSK1を用いて植物の感染感知能力を無効化
背景
植物は病原菌由来の物質を細胞膜局在型の免疫受容体によって認識し、病原菌の侵入を感知します。免疫受容体が過剰に反応すると、過剰な免疫反応や成長抑制を引き起こすため、厳密な制御が必要です。しかし、免疫受容体の制御機構には未解明な部分が多いのが現状です。一方、病原細菌は感染の過程で、病原性因子と呼ばれるタンパク質を植物細胞内に注入して、免疫受容体を介した防御応答を抑制します。高病原性の細菌であるPseudomonas syringae pv. tomato (Pto) DC3000の病原性因子HopF2Ptoは免疫受容体により誘導される防御応答を強く抑制する活性を持つことが知られていましたが、その分子機構は未解明でした。
研究手法と成果
免疫受容体の制御機構を解明するため、国際共同研究グループは免疫受容体複合体をモデル植物であるシロイヌナズナより精製し、新規構成因子を探索しました。その結果、受容体様リン酸化酵素QSK1を発見しました。QSK1の欠損変異体、および過剰発現体を作出して調べた結果、QSK1は植物の免疫受容体の機能を低下させる働きを持つことが明らかとなりました。そこで、病原細菌由来の鞭毛タンパク質を認識する免疫受容体FLS2や、細菌の翻訳制御因子を認識する免疫受容体EFRの量を調べたところ、QSK1はこれらの免疫受容体の量を減少させる機能を持っていました(図1)。QSK1による免疫受容体の減少は、液胞によるタンパク質分解の阻害剤であるConcanamycinAにより抑制されることから、QSK1は免疫受容体の液胞での分解を促進していると考えられます。
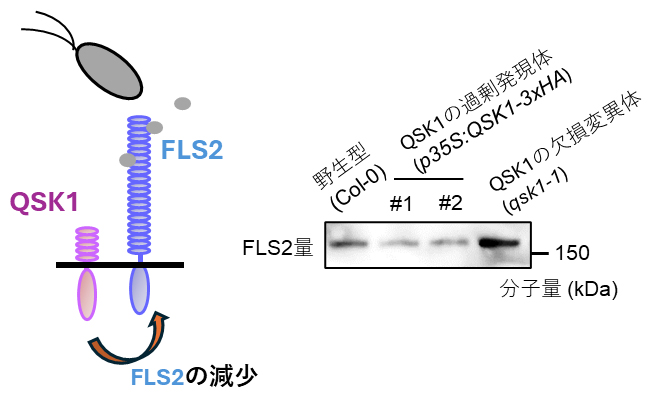
図1 QSK1による免疫受容体FLS2量の制御
QSK1の過剰発現体(p35S:QSK1-3xHA)(#1、#2)ではFLS2の量が減少し、QSK1の欠損変異体(qsk1-1)ではFLS2の量が増大した(黒色部分が大きいほど量が多い)。Col-0は野生型、kDa(キロダルトン)は分子量の単位。
病原性因子HopF2Ptoをシロイヌナズナに発現させるとQSK1の過剰発現体と同様に、免疫反応が完全に抑制されます。HopF2Ptoと相互作用する因子を探索したところ、興味深いことにQSK1が単離されました。さらに、QSK1と同様にHopF2Ptoは免疫受容体の量を減少させました(図2)。HopF2Ptoによる免疫受容体の減少もConcanamycinAにより抑制されることから、HopF2PtoはQSK1と同様に免疫受容体の液胞での分解を促進していると考えられます。
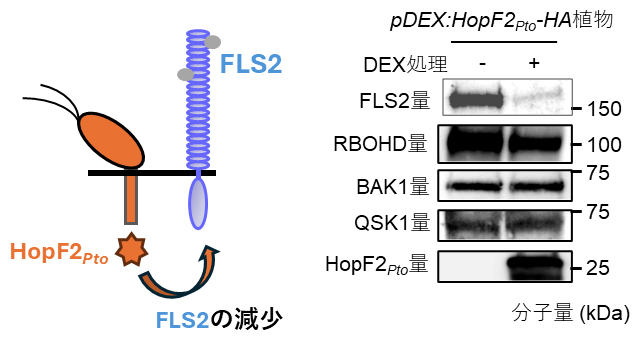
図2 HopF2Ptoの発現によるFLS2量の変化
HopF2PtoをDEX(dexamethasone)誘導性プロモーターによりDEX存在下で発現させると、FLS2の量が劇的に減少した。しかし、QSK1、RBOHD、およびBAK1などの制御因子の量は変化しなかった。
そこで、HopF2Ptoの病原性機構におけるQSK1の役割を調べたところ、HopF2PtoはQSK1と結合することにより安定化してタンパク質の量が増大し(図3左)、これによりHopF2Ptoは免疫受容体を減少させることが分かりました。病原細菌Pto DC3000 ΔhopF2 HopF2Pto-HAをQSK1の欠損変異体に感染させると、野生型に感染させたときに比べ、作られるHopF2Ptoの量が減少し、FLS2量が増大しました(図3中)。これにより、Pto DC3000に対する抵抗性が増大し、野生型に比べて細菌数が減少しました(図3右)。逆に、QSK1の過剰発現体に感染させると細菌数が野生型に比べて増大しました(図3右)。
さらに、網羅的な遺伝子発現解析を行った結果、HopF2Ptoはさまざまな免疫受容体の転写量を減少させるだけでなく、免疫反応を増強する分子であるファイトサイトカイン、およびファイトサイトカイン受容体の転写量を劇的に減少させました。以上のことから、HopF2Ptoは植物免疫の負の制御因子QSK1を用いて植物の免疫受容体、ファイトサイトカイン、およびファイトサイトカイン受容体を減少させることで、植物の感染感知能力を無効化していることが明らかになりました。
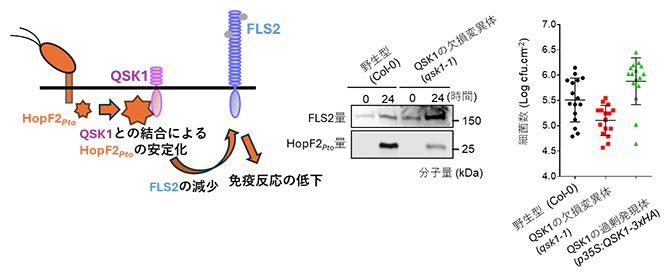
図3 QSK1とHopF2Ptoの蓄積、HopF2PtoによるFLS2量の減少の関係
病原細菌(Pto DC3000ΔhopF2 HopF2Pto-HA)をシロイヌナズナに感染させると、QSK1の欠損変異体(qsk1-1)では野生型(Col-0)に比べて感染24時間後のHopF2Ptoの蓄積量は減少し、FLS2の蓄積量は増大した。その結果、QSK1の欠損変異体では病原細菌に対する抵抗性が増大し、野生型に比べて細菌数が減少した。逆にQSK1の過剰発現体では細菌数が野生型に比べて増大した。このことは、HopF2Ptoの蓄積と病原性の機能にはQSK1が必要であることを示す。
今後の期待
本研究により、QSK1による植物の免疫受容体の制御機構が明らかになりました。さらに、病原細菌の病原性因子HopF2PtoがQSK1を用いて植物の感染感知能力を無効化する仕組みも解明されました。QSK1欠損変異体では免疫受容体の蓄積が誘導されるとともに、HopF2Ptoの働きが弱まるため、病原細菌抵抗性が向上しました。シロイヌナズナにはQSK1のホモログ(相同遺伝子)が三つ存在しており、多重欠損変異体を作出することにより、さらなる抵抗性の強化が期待されます。
本研究成果は、国際連合が定めた17の目標「持続可能な開発目標(SDGs)[5]」のうち、「2.飢餓をゼロに」「15.陸の豊かさも守ろう」に貢献するものです。
補足説明
1.免疫受容体
植物の免疫受容体には細胞膜局在型と細胞内局在型が存在する。細胞膜局在型の免疫受容体は、病原菌由来の物質を認識して免疫反応を誘導する。代表例として、病原細菌由来の鞭毛タンパク質を認識するFLS2や、細菌の翻訳制御因子を認識するEFRがある。細胞内局在型の免疫受容体は、病原菌が感染過程で細胞質に注入するエフェクタータンパク質を認識し、細胞死を伴った強い免疫反応を誘導する。
2.受容体様リン酸化酵素
受容体様リン酸化酵素は、細胞膜に存在し、外部からのシグナルを細胞外領域で認識し、細胞質領域のリン酸化酵素領域を介して細胞内へ情報を伝える。受容体様リン酸化酵素には、植物ホルモンや、病原菌由来物質を認識する受容体として機能するものがあるが、受容体の機能を補助したり、受容体の機能を正、または負に制御したりする働きを持つものもある。
3.病原性因子
病原微生物が感染過程において宿主細胞に注入するタンパク質や小分子で、宿主の防御機構を回避し、感染を成功させるために働く。病原性因子宿主の免疫応答を抑制したり、細胞の機能を改変したりすることで、病原体が繁殖しやすい環境を作り出す。
4.ファイトサイトカイン
ファイトサイトカインは免疫反応を増強する植物由来のペプチドである。通常、ファイトサイトカインは細胞内に存在するが、病原体の感染時に細胞外に放出され、細胞膜上のファイトサイトカイン受容体により認識される。ファイトサイトカイン受容体はこれにより免疫反応を誘導する。代表例としてSCOOPペプチドがある。前駆体タンパクであるPROSCOOPは病原体感染時に細胞外に放出され、細胞外でSCOOPペプチドが切り出される。その後SCOOPペプチドは受容体様リン酸化酵素であるMIK2により認識され、これにより免疫反応が誘導される。
5.持続可能な開発目標(SDGs)
2015年9月の国連サミットで採択された「持続可能な開発のための2030アジェンダ」にて記載された2016年から2030年までの国際目標。持続可能な世界を実現するための17のゴール、169のターゲットから構成され、発展途上国のみならず、先進国自身が取り組むユニバーサル(普遍的)なものであり、日本としても積極的に取り組んでいる(外務省ホームページから一部改変して転載)。
国際共同研究グループ
理化学研究所 環境資源科学研究センター
植物免疫研究グループ
グループディレクター 白須 賢(シラス・ケン)
(環境資源科学研究センター 副センター長)
特別研究員(研究当時)後藤 幸久(ゴトウ・ユキヒサ)
(現 チューリッヒ大学、Institute of Plant and Microbial Biology、日本学術振興会 海外学振特別研究員研究員)
専任研究員 門田 康弘(カドタ・ヤスヒロ)
基礎科学特別研究員 ブルーノ・ポクマン・ゴウ(Bruno Pok Man Ngou)
研究員(研究当時)市橋 泰範(イチハシ・ヤスノリ)
(現 バイオリソース研究センター 植物-微生物共生研究開発チーム チームリーダー)
テクニカルスタッフⅡ 槇 紀子(マキ・ノリコ)
テクニカルスタッフⅡ 柴田 ありさ(シバタ・アリサ)
植物プロテオミクス研究ユニット(研究当時)
ユニットリーダー(研究当時)中神 弘史(ナカガミ・ヒロフミ)
研究員(研究当時)松井 英譲(マツイ・ヒデノリ)
チューリッヒ大学(スイス)
Institute of Plant and Microbial Biology
教授 シリル・ジップフェル(Cyril Zipfel)
トロント大学(カナダ)
Department of Cell and System Biology and Centre for the Analysis of Genome
Function and Evolution
教授 ダレル・デヴォー(Darrell Desveaux)
教授 デービッド・グットマン(David S. Guttman)
研究員(研究当時)ジェニファー・ルイス(Jennifer D. Lewis)
センズベリー研究所(英国)
チームリーダー フランク・メンケ(Frank L.H. Menke)
チームリーダー(研究当時)シルケ・ロバツェック(Silke Robatzek)
研究員(研究当時)マリック・ムベンゲ(Malick Mbengue)
研究員 ヤン・スクレナー(Jan Sklenar)
研究員 ポール・ダービーシャー(Paul Derbyshire)
中部大学 応用生物学部
教授 鈴木 孝征(スズキ・タカマサ)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成制度学術変革領域研究(A)「不均一環境変動に対する植物のレジリエンスを支える多層的情報統御の分子機構(研究領域代表者:松下智直)」の計画研究「不均一土壌環境に応答した寄生植物の感染統御機構(研究代表者:吉田聡子)、同基盤研究(A)「アポプラストにおける植物-病原体相互作用(研究代表者:白須賢)」、同基盤研究(S)「植物と病原体の攻防における分子機構(研究代表者:白須賢)」、同特別研究員奨励費「植物レドックスシグナルの鍵となる活性酸素生成酵素の制御機構解明(研究代表者:後藤幸久)」「害虫抵抗性を付与する植物免疫受容体の同定(研究代表者:白須賢)」、同若手研究(A)「植物の感染防御応答に重要な活性酸素生成機構とシグナリングの解明(研究代表者:門田康弘)」、同基盤研究(B)「統合ゲノミクスによる抗線虫活性を示す微生物群集のプロファイリングと農地での再構築(研究代表者:門田康弘)」「植物による線虫認識機構の解明(研究代表者:門田康弘)」「植物の膜貫通型受容体(様)キナーゼを介した植物寄生線虫の認識機構の解明(研究代表者:門田康弘)」、同挑戦的研究(萌芽)「アグロバクテリウムのステルス化による植物の形質転換効率の向上(研究代表者:門田康弘)」、日本学術振興会海外特別研究員(JSPS海外学振)「プロテオミクスを駆使した新規ナス科植物免疫受容体の同定(後藤幸久)」による助成を受けて行われました。
原論文情報
Yukihisa Goto, Yasuhiro Kadota, Malick Mbengue, Jennifer D Lewis, Hidenori Matsui, Noriko Maki, Bruno Pok Man Ngou, Jan Sklenar, Paul Derbyshire, Arisa Shibata, Yasunori Ichihashi, David S. Guttman, Hirofumi Nakagami, Takamasa Suzuki, Frank L.H. Menke, Silke Robatzek, Darrell Desveaux, Cyril Zipfel, Ken Shirasu, “Leucine-rich Repeat Receptor Kinase QSK1 Regulates PRR-RBOHD Complex Targeted by Bacterial effector HopF2Pto“, The Plant Cell, 10.1093/plcell/koae267
発表者
理化学研究所
環境資源科学研究センター 植物免疫研究グループ
グループディレクター 白須 賢(シラス・ケン)
(環境資源科学研究センター 副センター長)
特別研究員(研究当時)後藤 幸久(ゴトウ・ユキヒサ)
専任研究員 門田 康弘(カドタ・ヤスヒロ)
報道担当
理化学研究所 広報室 報道担当