2024-11-27 理化学研究所
理化学研究所(理研)生命機能科学研究センター ヒト器官形成研究チームの佐原 義基 客員研究員、髙里 実 チームリーダーらの研究チームは、大塚製薬株式会社との共同研究下で、ヒトiPS細胞[1]から作製した3次元腎臓組織(腎臓オルガノイド[2])に含まれる近位尿細管[3]の成熟化速度を促進する方法を発見しました。
本研究成果は、開発中の薬が腎臓に副作用を及ぼす可能性を調べる腎毒性試験への応用や腎臓病の病態モデルの樹立など、腎臓病の治療法開発と病態解明の研究に向けた腎臓オルガノイドの高機能化に貢献すると期待されます。
近年、多能性幹細胞などにさまざまな刺激を加えて培養し、本物の臓器に似たミニ臓器(オルガノイド)を生み出す研究が世界中で進められています。
今回、研究チームは、より成体に近い腎機能の再現を目指し、腎臓オルガノイドの成熟化を加速させる培養法を探索しました。腎臓オルガノイドに存在する成熟度の速い細胞と遅い細胞に着目し、両者を1細胞レベルで比較したところ、成熟度の早い近位尿細管細胞では、核内受容体PPARα[4]に制御される遺伝子の発現上昇が見られました。そこで、PPARα経路を活性化させる薬剤を培養液に加えたところ、成熟した近位尿細管細胞で活性化する遺伝子の発現が上昇し、尿中のタンパク質などを血中に戻す再吸収機能が上昇していました。この近位尿細管では、活発なエンドサイトーシス[5]により小分子を多く取り込めるようになり、腎毒性物質に対する感受性も高くなっていることが分かりました。
本研究は、科学雑誌『Communications Biology』オンライン版(11月27日付:日本時間11月27日)に掲載されました。
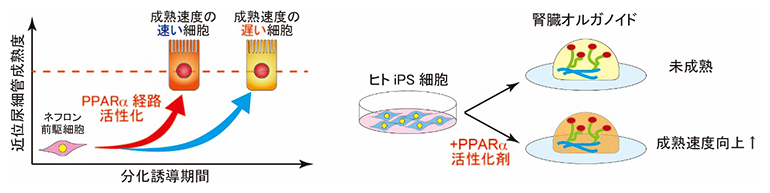
PPARα経路の活性化で促進される腎臓オルガノイドの成熟化
背景
腎臓は、一度機能が落ちると再生することがない臓器として知られています。そのため、末期腎不全に陥ると、生命を維持するためには腎臓移植か人工透析を行うしかありません。髙里チームリーダーらの研究チームはこれまでに、ヒトiPS細胞から腎臓オルガノイドと呼ばれる、3次元のミニ腎臓組織を開発してきました注1)。この技術は、実験動物を使わない新薬開発や、ヒト細胞を用いた腎臓病モデル組織、そして移植可能な人工腎臓の作製など、幅広い応用が期待されています。
しかし、本物の腎臓と比較して、腎臓オルガノイドは成熟性が劣り、その成熟度は胎児レベルであると判明しています。腎臓オルガノイドの未成熟性は、将来の移植応用への利用を見据えると、解決すべき重要課題の一つです。
今回、研究チームは、人為的に腎臓オルガノイドの成熟化速度を速めるため、腎臓オルガノイドの成熟化速度を制御している因子を探すことにしました。これまでに研究チームは、1細胞単位で腎臓オルガノイドの遺伝子発現を調べる過程で、成熟化速度の速い細胞と遅い細胞が混在していることに気付いていました。そこで、この両者の遺伝子発現を比較することで、成熟化速度の違いがどんな因子によって制御されている可能性があるのかを調べることにしました。
注1)Takasato, M. et al. Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis. Nature 526, 564–568 (2015).
研究手法と成果
研究チームははじめに、ヒトiPS細胞から腎臓オルガノイドを培養し、ネフロン[6]が成熟する過程の約2週間にわたって経時的にサンプリングを行いました。これらのサンプルに含まれる細胞一つ一つについて、どのような遺伝子が発現しているかを1細胞RNA sequence法[7]により網羅的に調べました。統計的な手法で遺伝子発現解析を行った結果、今回取得したサンプルは腎臓発生のネフロン前駆細胞[6]のステージの細胞から、腎臓を構成する糸球体、近位尿細管、遠位尿細管などの分化した細胞を含んでいること、また日を追うごとに、細胞が分化していく様子をいずれも確認できました(図1)。さらに、一部腎臓以外の細胞にも分化していることが分かりました。
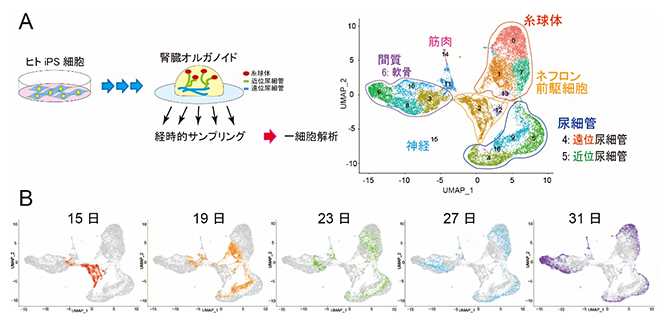
図1 腎臓オルガノイドを用いた1細胞解析
A.腎臓オルガノイドを用いた1細胞解析の方法とクラスタリング解析。ヒトiPS細胞から作製した腎臓オルガノイドを経時的にサンプリングし、1細胞RNA sequence法により網羅的に遺伝子発現解析を行った。細胞一つ一つについて、どのような遺伝子発現の特徴を持っているかをインフォマティクスの手法(UMAPと呼ばれる統計学的手法)で解析し、2次元グラフ上の点で示したところ、似た特徴を持つ細胞同士はグラフ上で近い位置に集まって複数のクラスターを形成した。これらのクラスターが何の細胞であるかを既知の遺伝子マーカーにより分類した結果、腎臓オルガノイド内には腎臓の前駆細胞、ネフロン構成細胞(糸球体、近位尿細管、遠位尿細管)以外にも、軟骨や筋肉なども一部含まれることが分かった。
B.分化誘導後15日から31日まで4日ごとに回収したサンプルのクラスタリング解析。分化誘導後15日目の細胞(赤)は、ほとんどがネフロン前駆細胞のクラスター(図A参照)に位置していたが、培養日数を経るとさまざまな細胞に分化し、広がっていく様子が確認できた。
次に、この腎臓オルガノイドにおいて細胞が分化していく様子を成熟度の順番に並べるために、各サンプルに含まれるネフロン前駆細胞から成熟した腎臓細胞までのクラスターの細胞を用いて、疑似時間軸細胞経路解析[8]を行いました。これにより、ネフロン前駆細胞から、腎臓を構成する細胞が経時的に分化していく様子を3次元グラフ上に並べることができました(図2A)。今回、研究チームは、腎臓において水分や電解質、ブドウ糖、タンパク質の再吸収を担う近位尿細管の細胞に着目し、近位尿細管細胞集団のみを抽出して、同様な疑似時間軸細胞経路解析を行いました。すると、近位尿細管細胞を枝分かれのない1本の時間軸上に並べることができ、すでに分化している近位尿細管細胞においても細胞間で成熟度に差が存在することが示されました(図2B)。
この成熟度を基に、腎臓オルガノイド内で成熟化速度が速い細胞群と、成熟化速度の遅い細胞群を定義し、それらの細胞群間の発現変動遺伝子のうち、成熟化速度が速い細胞群で発現が高い遺伝子を抽出しました。これらの遺伝子発現を制御する可能性のある因子について、オミックスデータを基にネットワーク/パスウェイ解析をするソフトウエアで上流調節因子を探索したところ、近位尿細管細胞の成熟化速度の向上に核内受容体の一種であるPPARα経路の活性化が関与することが示唆されました(図2C)。
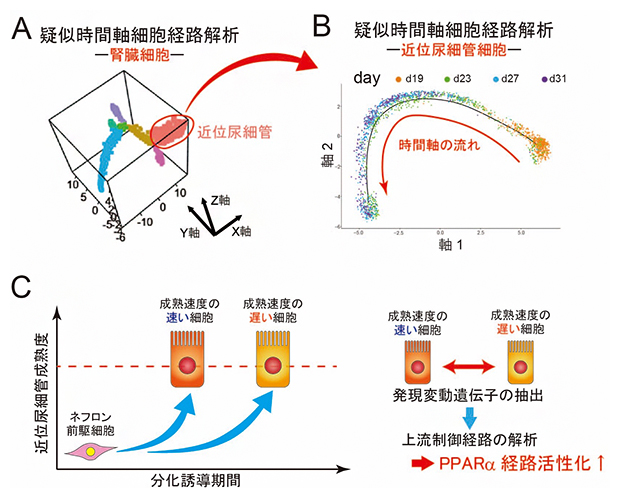
図2 近位尿細管細胞の疑似時間軸細胞経路解析と成熟化速度を制御する因子の抽出方法
A.腎臓細胞のクラスターのみを抽出して、疑似時間軸細胞経路解析を行った際の3次元プロット。前駆細胞(紫)から糸球体細胞(青)と尿細管細胞(黄)に分かれた後、尿細管細胞が、近位尿細管細胞(桃)と遠位尿細管細胞(マゼンタ)に分化する過程を3次元プロットにより確認した。
B.近位尿細管細胞の疑似時間軸細胞経路解析。擬似時間軸に沿って、近位尿細管細胞を示すプロットが右から左下に向かって配置されている。分化誘導後の日数ごと(19>23>27>31日目)に細胞のプロットを色分け(オレンジ色>緑色>水色>紫色)して表示している。グラフから分かるように、分化誘導後の日数が同じ細胞であっても擬似時間軸上に幅広く分布していた。
C.成熟化速度を制御する因子の抽出方法の模式図。成熟度順に並べた細胞の同一成熟度において、分化誘導期間の短い細胞は短期間で特定の成熟度に達するため、「成熟化速度の速い細胞」と定義できる。一方、分化誘導期間が長い細胞は、長い時間を経て特定の成熟度に達するため、「成熟化速度の遅い細胞」と定義できる。このように定義した細胞間で発現の異なる遺伝子を抽出し、これらの発現変動を制御する上流因子をオミックスデータに基づいてネットワーク/パスウェイ解析するソフトウエア(IPA)で探索したところ、PPARα経路の活性化が近位尿細管細胞の成熟化速度の調節に関与することを見いだした。
このPPARα経路の活性化により、腎臓オルガノイドの近位尿細管の成熟度が上昇するのかを確認するために、iPS細胞から腎臓オルガノイドを作製する際の培地にPPARα活性化剤を加えて培養しました(図3A)。その結果、PPARα経路を活性化することで、近位尿細管の成熟化マーカー遺伝子の発現が上昇することが分かりました(図3B)。また、タンパク質の再吸収機能の上昇(図3C)および、尿細管壊死を引き起こす薬剤(シスプラチン[9])に対する細胞死の感受性の上昇(図3D)も認められました。これは、PPARα経路を活性化させた腎臓オルガノイドの近位尿細管では、エンドサイトーシスという機能が活性化して小分子を多く取り込むことができるようになり、薬剤に対する感受性も向上したためと考えられました。
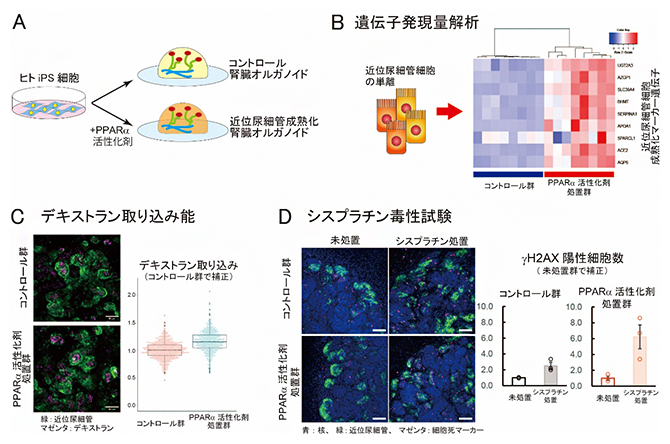
図3 近位尿細管成熟化腎臓オルガノイドにおける遺伝子発現量解析と機能評価
A.近位尿細管の成熟化速度を向上させた腎臓オルガノイドの作製。PPARα経路を活性化させる薬剤を培地に添加して腎臓オルガノイドを作製した。
B.PPARα経路の活性化による近位尿細管の成熟化マーカー遺伝子の発現上昇。ヒトiPS細胞株を二つに分け、PPARα活性化剤処置したものと未処置(コントロール)の腎臓オルガノイドをそれぞれ8サンプルずつ作製した。近位尿細管細胞を精製し、成熟化マーカー遺伝子の発現量を比較したところ、PPARα活性化剤処置群でこれらの遺伝子発現が上昇(ヒートマップの赤色で示す)していた。
C.腎臓オルガノイドの再吸収機能の評価。本実験では、近位尿細管における再吸収機能を主に担うエンドサイトーシスの活性化を調べるため、エンドサイトーシスを検出する薬剤(蛍光ラベルしたデキストラン)の取り込みにより評価した。近位尿細管(緑)に取り込まれたデキストラン(マゼンタ)の蛍光強度は、PPARα活性化剤処置群で有意に高い。スケールバーは50マイクロメートル(μm、1μm は100万分の1メートル)。
D.シスプラチン処置による細胞死の評価。シスプラチン処置により、細胞死マーカー(DNA障害の指標であるγH2AX陽性)を示す細胞の数が増える。γH2AX陽性細胞数の上昇は、PPARα活性化剤処置群で高い傾向にあった。スケールバーは100μm。
さらに研究チームは、公共データベースで公開されているヒト胎児腎臓や成人腎臓の1細胞解析のデータを用いて、ヒトの腎臓発生における近位尿細管細胞の成熟度スコアを定義することに成功しました。そして、今回作製した腎臓オルガノイドの近位尿細管細胞の成熟度をこれに当てはめたところ、PPARα経路を活性化させたオルガノイドは、活性化させなかったものに比べて近位尿細管細胞の成熟度の上昇が認められました。しかし、PPARα経路の活性化によってもオルガノイドの成熟度は成人の腎臓レベルには達しておらず、胎児期の腎臓の成熟度と近いことが分かりました(図4)。
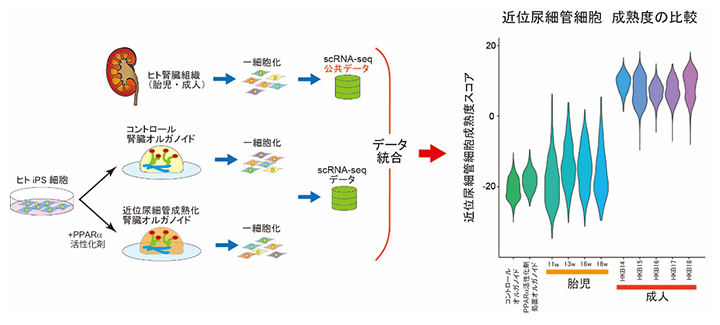
図4 公共データを用いた腎臓オルガノイド近位尿細管細胞の成熟度の比較
ヒト胎児や成人の腎臓から取得された1細胞RNA sequence(scRNA-seq)公共データを用いた、腎臓オルガノイドの近位尿細管細胞の成熟度の比較。コントロールオルガノイドに対して、近位尿細管を成熟化させたオルガノイドでは近位尿細管細胞の成熟度スコアは上昇した。しかし、この成熟度は胎児期の腎臓の成熟度に近く、成人の腎臓の成熟度に達していない。
今後の期待
近位尿細管は、大量のエネルギーを消費し、尿中から小分子を再吸収する機能を最も強く発揮する組織であると同時に、さまざまなストレスや薬剤によりダメージを受けやすい組織です。そのため新薬開発の際には、近位尿細管へのダメージによる腎機能低下が薬の副作用として出るかどうかを、動物実験や臨床試験により、入念に確認する必要があります。しかし、それぞれ、動物福祉や動物と人間の薬剤感受性の違いの問題、人体を使う臨床試験のコストや時間の問題があり、薬価高騰や開発期間の長期化をもたらす原因となっています。
今回の発見は、腎臓オルガノイドの近位尿細管の成熟化速度を人為的に速める手法であり、動物や人体を使わずに腎臓オルガノイドを腎毒性試験に用いる技術の開発につながると考えられます。
一方、今回の発見により成熟化速度を制御することができるようにはなったものの、現在の培養技術で腎臓オルガノイドが到達できる成熟度の上限も見えました。今後は、腎臓オルガノイドの培養技術をさらに最適化し、小児、さらには成人の腎臓と同じ成熟度に到達するための研究を進めていきます。
補足説明
1.iPS細胞
人工多能性幹細胞。皮膚や血液などから採取した細胞に少数の遺伝子などを導入して作製された多能性幹細胞。iPSはinduced pluripotent stemの略。
2.オルガノイド
3次元的に幹細胞や前駆細胞を培養する方法(オルガノイド培養)により、人工的に作製した細胞塊の中に幹細胞だけでなく分化細胞を含み、由来する組織や胚の機能を部分的に持つ「ミニ臓器」をオルガノイドと呼ぶ。培養されたオルガノイドは、薬剤のスクリーニングなどの創薬応用や、再生医療のソースとしての応用が期待されている。
3.近位尿細管
尿細管のうち、糸球体と接続する側を近位尿細管と呼ぶ。近位尿細管は、糸球体で血液をろ過して生成された尿(原尿)からタンパク質や電解質など生体に必要な成分を再吸収する。近位尿細管で再吸収されなかった物質は、遠位尿細管を経て集合管に送られる。
4.PPARα
ペルオキシソーム増殖因子活性化受容体アルファ。細胞内または核内で脂溶性物質と結合することにより転写因子として働く核内受容体の一つ。PPARαによって活性化する一連の遺伝子発現や代謝などをPPARα経路と総称する。PPARはperoxisome proliferator-activated receptorの略。
5.エンドサイトーシス
細胞が外来物質を取り込む経路の一つ。細胞膜を内側に陥入させて小胞を形成することで、細胞内へ取り込む。
6.ネフロン、ネフロン前駆細胞
ネフロンは腎臓機能の最小の構成組織。その前駆細胞であるネフロン前駆細胞は、発生過程において中間中胚葉から分化した腎節(間葉細胞)のうち、後腎間葉に由来する。
7.1細胞RNA sequence法
DNAシーケンサーを用いて、1細胞中に含まれるRNAの量や種類を網羅的に決定する手法。細胞ごとの遺伝子発現プロファイルを基に細胞集団を分類し、各集団に含まれる細胞タイプ、割合、特徴的な遺伝子発現を同定できる。
8.疑似時間軸細胞経路解析
遺伝子発現パターンの類似性を基に、遺伝子発現が変化していく疑似的な時間軸を設定し、一つ一つの細胞をその順番に並べることで細胞分化の軌道を推定する手法。
9.シスプラチン
腎臓に対し毒性を持つ抗がん剤の一つ。人体に対する長期間あるいは高濃度の使用により、副作用として近位尿細管にアポトーシス(細胞死)を引き起こす。
研究チーム
理化学研究所 生命機能科学研究センター ヒト器官形成研究チーム
チームリーダー 髙里 実 (タカサト・ミノル)
テクニカルスタッフⅠ 福井 智恵 (フクイ・チエ)
客員研究員 佐原義基 (サハラ・ヨシキ)
(大塚製薬株式会社 大阪創薬研究センター 創薬モダリティ研究所 研究員)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、理研BDR-大塚製薬連携センター、大塚製薬株式会社の支援および、日本学術振興会(JSPS)科学研究費助成事業新学術領域研究(研究領域提案型)「腎臓オルガノイドを用いた細胞成熟度多様性の理解と制御(研究代表者:髙里実)」、日本医療研究開発機構(AMED)再生医療・遺伝子治療の産業化に向けた評価基盤技術開発事業「創薬スクリーニングを可能にするヒトiPS細胞を用いた腎臓Organ-on-a-Chip(研究代表者:横川隆司)」「被血管化能を備えた腎臓細胞の安定作出(研究代表者:髙里実)」「ヒト iPS 細胞を用いた腎臓 MPS の高機能化と疾患モデルへの展開(研究代表者:横川隆司)」による助成を受けて行われました。
原論文情報
Yoshiki Sahara, Chie Fukui, Yuki Kuniyoshi, Minoru Takasato, “Proximal tubule cell maturation rate and function are controlled by PPARα signaling in kidney organoids”, Communications Biology, 10.1038/s42003-024-07069-6
発表者
理化学研究所
生命機能科学研究センター ヒト器官形成研究チーム
チームリーダー 髙里 実(タカサト・ミノル)
客員研究員 佐原 義基(サハラ・ヨシキ)
報道担当
理化学研究所 広報室 報道担当