2024-11-28 国立成育医療研究センター
国立成育医療研究センター(所在地:東京都世田谷区大蔵、理事長:五十嵐隆)小児がんセンター血液腫瘍科の富澤大輔は、同臨床研究センターの研究支援のもと、欧米の小児急性骨髄性白血病(AML)研究グループと協働して、AMLを再発した小児患者を対象とした国際共同医師主導治験を開始します。
AMLは、再発した場合の生存率が40%に満たず、有効で安全な新しい治療法の開発が望まれています。
本治験は、治療の難しい再発AMLの小児患者に対する標準治療法を確立することを目的に、AMLを再発した小児患者約100名(日本人約10名を含む)を対象に行います。日本をはじめ、アメリカやオランダなど、約20カ国が参加する国際的な治験です。
具体的には、FLA/GO併用療法※1に、分子標的薬※2のベネトクラクスを併用することで、治療成績が改善するかどうかを、ランダム化比較試験※3で検証します(図1)。日本からは、国立成育医療研究センターが日本の代表施設となり、兵庫県立こども病院・大阪市立総合医療センター・埼玉県立小児医療センター・日本赤十字社愛知医療センター名古屋第一病院が参加します。
※1:FLA/GO併用療法:抗がん剤であるフルダラビン+シタラビン+ゲムツズマブオゾガマイシンの併用療法。欧米を中心に再発AMLの治療に用いられています。
※2:分子標的薬:病気の原因となっている特定の分子だけを攻撃する薬。
※3:ランダム化比較試験:研究の対象者を無作為に2つのグループに分けて、ある介入の効果を検証する研究手法。最もエビデンスレベルが高いとされています。
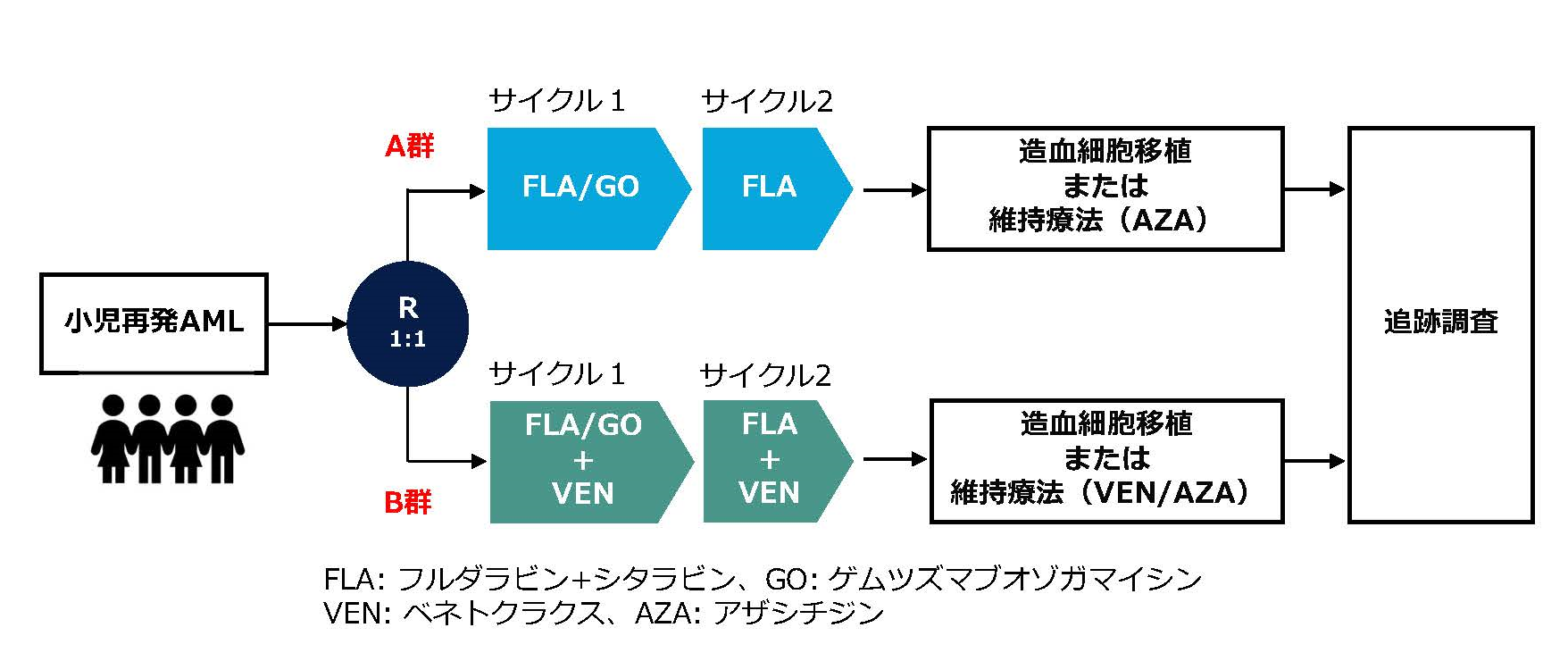
【図1:再発AMLの国際医師主導治験(ITCC-101/APAL2020D試験)の概要】
プレスリリースのポイント
- AMLは血液のがんである白血病の一種で、国内では毎年180人ほどの子どもが発症しています。複数の抗がん剤を用いる多剤併用化学療法や、再発リスクが高い患者さんには造血細胞移植を組み合わせることで、約80%の患者さんが治るようになりました。しかし、再発した場合の生存率は40%に満たない状況で、新規治療法の開発が望まれています。
- 近年、AMLに対する新しい治療として分子標的薬が開発されており、すでに複数の薬剤が成人患者さんを対象に承認されています。一方で,小児患者に対する開発は、さまざまな理由から世界的に思うように進んでおらず、日本では小児のAMLに対して承認されている分子標的薬はありません。
- 本治験は、AMLを再発した世界中の小児患者100名(日本人約10名含む)を対象とし、FLA/GO併用療法のみを行うグループと、FLA/GO併用療法に加え分子標的薬のベネトクラクスを併用するグループに分け、治療成績を見ていきます。
- 国際共同治験に積極的に参加することで、日本と海外で同時に新規治療法を開発することができます。また、AMLのような希少疾患では、新規治療法の効果を評価するために必要な数の患者さんを一定期間に確保することが困難なため、欧米では国際共同治験が増えてきています。日本において国際共同治験を実施する基盤と国際コミュニケーション力(言語・文化)を充実させることは、海外で使われている治療薬が日本では使うことができない「ドラッグラグ」問題を解消するための、重要な国際戦略の一つになると期待されます。
国際医師主導治験の概要
- 参加国:日本やアメリカ、オランダなど、約20カ国
- 対象:急性骨髄性白血病(AML)を再発した小児患者100名(日本人約10名を含む)
- 研究手法:ランダム化比較試験
グループA:FLA/GO併用療法(フルダラビン+シタラビン+ゲムツズマブオゾガマイシン)
グループB:FLA/GOに加えて、分子標的薬ベネトクラクスを併用 - 治験登録期間:2026年4月30日まで
- 治験期間:2029年9月まで
治験に関する問い合わせ先
国立成育医療研究センター 臨床研究センター 臨床研究コーディネートユニット
本件プレスリリースのPDFダウンロード
- 本件に関する取材連絡先
国立成育医療研究センター 企画戦略局 広報企画室