2024-12-03 理化学研究所
理化学研究所(理研)生命機能科学研究センター 合成生物学研究チームの上田 泰己 チームリーダー、秋山 郁人 リサーチアソシエイト(研究当時)、松本 桂彦 客員研究員らの共同研究チームは、ハイスループット[1]で簡便なマウス臓器まるごとの透明化、染色、3Dイメージング、データ解析手法を開発しました。
本研究成果は、組織切片による従来の2D観察から、臓器まるごとを対象とする3Dバイオロジーへの移行を加速し、創薬研究や病理診断技術の次世代化への貢献が期待できます。
組織や臓器レベルの生命現象を細胞レベルで理解するには、従来の平面的・断片的な2D画像で得られる情報では限界があり、立体的・網羅的な3D画像による高品質データ解析への移行が、バイオ医学研究を大きく進展させると期待されています。このためには、組織透明化、免疫染色、顕微鏡撮影、および解析のハイスループット化が重要ですが、これまでは頻繁な溶液の交換作業の煩雑さのために多くのサンプルを処理することは困難でした。
今回、共同研究チームは、細胞培養などでよく用いられる6ウェルプレート[2]を用いて、簡便でハイスループットな組織透明化プロトコルを開発しました。これにより、複数のマウスの脳や各臓器の透明化を簡便かつ並行して行うことができるようになり、独自に開発した高速光シート顕微鏡[3]による3Dイメージングやクラウド上での解析環境を組み合わせることで、透明化からデータ解析までの一連のステップを効率的に行うことが可能になりました。
本研究は、科学雑誌『Nature Protocols』オンライン版(12月3日付:日本時間12月3日)に掲載されました。
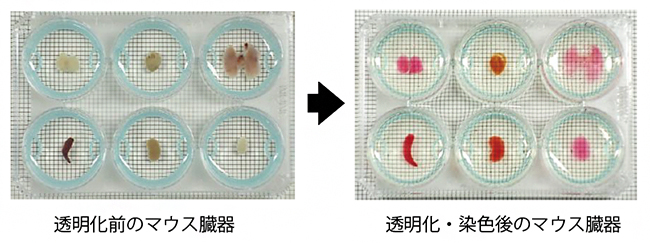
ハイスループットな組織透明化プロトコルによるマウス臓器の透明化
背景
現在の創薬研究や病理研究、病理診断の現場では、対象となる生体組織を薄く切ってスライドガラスに貼ったものを顕微鏡で観察します。この従来法では、サンプルのごく一部しか観察できていないため、小さな変化を見落とすなど定量的な判断ができず、また元の組織が3次元的にどのような構造をとっているのか分からないなど、課題も多くあります。
生体の内部構造を光学的に観察するための組織透明化技術は1900年頃から開発されてきましたが、十数年前から光シート顕微鏡と組み合わせることで飛躍的な発展を遂げてきました。透明化手法には大きく分けて有機溶剤を用いた方法と水溶性化合物を用いた方法、ゲルに包埋(ほうまい)する方法の3種類があります。水溶性化合物を用いた方法は比較的扱いやすく、蛍光タンパク質や免疫染色[4]などとも相性が良いため、上田チームリーダーらはこれまでに水溶性化合物を用いた透明化技術CUBIC[5]を開発し、併せて染色、撮影、解析技術の開発を行ってきました注1)。その結果、個々の要素技術としての性能では世界最高レベルに達していましたが、基礎研究や臨床現場で広く使用されるには、簡便なプロトコルとデータ解析までのパイプライン[6]の構築が必要でした。
注1)2014年4月18日プレスリリース「成体の脳を透明化し1細胞解像度で観察する新技術を開発」
研究手法と成果
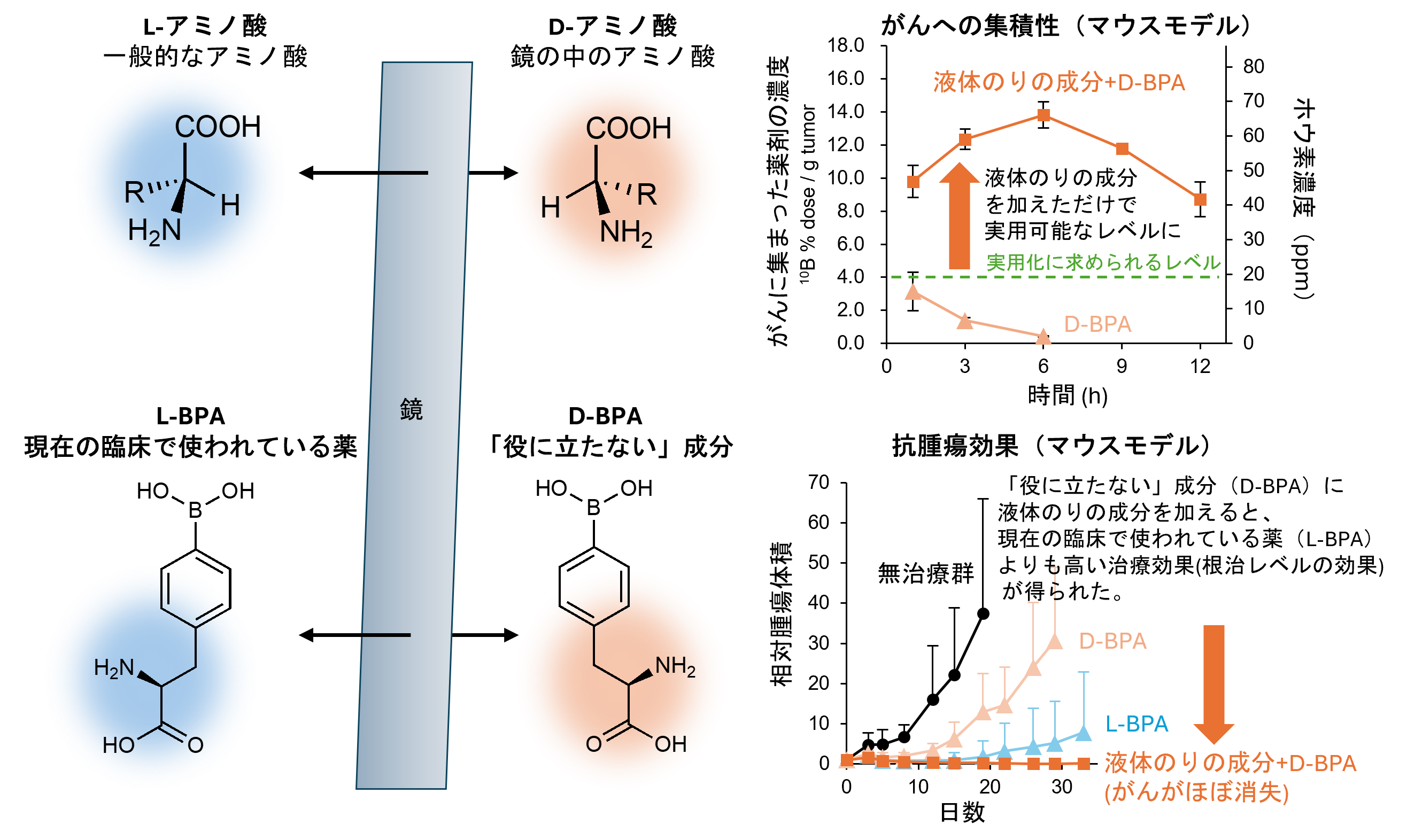
本研究では、簡便かつ並列処理可能な透明化プロトコルの開発を行いました。これまでは、一つのサンプルを一つのチューブに入れ、透明化液や洗浄液を合計20回近く交換する必要があり、サンプル数が多くなると溶液交換に膨大な時間がかかるため、大規模な研究にCUBICを用いることは困難でした。そこで、細胞培養で一般的に使用する6ウェルプレートに、3Dプリンターで作成した透明化用のインサートデバイスを入れることで、1プレートにつき6サンプルを並列に作業できるようにし、溶液の交換も1サンプル当たり4~5倍程度の高速化を実現しました(図1)。また、以前に松本客員研究員らが開発した低倍率/広視野化した高速の光シート顕微鏡注2)を用いることで、マウスの脳や肺、心臓、腎臓などの臓器全体の3D蛍光画像を迅速に撮影できるようになりました(図2)。さらに、脱色処理を追加することで、眼球のような色素が多い組織もこのプロトコルによる透明化が可能になりました(図3)。

図1 6サンプルの並列作業を可能にするインサートデバイス
a)3Dプリンターで作成した透明化用のインサートデバイス。
b)従来法での溶液交換作業。一つのサンプルを一つのチューブに入れて溶液を交換する必要があった。
c)6ウェルプレートにインサートデバイスを入れることで、サンプルの出し入れや溶液交換を迅速に行い、1プレートにつき6サンプルを並列に作業できるようになった。各ウェルの直径は3.5cm。
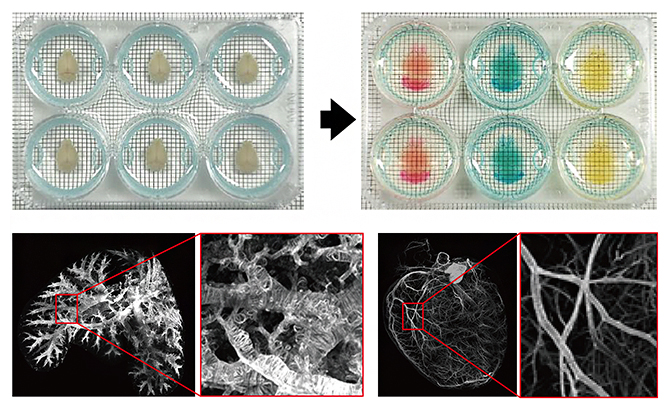
図2 6ウェルプレートを用いたマウス臓器の透明化
上)6ウェルプレートを用いたマウス脳の透明化・染色の例。固定液(パラホルムアルデヒド)で処理した不透明な臓器を、透明化し、核染色した。色の違いは、核染色に用いた3種類の試薬(PI、SYTOX-G、RD2)によるもの。背景のマス目は2mm。
下)透明化した肺(左)および心臓(右)の全体像を光シート顕微鏡で低倍率/広視野で観察した画像と、それぞれの赤枠部分を高倍率で観察した画像。

図3 マウス眼球の透明化
眼球は虹彩や網膜色素上皮など色素を多く含むが、透明化処理後に脱色の工程を追加することで、透明化サンプルを得ることができる。背景のマス目は2mm。
本研究では光シート顕微鏡で得た3D画像から細胞を検出するプログラムを作成し、クラウドベースでマウス全脳の定量解析ができるCUBIC-Cloud[7]注3)に適用可能な形式に変換しました。パイプラインの実施例として、中枢神経系に作用する薬剤を投与したマウス脳を取り出し、透明化、免疫染色、撮影、細胞検出、定量解析を実施し、全脳に対する薬剤の影響の可視化を試みました。免疫染色は神経の活動マーカーであるc-Fos抗体[8]を用いました。c-Fos陽性細胞を検出してCUBIC-Cloud上で解析を行うことで、マウス全脳のどの神経細胞が活性化し、どの領域で薬剤の投与有無による差が見られるかを解析することに成功しました(図4)。これにより、本研究で開発した透明化から解析までのパイプラインが、中枢神経系に対する薬効を評価できることが実証できました。
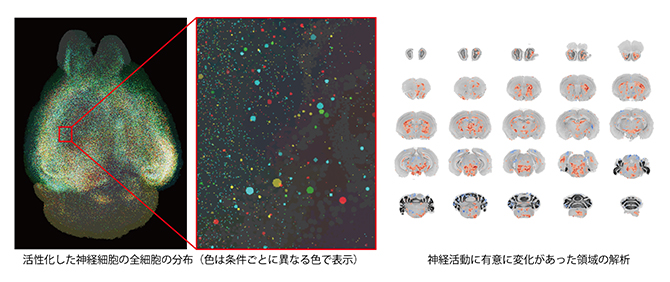
図4 CUBIC-Cloudによる全脳解析パイプラインの解析例
本研究での全脳解析パイプラインでは、6ウェルプレートを用いてマウス脳を透明化処理した後、光シート顕微鏡で撮像し、取得した全脳画像と、特定の細胞を検出した画像をCUBIC-Cloudにアップロードした。CUBIC-Cloudでは、クラウド上で全脳の3次元構造をデジタル化したマウス脳アトラス(CUBIC-Atlas)とアップロードした脳画像の位置合わせを行い、解析を行った。
左)中枢神経に作用する薬剤で活性化した神経細胞の全細胞の分布。全脳の画像と、赤枠部分の拡大図を示す。薬剤処理の条件の違いによる活性化細胞を異なる色で表示した。
右)薬剤処理で神経活動に有意に変化があった領域の解析。画像は脳の断面図。
注2)2019年12月13日プレスリリース「臓器内の全細胞を調べる革新技術」
注3)2021年6月22日プレスリリース「脳の全細胞を解析するクラウドシステムの開発」
今後の期待
本研究成果により、簡便に多数のマウス臓器を透明化して、光シート顕微鏡を用いた3D画像の取得、細胞検出から全細胞の解析をすることが可能になりました。今回の実証実験では薬剤による神経活動の網羅的な定量解析を行いましたが、他にも、抗体医薬品や核酸医薬品が臓器のどこに送達されているのか、どこに蓄積しているのかなどを可視化して、定量的に評価することにも応用できます。さらに、透明化した組織・臓器中の全ての細胞を観察することができるので、転移がん細胞や幹細胞のような組織中にごくわずかしか存在しない細胞まで見落とすことなく、観察、定量することが可能になると期待できます。これまでの組織切片を使った2Dから、臓器まるごとの3Dのバイオロジーへ移行していくことで、創薬研究や臨床研究を含めてさまざまな分野での研究が効率化されることが期待されます。
補足説明
1.ハイスループット
従来の実験手法などの高速・効率化による大量処理を指す用語。high-throughput。
2.6ウェルプレート
「ウェル」は、プレートに設けられた液体やサンプルを入れるための穴を意味し、6ウェルプレートは、通常3×2列で合計六つのウェルを備えたプレート。六つのサンプルを一つのプレートで同時に扱うことができる。
3.光シート顕微鏡
レーザー光をシート上に広げて透明化サンプルの側面から照射し、サンプルの上からカメラで撮影することで、透明化サンプル内の特定の平面(光学切片)を撮影することができる顕微鏡。サンプルをZ方向(高さ方向)に動かして光学切片を撮影する。本研究で使用した光シート顕微鏡はサンプルを止めずに連続撮影する技術を用いて高速化している。
4.免疫染色
特定の抗原に結合する抗体の性質を利用し、タンパク質などを可視化する手法。
5.CUBIC
理研が2014年に開発した、3次元イメージング、画像解析を組み合わせた全臓器・全身全細胞解析のためのパイプライン。CUBICは、Clear, Unobstructed Brain/Body Imaging Cocktails and Computational analysisの略。
6.パイプライン
実験で得られた結果を次の解析に回す一連の工程において、それらを並行して行う処理システムを比喩的にパイプラインと呼ぶ。
7.CUBIC-Cloud
理研が2021年に開発して公開したクラウドベースのマウス全脳解析プラットフォーム。核画像と点群化したcsvのファイル形式のデータをアップロードすることで、CUBIC-Atlas(理研が2018年に作成して公開した、マウス全脳の全細胞の位置と組織学的情報をひも付けした全細胞アトラス)にマッピングされ、サンプル間の比較解析が可能になる。
8.c-Fos抗体
c-Fosは、核内で機能する転写因子の一つ。c-Fosの発現はニューロンの活動と関連しており、c-Fosを認識する抗体で染色することで神経活動を捉えることができる。
共同研究チーム
理化学研究所 生命機能科学研究センター 合成生物学研究チーム
リサーチアソシエイト(研究当時)秋山 郁人(アキヤマ・フミト)
(長崎大学 大学院医歯薬学総合研究科 眼科・視覚科学教室 助手)
客員研究員 松本 桂彦(マツモト・カツヒコ)
(東京大学 大学院医学系研究科 機能生物学専攻 システムズ薬理学教室 講師)
研修生 山下 勝成(ヤマシタ・カツナリ)
チームリーダー 上田 泰己(ウエダ・ヒロキ)
(東京大学 大学院医学系研究科 機能生物学専攻 システムズ薬理学教室 教授)
長崎大学 大学院医歯薬学総合研究科 眼科・視覚科学教室
准教授 大石 明生(オオイシ・アキオ)
教授 北岡 隆(キタオカ・タカシ)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、科学技術振興機構(JST)ムーンショット型研究開発事業「恒常性の理解と制御による糖尿病および併発疾患の克服(研究代表者:片桐秀樹)」、同戦略的創造研究推進事業ERATO「上田生体時間プロジェクト(研究総括:上田泰己)」、同光・量子飛躍フラッグシッププログラム「量子生命技術の創製と医学・生命科学の革新(研究代表者:馬場嘉信)」、日本医療研究開発機構(AMED)先端的バイオ創薬等基盤技術開発事業「先端的医療技術に対する全臓器・全身スケールでの評価技術基盤の開発(研究代表者:上田泰己)」による助成を受けて行われました。
原論文情報
Fumito Akiyama, Katsuhiko Matsumoto, Katsunari Yamashita, Akio Oishi, Takashi Kitaoka, Hiroki R. Ueda, “A multiwell plate approach to increase the sample throughput during tissue clearing”, Nature Protocols, 10.1038/s41596-024-01080-1
発表者
理化学研究所
生命機能学科研究センター 合成生物学研究チーム
チームリーダー 上田 泰己(ウエダ・ヒロキ)
客員研究員 松本 桂彦(マツモト・カツヒコ)
リサーチアソシエイト(研究当時)秋山 郁人(アキヤマ・フミト)
報道担当
理化学研究所 広報室 報道担当