2025-01-29 理化学研究所
理化学研究所(理研)生命機能科学研究センター 先端バイオイメージング研究チームの塩井 剛 技師、渡邉 朋信 チームリーダー、発生動態研究チームの東 裕介 研究員(研究当時)、大浪 修一 チームリーダーらの研究チームは、これまでに観察困難とされてきたマウス初期胚[1]の受精後5.5日目から24時間にわたる全細胞の連続観察に成功しました。
本研究成果は、哺乳類の初期発生において細胞が多細胞システムを構成するメカニズムという基礎科学の解明に加え、胎児の生育異常の原因解明やその治療などの医学応用にもつながると期待されます。
マウスの胚発生において受精後5.5日目は、将来の体づくりの基礎となる体軸の形成に重要な時期です。この時期の細胞移動が将来の前後軸を決定し、細胞配置の対称性が破れ、多細胞システムが形成されていきます。この詳細なメカニズムの解明には、胚全体および内部の細胞全ての同時動的観察が必要でしたが、それを達成できた研究はありませんでした。
今回、研究チームは、理研がこれまで培ってきた発生生物学の実験技術と、光学顕微鏡の開発技術、生物画像の処理・解析技術を駆使して、初期胚に最適な観察環境を実現した新しいインキュベータ型光シート顕微鏡[2]システムを開発し、受精後5.5日目マウス初期胚の最長24時間の全細胞連続観察および12時間の細胞挙動の完全追跡に成功しました。このシステムにより、胚体が単調に成長する間に突然収縮するという新しい発見にもつながりました。
本研究は、科学雑誌『Life Science Alliance』(1月15日付)に掲載されました。

インキュベータ型光シート顕微鏡のサンプル付近の構成と、観察時の様子
背景
哺乳類の体には、前後(頭尾)、左右、背腹の三つの軸があります。受精卵にはこのような方向性は存在しませんが、発生が進むにつれてこれらの軸に沿った形の違いが現れます。マウス胚の初期発生過程では、受精後5.5日目に円柱状となった胚に胚体外胚葉[3]が形成され、この子孫細胞から体のほぼ全て(一部の腸管を除く)が作られます。同時に、最も原始的な体軸である前後軸が形づくられ、その後の形態形成の基盤となります。この前後軸形成のきっかけは、腸管の一部となる臓側内胚葉[4]の一集団(遠位臓側内胚葉(DVE)[4])が将来の前側となる領域に約5時間かけて移動することであり、それに続いて形態的な左右非対称性[5]や、シグナル伝達カスケード[6]の非対称性が発生すると考えられています。この仮説の証明には、受精後5.5日目における全細胞の配置変換を観察することが必要不可欠ですが、この時期の胚はすでに子宮に着床した状態で発生しており、詳細な観察のためには培養した胚を用いる必要があります。
近年の光学顕微鏡の性能向上により、胚盤胞[1]形成以前や受精後6.5日目以降での単一細胞解像度での長時間観察に、いくつかの研究グループが成功しています注1、2)。また、受精後5.5日目以前の単一細胞の長時間観察も実現されていますが、生きた受精後5.5日目胚での単一細胞観察を達成した研究報告は1件のみであり、その観察時間は90分でした注2)。5時間にわたる細胞集団の移動を観察し、初期胚が対称性の破れ(左右差の出現)を獲得するメカニズムを解明するには、受精後5.5日目から5時間以上の全細胞の連続観察が必要ですが、これまでどの研究チームも成功していませんでした。マウス初期胚の発生過程において、顕微鏡観察が困難な受精後5.5日目からの24時間は「ミッシングリンク(失われた環)」だったのです。
受精後5.5日目からの24時間は、胚を構成する細胞の状態が大きく変化するため、この時期のマウス初期胚は周囲環境に対して敏感になり、正常に成育するように培養するのが難しいことが知られています。また、顕微鏡観察に必要となる光の照射は、細胞に対して毒性を持つので、その影響も大きく現れます。研究チームは、このことが、受精後5.5日目からの全細胞観察の妨げになっていたと考えました。
注1)Kurotaki Y, Hatta K, Nakao K, Nabeshima Y, Fujimori T (2007) Blastocyst axis is specified independently of early cell lineage but aligns with the ZP shape. Science 316: 576, 719-723.
注2)Ichikawa T, Nakazato K, Keller P, Kajiura-Kobayashi H, Stelzer EHK, Mochizuki A, Nonaka S (2013) Live imaging of whole mouse embryos during gastrulation: migration analyses of epiblast and mesodermal cells. PLOS One 8: e64506.
研究手法と成果
今回、研究チームは、「受精後5.5日目のマウス初期胚における、24時間の全細胞の完全追跡」を達成目標に設定しました。市販されている顕微鏡でこの目標を達成できる製品は存在しなかったため、本研究では、理研がこれまで培ってきた発生生物学の実験技術と、光学顕微鏡の開発技術、生物画像の処理・解析技術を駆使して、受精後5.5日目のマウス初期胚の観察に特化した顕微鏡の開発に自ら取り組みました。その結果、マウス胚発育環境に最適化された顕微鏡観察用飼育装置(インキュベーター)の開発と、観察条件における胚への光毒性の検討を組み合わせて、最終的に、生きた受精後5.5~6.0日目胚における単一細胞の移動と胚全体の形態変化の同時追跡に成功しました。この顕微鏡システムにより、胚半球内の全ての細胞を識別することができ、胚体外胚葉、臓側内胚葉、DVEのそれぞれの細胞運動を定量することが可能となりました。また、胚の単調な成長中に突発的な収縮を伴う「しゃっくり」のような新たな挙動も発見しました。
①顕微鏡の仕様設定
マウス初期胚の大きさは、受精後5.5日目から24時間で直径約300マイクロメートル(μm、1μmは100万分の1メートル)、長さ1,000μm程度にまで成長します。そのため、必要な観察視野は300μm×300μm×1,000μmとなります。全ての細胞の連続的な動きを追跡するのに、緑色蛍光タンパク質(GFP)[7]で標識した核内タンパク質の蛍光を利用して細胞核を識別します。一つ一つの細胞核を識別するために必要な空間分解能は5μmです。細胞は分裂して二つに分かれてそれぞれ運動します。この細胞分裂を認識して検出するために必要な時間分解能は5~10分です。これらの仕様を満たす顕微鏡の基盤となる技術は、光シート顕微鏡技術です(図1A)。マウス胚内部にあるさまざまな微小構造は、光を反射、吸収、散乱し、取得された画像の質劣化の原因となります。この問題に対しては、過去に開発されてきた光学的な解決方法を導入して、最終的に、観察視野は300μm×300μm×1,000μm、空間分解能1~3μm、時間分解能18秒を実現しました。
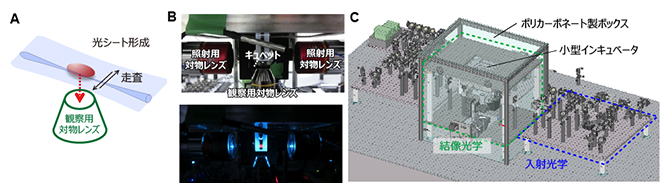
図1 開発した光シート顕微鏡
A)光シート顕微鏡の概念図。細く集光したレーザー光を水平方向に往復走査することでシート光を実現する。この薄いシートは観察サンプルを透過し、その内部のみを照射することができる。
B)サンプル付近の写真。サンプルを設置するキュベット(ガラスセル)の両側に光シート照射用の対物レンズ、および、下側に観察用の対物レンズが配置されている。下の図写真は、キュベット内に蛍光色素を入れて光シートを可視化した例。
C)開発された顕微鏡システムの外観図。結像光学系全てがポリカーボネート製の箱に覆われている。
②マウス胚への光毒性の軽減
観察仕様の達成だけでは、受精後5.5日目のマウス初期胚の連続観察は実現できません。光シート作成時のレーザー強度や照射回数が、細胞に損傷を与え、初期胚が成長しないからです。一方で、細胞は光照射で受けた損傷を修復する能力を備えているので、光照射後に十分に時間を与えれば細胞が受けた損傷は修復されます。そのため、一般的には、細胞に与える損傷を軽減するため照射強度は可能な限り低くし、かつ、回復の時間を与えるために照射回数を可能な限り減らします(つまり、時間分解能を可能な限り低く設定)。このような予想に基づいた試行錯誤は、過去にも行われていたはずですが、それにもかかわらず成功例が報告されていないのは、何か見落としている「鍵」があるからと考えられます。
研究チームは、マウス胚性幹細胞(ES細胞)[8]に対する光照射への影響を調べる実験系をつくり、光照射の細胞への影響を詳細に調べました。まず、ES細胞は、接着培養時と浮遊培養時では光に対する耐性が全く異なり、浮遊培養時の方が、はるかに耐性が低いことが分かりました。つまり、一般的に、接着細胞を用いた実験結果から得られた洞察は、浮遊状態にあるマウス初期胚の観察には当てはまらないのです。そこで、初期胚を模したES細胞の塊(胚様体)をつくり、培養液に浮遊する胚様体に対する光照射の影響を調べることにしました。研究チームは、レーザーの走査速度や強度、照射頻度などさまざまな条件で胚様体に光照射を行い、胚様体の成長率の低下から光照射による毒性を定量しました。これにより、マウス胚への光毒性を軽減できる光照射条件が見つかりました。
③顕微鏡観察と両立する胚培養システムの開発
それでもなお、受精後5.5日目のマウス初期胚の連続観察は実現できませんでした。次に研究チームが着目したのは「損傷の回復」です。試験管実験系における環境は、子宮内環境とは大きく異なります。従って、培養すること自体が初期胚へのストレスとなり、その上に光照射によるストレスも負荷されるのです。可能な限り初期胚に対して適した環境を与えることで、損傷の回復が促進される、あるいは、ストレスの軽減になると予想し、顕微鏡観察時における培養システムの開発を行いました。
大きさ10mm×10mm×23.5mmのガラス製キュベット(ガラスセル)を光シート顕微鏡のサンプルホルダーとしました。この中に初期胚が配置されます(図1B)。ガラス製キュベットは、常に37.0℃(5%CO2、湿度95%)に調整された小型チャンバー[9]に入れられて、顕微鏡のステージに載せられます。さらに、顕微鏡全体をポリカーボネート製の箱で覆いました(図1C)。一般的には、サンプル周辺に温度センサーを設置しフィードバック制御により温度を一定に保つのですが、この仕組みでは、箱内部で空気の対流が発生します。この対流は初期胚にとって力学的な刺激となります。また、結果として、チャンバー温度が対流に合わせて変動してしまいます。研究チームは、一定の温度に調整された空気を一定の速度で流すことでチャンバー内を陽圧に保ちながら空気の流れを恒常的に保つことで、この問題を解決しました(図2A)。さらに、コラーゲンで満たされた3mm立方のキューブの中に初期胚を配置し、そのキューブをガラス製キュベット底面に設置しました(図2B)。コラーゲンゲルが溶液の対流による力学刺激から初期胚を守ってくれるのです。

図2 顕微鏡を覆う培養インキュベータシステム
A)実際の顕微鏡システムの写真。写真では結像光学系も入射光学系も共にポリカーボネート製ボックスに覆われている。結像光学系の方にのみ、37℃に温められた空気が還流している。入射光学系側のボックスはミラーやレンズなどの光学素子へのほこりなどの汚れの付着を防ぐ役割をしている。
B)キュベットにマウス初期胚を設置した様子。初期胚はコラーゲンゲルで満たされた一辺3mmのキューブの中に設置されている。このキューブをキュベット底面に静置する。
④初期胚全細胞の24時間連続撮像
こうして研究チームは、受精後5.5日目のマウス初期胚について、単細胞を識別できる空間分解能を維持したまま、一度の撮像で1,800枚/30秒の画像を、5分ごとに最長24時間連続で収集することに成功しました(図3A)。また、5.5日目から12時間までは、一つ一つの細胞の挙動を完全に追跡できました。この結果、例えば、初期胚の外側に位置した細胞が初期胚内部に移動した後に細胞分裂を行い、それぞれの娘細胞が細胞の外側へと再度移動する様子が明確に観察されました(図3B)。
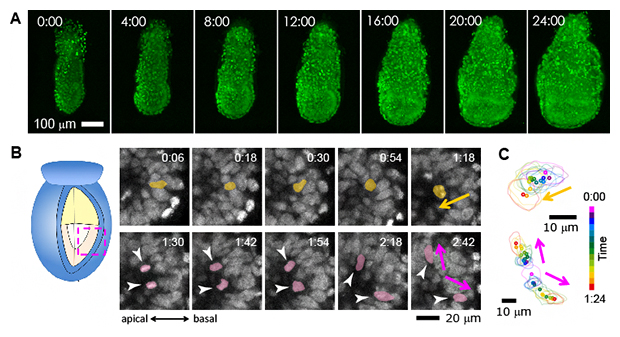
図3 マウス初期胚の受精後5.5日目からの24時間連続観察の例
A)4時間ごとの初期胚の様子。一つ一つの明るい円状の光が細胞核である。この画像では3次元的に得られたデータを2次元画像に投影しているため細胞が重なって見える。なお12時間までは胚の全細胞が追跡可能だが、それ以降は将来胎盤を形成する胚外外胚葉の一部が1細胞レベルの解像度に達していない。
B)光学切片の12分ごとのスナップショット。初期胚の外側にいた細胞(黄色)が内側へと移動し、細胞分裂を行った後、娘細胞(紫色)はそれぞれ別の方向へと移動する様子。apical:頂端側、basal:基底側。
C)Bの細胞における細胞核の形状と位置をトレース化し、細胞の挙動を可視化した例。
胚体を構成する全ての細胞を識別できるので、細胞一つ一つを胚体外胚葉、臓側内胚葉、DVEと分類し、それぞれの挙動を定量することができました(図4A)。さらに、細胞個々の局所的な挙動だけでなく、胚全体の挙動も同時に観察できることが、今回開発された顕微鏡システムの特徴です。初期胚は、盛んな細胞分裂に伴い単調に成長していくと考えられるのですが、高時間分解能で観察することにより、単調な成長の間に胚体が突然わずかに収縮する現象が発見されました(図4B)。これは、初期胚の細胞の数が減っているのではなく、初期胚全体の細胞が内部に移動することで起きていました。細胞の追跡結果から、収縮の中心は、将来胎盤を形成する胚体外胚葉に限定されていました。研究チームは、このしゃっくりのような挙動が細胞に対する機械的・化学的シグナルの非対称性を生み出し、胚内の位置に依存した細胞運命が決定づけられることで、胚の前後軸の形成につながる可能性があると仮説を立てています。仮説の証明には、実験数を増やし、さらなる詳細な解析が必要ですが、今回の研究により、これまで観察されたことのなかった細胞たちの共同作業が可視化され、前後軸形成に関する新しい知見が提供されたといえます。
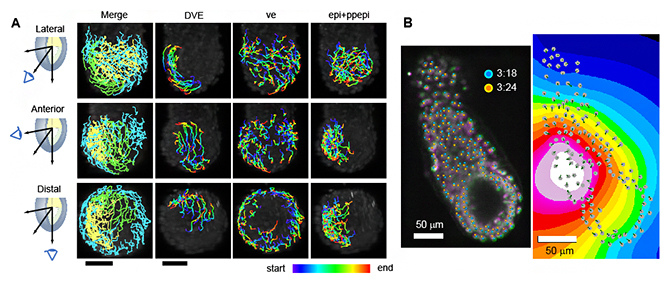
図4 受精後5.5日目からの16時間全細胞追跡結果の例
A)受精後5.5日後マウス初期胚の個々の細胞の追跡結果。左パネルは、DVEの細胞を緑、臓側内胚葉の細胞を水色、胚体外胚葉を黄色で示した図。その他のパネルは、DVE、臓側内胚葉(ve)、胚体外胚葉(epi+ppepi)の細胞を追跡し、時間経過を色で可視化した図。Lateral:外側、Anterior:前側、Distal:遠位側。
B)胚の収縮のスナップショット。左のパネルは、3:24時点(マゼンタ、経過時間204分)の胚が、3:18時点(緑、経過時間198分)の胚よりも小さいことを示す。3:18時点と3:24時点の細胞を、それぞれシアン色の円とオレンジ色の円で表した。右のパネルは、時点3:24の初期胚の収縮中心の視覚化。色は、白(最小)から黒(最大)までの 4ビットスケールでの収縮レベルを示す。灰色の円は胚の細胞の位置、緑色の線はフレーム内の細胞移動の距離を示す。
今後の期待
本研究により、マウス初期胚における受精後5.5日目からの24時間の細胞運動が初めて可視化されました。一方で、今回の開発は画像取得技術に限定されているため、一つ一つの細胞の挙動は人の手と目により解析されました。マウス初期胚における発生生物学が細胞精度へと向かい、今後、初期発生に関するさまざまな現象を発見し、それらの相互/因果関係を理解するためには、さらに多くの胚のデータを取る必要があります。研究チームは、引き続き、ディープラーニング[10]を用いて細胞を自動で検出・認識し追跡する解析技術の開発に取り組んでいます。
今回開発した顕微鏡システムは、理研内の共通機器として稼働しており、理研外の研究者らも使うことができます。より多くの人々が本システムを使用することにより、初期胚発生の全貌が明らかになると期待されます。
そこから得られる知見は、細胞と多細胞システムが織り成す多層システム形成の基盤メカニズムの理解とともに、哺乳類初期胚の生育異常メカニズムの解明や、その治療法の開発に貢献するかもしれません。
補足説明
1.マウス初期胚、胚盤胞
マウスの初期胚において最初に分化する細胞は、8~16細胞期に現れる胚の外側を覆う栄養外胚葉であり、将来、胎仔(たいじ)側の胎盤を形成する。受精後3.5日目になると胚は内腔(ないくう)を生じ、胚盤胞を形成する。受精後4.5日目に、胚盤胞内部の内部細胞塊は原始外胚葉と原始内胚葉に分化し、原始外胚葉からは胚体外胚葉が、原始内胚葉からは臓側内胚葉が形成される。
2.光シート顕微鏡
シート状にした光をサンプル側面から当てて、特定の平面を撮影する顕微鏡。サンプルをZ方向(高さ方向)に動かすことで、光学的に切片を撮影できる。
3.胚体外胚葉
胚発生期の組織。胚のほぼ全体がこの組織から出来上がる。
4.臓側内胚葉、遠位臓側内胚葉(DVE)
胚発生期の組織。胚体外胚葉に栄養供給したり、シグナルを送ったりする役割がある。遠位臓側内胚葉は臓側内胚葉の一部の細胞集団で、胚発生期に臓側内胚葉内を移動し、その近くに位置する胚体外胚葉に将来の頭部組織をつくるためのシグナルを送る。DVEはdistal visceral endodermの略。
5.左右非対称性
体や臓器の形・配置などが非対称であること。ヒトを含む哺乳類の胚は、最初は左右対称であるが、マウスでは受精後7.5日目に左右非対称性が決定される。
6.シグナル伝達カスケード
細胞が外から受けた刺激は、細胞内に存在する低分子の濃度変化や、細胞内タンパク質の連鎖的なリン酸化などを介して、最終的に遺伝子の発現制御につながる。この一連の反応をシグナル伝達カスケード(細胞内シグナル伝達)と呼ぶ。
7.緑色蛍光タンパク質(GFP)
青色の光を照射することで緑色の光を発するタンパク質。なお、青色光は細胞への毒性が強いことが知られており、長期間観察のためには青色光励起による細胞の光損傷が懸念されるGFPではなく、より長波長側の蛍光タンパク質(赤色に発光する蛍光タンパク質など)を適用する方が好ましいが、過去に報告されている観察例でも、GFPを用いるケースが圧倒的に多いことから、本研究でもGFPを選択した。GFPはgreen fluorescent proteinの略。
8.胚性幹細胞(ES細胞)
ヒトやマウスなどの胚盤胞期の内部細胞塊よりつくられる細胞。自己複製能力を持つと同時に、外胚葉、中胚葉、内胚葉のどの胚葉系にも分化できる分化多能性を持つことを特徴とする。ESはembryonic stemの略。
9.チャンバー
サンプルホルダーを設置する容器。培養するための条件を再現するために、内部の温度や湿度を維持することができる。
10.ディープラーニング
コンピュータが大量のデータを学習して、データ内から特徴を見いだす技術。人が指定した特徴を見いだすだけでなく、人が気付かない特徴を見いだすこともあり、広く研究に使われている。
研究チーム
理化学研究所 生命機能科学研究センター
先端バイオイメージング研究チーム
チームリーダー 渡邉朋信(ワタナベ・トモノブ)
(広島大学 原爆放射線医科学研究所 教授)
技師 塩井 剛(シオイ・ゴウ)
技師(研究当時)金城 純一(カネシロ・ジュンイチ)
発生動態研究チーム
チームリーダー 大浪 修一(オオナミ・シュウイチ)
研究員(研究当時)東 裕介(アズマ・ユウスケ)
(現 最先端研究プラットフォーム連携(TRIP)事業本部 研究DX基盤開発チーム 専門技術員)
研究支援
本研究は、主に、理化学研究所生命機能科学研究センターのセンタープロジェクト「次世代SPIM開発プロジェクト(交付金)」により実施され、一部は平成30年度~令和4年度文部科学省(MEXT)科学研究費助成事業新学術領域研究(研究領域提案型)「シンギュラリティ生物学(研究代表者:永井健治)」の助成を受けて実施されました。
原論文情報
Go Shioi, Tomonobu M Watanabe, Junichi Kaneshiro, Yusuke Azuma, Shuichi Onami, “Trans-scale live-imaging of an E5.5 mouse embryo using incubator-type biaxial light-sheet microscopy”, Life Science Alliance, 10.26508/lsa.202402839
発表者
理化学研究所
生命機能科学研究センター 先端バイオイメージング研究チーム
チームリーダー 渡邉 朋信(ワタナベ・トモノブ)
技師 塩井 剛(シオイ・ゴウ)
発生動態研究チーム
チームリーダー 大浪 修一(オオナミ・シュウイチ)
研究員(研究当時)東 裕介(アズマ・ユウスケ)
報道担当
理化学研究所 広報室 報道担当