2024-01-15 産業技術総合研究所
ポイント
- ドロップレット技術で、1回の実験で1万個の細胞の1細胞ごとの糖鎖とRNAの情報を取得
- さまざまな細胞の糖鎖プロファイルを網羅的に同定
- 病気の原因解明や、新しい医薬品や予防法の開発に貢献
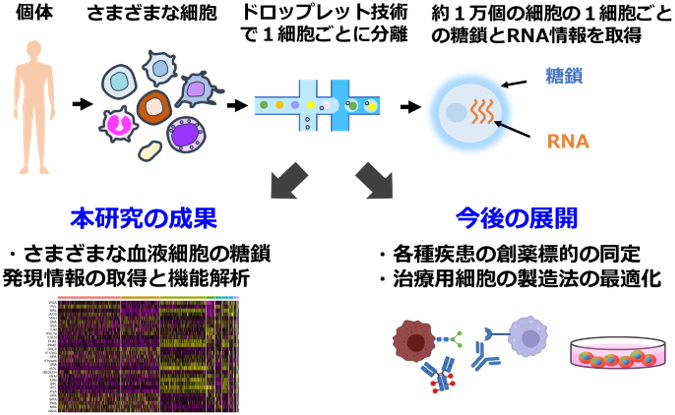
本研究で得られた成果と今後の展開
概要
国立研究開発法人 産業技術総合研究所(以下「産総研」という)細胞分子工学研究部門 多細胞システム制御研究グループ 舘野浩章 研究グループ長と、筑波大学大学院ヒューマンバイオロジー学位プログラム(博士)大学院生 Sunanda Keishamさんは、組織などから分離した約1万個の細胞の1個1個に発現する糖鎖とRNAを次世代シーケンサーで一斉解析するドロップレット型1細胞糖鎖・RNAシーケンス法(ドロップレット型scGR-seq法)を開発しました。
細胞表面の糖鎖はさまざまな疾患の創薬標的や再生医療用の細胞の品質管理に利用されています。以前われわれは、DNAバーコードを標識したレクチン(糖結合タンパク質)を複数、細胞に反応させ、1細胞ごとに微量遠心管に分離した後、次世代シーケンサーで細胞外の糖鎖と、細胞内のRNAの発現情報を1細胞ごとに取得する技術を開発しました。しかし従来の微量遠心管に1細胞を分注するプレート型の方法では、一度の実験で解析できる細胞数は数百個程度が限界でした。本成果では、ドロップレット技術を導入することで、約1万個の細胞を1回の実験で解析できるようになり、従来法と比較して処理できる細胞数が100倍程度向上しました。異なる細胞型間の違いや、同じ細胞型内における細胞表面糖鎖の多様性をより包括的に解析できるようになるとともに、少数しか含まれないような希少な細胞の情報も迅速に取得できるようになりました。
なお、この技術の詳細は、2024年1月2日に「Small Methods」にオンライン掲載されました。
開発の社会的背景
近年、がんやアルツハイマー病、生活習慣病などの病態解明や新たな医薬品の開発、さらには予防法の開発のために、これら疾患の原因となる細胞に発現する全ての生体分子の情報(オミクス情報)を取得する技術の開発が注目されています。特に健康長寿社会の実現に求められる新たな医療技術の開発のために、従来の細胞集団(バルク)単位での情報取得ではなく、1細胞ごとのオミクス情報を取得することが必要です。それにより病気の発症メカニズムをより正確に理解するとともに、多細胞間の相互作用や、組織中に少数しか存在しないような病態細胞を標的とするような、これまでにない新たな医療技術を開発することが期待できます。1細胞ごとのRNAの発現を解析する技術(scRNA-seq法)は、基礎研究のみならず新たな医薬品の開発に世界中で広く利用されています。
しかし従来型のscRNA-seq法では細胞内のRNA発現のみを解析可能であり、細胞表面に局在する生体分子である糖鎖の情報を直接解析することができませんでした。糖鎖は多様性が大きく分岐構造があるなどの理由から、その解析には多大な時間と労力が必要とされ、多くの試料を迅速に解析することが困難でした。そのため糖鎖の創薬やヘルスケアへの利用が十分ではありませんでした。
研究の経緯
これまで産総研では長年にわたって糖鎖を解析する技術の開発に取り組んできました(2011年6月22日 産総研プレス発表)。そして幹細胞やがん細胞などに発現する糖鎖を解析することにより、幹細胞の品質管理技術の開発や医薬品候補の開発を続けてきました(2013年3月19日、2014年2月17日、2015年4月10日、2017年9月26日 産総研プレス発表)。
産総研は健康社会を支える基盤技術の開発において、新たな糖鎖解析技術の開発を目指しており、最近、DNAバーコード標識レクチンと次世代シーケンサーを用いて、1細胞ごとに発現する糖鎖とRNAの発現を同時にプロファイリングする技術(scGR-seq法)を開発しました(2021年7月27日 産総研プレス発表)。しかし従来のscGR-seq法は一度に解析できる細胞数が数百個程度と、組織を構成するごく一部の細胞しか解析できないという課題がありました。そのため組織を構成するさまざまな細胞型を網羅的に解析することができませんでした。今回、scGR-seq法にドロップレット技術を導入したドロップレット型scGR-seq法を開発しました。これにより処理細胞数を100倍程度(約1万個)に向上することに成功しました。なお、本研究開発は国立研究開発法人 科学技術振興機構の「戦略的創造研究推進事業(さきがけ)統合1細胞解析のための革新的技術基盤」(2016~2019年度)、「研究成果最適展開支援プログラム(A-STEP)産学共同(育成型)」(2020~2022年度)、独立行政法人 日本学術振興会 科学研究費助成事業「基盤研究(B)」「学術変革領域研究(B)」(2023年度~)による支援を受けています。
研究の内容
今回、ドロップレット技術を導入したscGR-seq法を考案し、1細胞ごとの糖鎖とRNAの発現データ、約1万個分を1回の実験で取得するドロップレット型scGR-seq法の開発に至りました。図1に実験の流れを示します。さまざまな糖結合特異性を有する30種のレクチンを選抜し、それぞれに固有の短い塩基配列の目印(DNAバーコード)を結合させたDNAバーコード標識レクチンを作製しました。そしてドロップレット技術を用いて、マイクロ流路により1個のエマルジョンに1個の細胞と1個のビーズを封入しました。ビーズには異なるDNAバーコードが細胞の目印(細胞タグ)として含まれており、それぞれの細胞で得られる情報を識別できるようにしてあります。細胞タグには、レクチンに修飾されているDNAバーコードとmRNAに結合する塩基配列が含まれています。細胞タグが結合したDNAバーコードとmRNAの情報をPCR(ポリメラーゼ連鎖反応)で増幅することで、1個の細胞に結合したレクチンの種類と相対分子数、およびmRNAを次世代シーケンサーで解析しました。これにより1細胞ごとの糖鎖と遺伝子の発現情報を同時に取得しました。
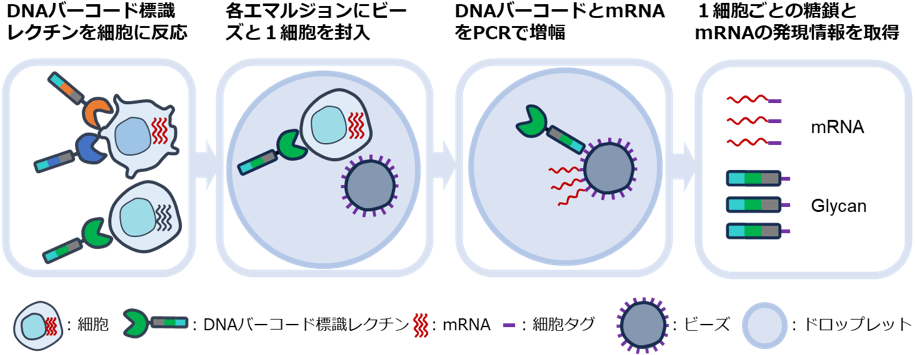
図1 ドロップレット型1細胞糖鎖・RNAシーケンス法(scGR-seq法)の流れ
※原論文の図を引用・改変したものを使用しています。
本技術を用いてヒト血液中の末梢血単核細胞、約1万個の1細胞ごとの糖鎖とRNAの発現を解析しました。得られた1細胞ごとの糖鎖とRNAの統合データ(最終的に約8000細胞分のデータ)を用いてUMAP(Uniform Manifold Approximation and Projection)と呼ばれる統計解析手法を用いて細胞を分類した結果、リンパ球系と骨髄系で二つの大きなクラスターに分類されることがわかりました(図2A)。すなわち、リンパ球系と骨髄系で大きく糖鎖とRNAの発現が異なっていることを示しています。さらに糖鎖とRNAの二つのオミクス情報を用いることで、T細胞(CD4+T、CD8+T)、メモリーB細胞、単球(古典的、中間、非古典的)、樹状細胞(DC、pDC)、血小板など、細胞型ごとに細胞を明確に分類できました(図2A)。糖鎖の情報を加えることにより、RNA情報だけでは同定できなかった、血液中にわずかしか含まれない希少な細胞であるpDC(形質細胞様樹状細胞)を識別することができました。
1細胞ごとの糖鎖プロファイル(レクチンの反応パターン)を図2Bに示します。糖鎖プロファイルは、細胞型ごとに異なっていることがわかりました。すなわち、それぞれの細胞型は異なる糖鎖を発現していることを示しています。さらに同じ細胞型内でも、1細胞ごとに糖鎖プロファイルの多様性があることがわかりました。
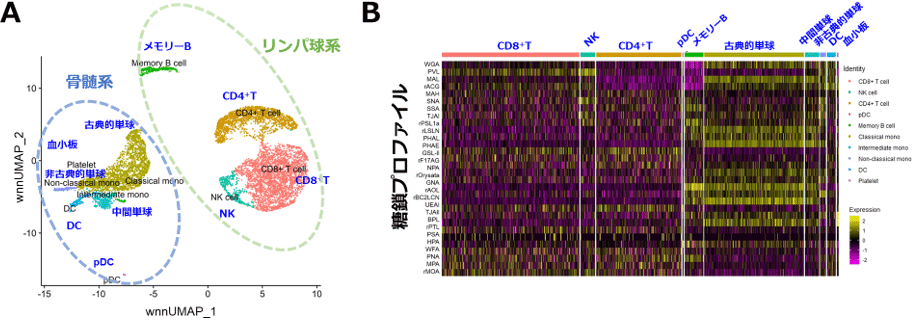
図2 末梢血単核細胞の解析
A:糖鎖とRNAの統合データによる細胞の分類。wnnUMAP_1、wnnUMAP_2:各データセットの主成分を2次元に次元圧縮した際の直交成分。
B:1細胞ごとの糖鎖プロファイルのヒートマップ図。黄:強い反応性、黒:中間の反応性、紫:弱い反応性。
※原論文の図を引用・改変したものを使用しています。
次に、それぞれの細胞型に特異的に反応するレクチンを探索しました(図3A)。TJAIIと呼ばれるα1,2フコース特異的レクチンは、他の細胞型と比べて血小板に強く反応しました。細胞を解析するための一般的な手法であるフローサイトメトリー法でも同様の結果が得られました。TJAIIが血小板上のどのような糖タンパク質に反応しているのかについて調べたところ、GPIbαという血小板特異的な糖タンパク質に強く反応することがわかりました。GPIbαは障害を受けた血管壁に集積したフォンビルブランド因子(vWF)と結合することで血液凝固を引き起こすことが知られています。血小板上のα1,2フコースをフコシダーゼと呼ばれる糖加水分解酵素で除去すると、vWFへの反応性(蛍光強度)が高い血小板の割合が13.2%から20.3%に増加しました(図3B)。すなわち血小板上のα1,2フコースは血液凝固において重要な役割をもつことが示唆されました。
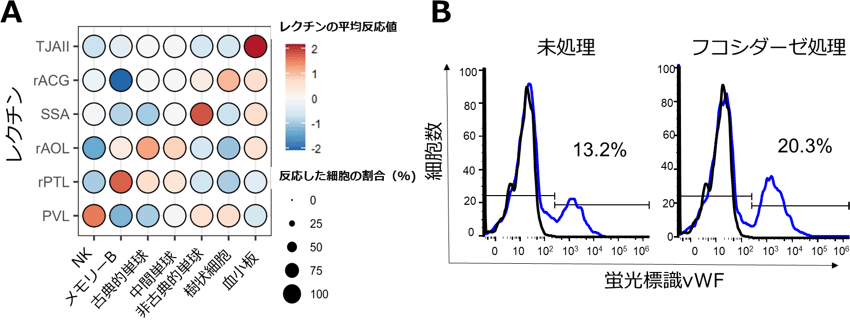
図3 細胞型ごとに特異的に反応するレクチンの同定と機能解析
A:各細胞型に強く反応するレクチンの同定。赤:強い反応性、白:中間の反応性、青:弱い反応性。
B:フコシダーゼ処理、未処理の血小板へのvWFの反応性。黒線:コントロール抗体の反応性、青線:vWF抗体の反応性
※原論文の図を引用・改変したものを使用しています。
このように今回開発したドロップレット型scGR-seq法を用いることで、個々の細胞の糖鎖と遺伝子の発現情報について、約1万個分を一挙に取得できるようになりました。そして、血液に含まれるさまざまな細胞型ごとの糖鎖プロファイルを取得するだけでなく、細胞型ごとに発現する特徴的な糖鎖を明らかにしました。
今後の予定
今後はドロップレット型scGR-seq法を社会実装することにより、技術の普及化を実現します。さらに本技術の医療やヘルスケアへの応用を実施します。例えば病態組織を解析することで、病態細胞などの創薬標的を同定します。また年齢の異なる正常組織を解析することで、老化や病気の進行度の可視化や未然に防ぐ技術の開発に展開します。さらに再生医療用細胞を解析することで、細胞の規格設定や評価法の開発、そして治療効果の高い再生医療用細胞の培養技術の開発を目指します。
論文情報
掲載誌:Small Methods
論文タイトル:Droplet-based glycan and RNA sequencing for profiling the distinct cellular glyco-states in single cells
著者:Sunanda Keisham, Sayoko Saito, Satori Kowashi, Hiroaki Tateno
DOI:https://doi.org/10.1002/smtd.202301338
関連特許
発明の名称:「糖鎖を解析する方法」
国際出願番号:PCT/JP2021/010385
出願日:2021年3月15日
用語解説
- 糖鎖
- ブドウ糖などの単糖がつながった生体分子の一種。すべての細胞表層に存在し、細胞間相互作用を媒介することで多様な生命現象に関与している。細胞の形質による構造が異なることから細胞の同定や選別のための目印として利用されている。
- 次世代シーケンサー
- 数千万から数億個の比較的短いDNAを、大規模かつ高速に塩基配列決定することができる装置。生命医科学分野で広く利用されているだけでなく、個別化医療などへの応用が進んでいる。
- ドロップレット
- 油中に形成されるマイクロメートルスケールの微小な水滴を指し、内部に細胞を封入することができる。ドロップレットを利用すると、短時間で大量の細胞を1細胞ごとに分離することが可能。
- scGR-seq
- Single-cell glycan and RNA sequencingの略。個々の細胞に発現する糖鎖とRNAの発現を次世代シーケンサーで網羅的に同時解析する技術。ドロップレット型scGR-seq法ではドロップレット技術を用いることで1万個の細胞を1回の実験で解析することができる。
- DNAバーコード
- 固有の短い塩基配列のこと。抗体やレクチンに目印として結合させて細胞に反応させ、DNAシーケンサーで解析することで、細胞に結合した抗体やレクチンの種類や量を間接的に解析することができる。また今回の実験では細胞を識別するための細胞タグ(目印)としても利用している。
- レクチン
- 糖鎖に結合するタンパク質の総称であり、すべての生物に存在する。さまざまな糖鎖に特異的に結合するレクチンが存在し、細胞内外において多様な機能を媒介している。レクチンは糖鎖を検出する試薬としても用いられている。
- scRNA-seq
- Single-cell RNA sequencingの略。1細胞ごとのRNAの発現情報を次世代シーケンサーで解析する技術。1細胞ごとに微量遠心管に分注して解析するプレート型と、ドロップレット技術で1細胞ごとに分離して解析するドロップレット型の大きく2種類の方法が開発されている。
- UMAP
- Uniform Manifold Approximation and Projectionの略。主成分分析で得られた主成分をさらに圧縮することで細胞の分類を可視化するための新しい次元圧縮法。
- TJAII
- Trichosanthes japonica Agglutinin IIの略。キカラスウリの球根から分離精製されたレクチンのことであり、Fucα1-2Galβ1-3/4GlcNAc(Hタイプ1/2)という糖鎖構造に特異的に反応することから、この糖鎖構造を検出するための試薬として用いられている。
- フローサイトメトリー
- 個々の細胞の光散乱や、発する蛍光をさまざまな波長で計測する技術のこと。細胞に発現するタンパク質や糖鎖の量を蛍光標識した抗体やレクチンを用いて測定することができる。
- GPIbα
- Glycoprotein Ibαの略。血小板上に発現する高度に糖鎖修飾された約135 kDaの大きさの糖タンパク質であり、損傷した血管壁に結合したフォンビルブランド因子(vWF)に結合し、血小板血栓を誘導する機能をもつ。
- vWF
- von Willebrand factorの略。血液凝固因子の一種で、約 260 kDaのタンパク質が多量体となった巨大な糖タンパク質。血管が傷つき出血したときに、vWFは傷ついた血管内皮の下に存在するコラーゲンに結合する。結合したvWFに血小板が接着し、血小板血栓を形成する機能をもつ。
お問い合わせ
産業技術総合研究所