EPFLの研究者たちは、生物学とロボット工学を融合させ、マイクロメートル単位の高精度の解剖を可能にするロボットマイクロサージェリープラットフォームを構築し、胚発生の過程で脊椎動物の体がどのように形成されるかの理解を進めました。 Combining biology and robotics, scientists at EPFL have built a robotic microsurgery platform that can perform high-precision, micrometer-resolution dissections to advance our understanding of how the vertebrate body forms during embryonic development.
2023-01-09 スイス連邦工科大学ローザンヌ校(EPFL)
EPFL生命科学部のアンディ・オーツは、「発生学における本来の実験手法は、マイクロサージェリーです」と言う。「しかし、かつては非常に単純な顕微鏡と、サボテンの棘や研いだ針金のような非常に単純な道具を使って行われていたのです。もうひとつの問題は、私たちは生まれつき手が震えているため、人によってはマイクロサージェリーが難しいということです。何年も訓練が必要で、一部の人しかできないので、処理能力が非常に低いのです。”
ロボット工学と生物学の融合
マイクロサージェリー技術の限界を克服するため、オーツはマイクロテクノロジーと小型ロボットの専門家である工学部のセルマン・サカー教授と手を組みました。
Nature Communications』誌に発表されたこの新しいプラットフォームの役割について、研究者らは「ロボット支援型組織マイクロマニピュレーション」と説明している。このプラットフォームは、コンパクト(200 x 100 x 70 mm3)、高解像度(4 nmの位置と25 μ°の回転)、器用であり、いくつかの自由度を備えている。このツールは、人手を介さずに自動的に位置決めを行い、高い再現性で安定させることができる。研究者らは、このプラットフォームを使用して、ゼブラフィッシュ胚の体軸伸長を研究し、その能力を検証した。
この研究により、胚のノトコルドは、幼生が泳ぎ始めるときに初期の「背骨」として機能する驚くべき挙動が明らかになった。
<関連情報>
- https://actu.epfl.ch/news/a-robotic-microsurgeon-reveals-how-embryos-grow/
- https://www.nature.com/articles/s41467-022-35632-4
ロボット支援組織マイクロマニピュレーションを用いたゼブラフィッシュ胚の体軸形態形成の再構築 Deconstructing body axis morphogenesis in zebrafish embryos using robot-assisted tissue micromanipulation
Ece Özelçi,Erik Mailand,Matthias Rüegg,Andrew C. Oates & Mahmut Selman Sakar
Nature Communications Published:24 December 2022
DOI:https://doi.org/10.1038/s41467-022-35632-4
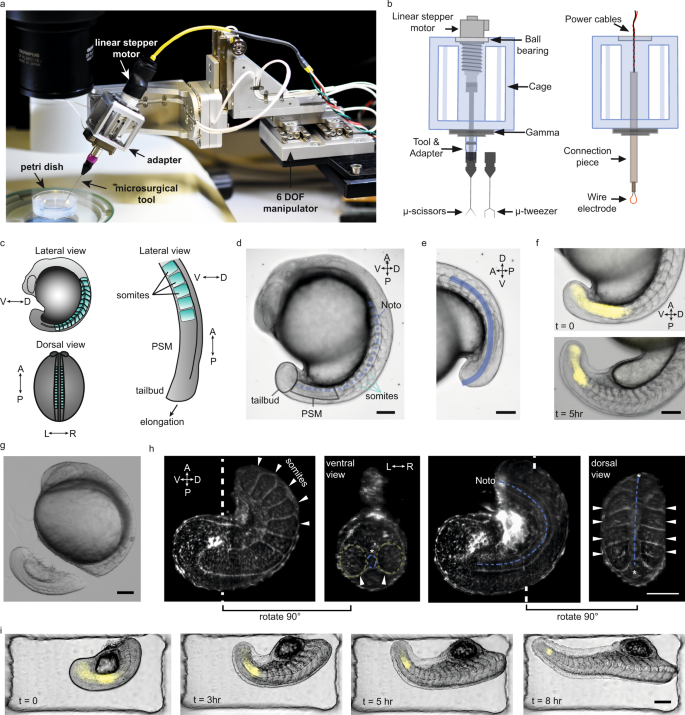
Abstract
Classic microsurgical techniques, such as those used in the early 1900s by Mangold and Spemann, have been instrumental in advancing our understanding of embryonic development. However, these techniques are highly specialized, leading to issues of inter-operator variability. Here we introduce a user-friendly robotic microsurgery platform that allows precise mechanical manipulation of soft tissues in zebrafish embryos. Using our platform, we reproducibly targeted precise regions of tail explants, and quantified the response in real-time by following notochord and presomitic mesoderm (PSM) morphogenesis and segmentation clock dynamics during vertebrate anteroposterior axis elongation. We find an extension force generated through the posterior notochord that is strong enough to buckle the structure. Our data suggest that this force generates a unidirectional notochord extension towards the tailbud because PSM tissue around the posterior notochord does not let it slide anteriorly. These results complement existing biomechanical models of axis elongation, revealing a critical coupling between the posterior notochord, the tailbud, and the PSM, and show that somite patterning is robust against structural perturbations.


