2025-02-14 国立がん研究センター
発表のポイント
- 自然免疫応答の活性化を促す薬剤は、免疫チェックポイント阻害薬の治療抵抗性の克服に有用である可能性が期待されていますが、臨床応用には至っていません。
- 本研究では、自然免疫応答を活性化する薬剤の1つであるOK-432を担がんモデルマウスへ投与する実験によって、多形核骨髄由来免疫抑制細胞ががん組織の内部へ集まり、治療抵抗性を示す機序を明らかにしました。
- さらに、がん免疫療法の治療効果を左右することが分かっている炎症性がん、非炎症性がんを多種類のマウスモデルで再現し、どのタイプのがんで抵抗機序が作動するのかを明らかにし、臨床応用に向けたバイオマーカーの同定につなげました。
- 本研究成果により、がん免疫療法においてOK-432のような自然免疫応答を活性化する薬剤を併用する際には、多形核骨髄由来免疫抑制細胞を除去する薬剤を併せて用いることで治療効果を高められる可能性が示されました。
- 今後、自然免疫応答を活性化する薬剤の最適化法を明らかにし、さらに研究を進めることにより、新規がん免疫併用療法の開発への展開が期待できます。
概要
国立研究開発法人国立がん研究センター(東京都中央区、理事長:中釜 斉)研究所(所長:間野 博行)腫瘍免疫研究分野を中心とする研究チームは、免疫チェックポイント阻害薬と自然免疫応答注1を活性化させる薬剤を併用してがん治療を行う際には、免疫抑制細胞の活性化を防ぐことで、治療抵抗性を克服し、有用性が期待できることを担がんモデルマウスで確認しました。
免疫チェックポイント阻害薬による治療は多くのがん種に対する標準治療として臨床応用されていますが、効果が期待できる患者さんは、がん組織にCD8陽性T細胞(キラーT細胞)注2等が多数存在する患者さんに限定されています。CD8陽性T細胞は、自然免疫応答を刺激する薬剤OK-432注3などにより活性化する可能性があり、本研究では、免疫チェックポイント阻害薬PD-1抗体注4とOK-432の併用によりがんが縮小する結果を得られるどうかを検討しました。
その結果、免疫チェックポイント阻害薬PD-1抗体とOK-432を併用する場合は、免疫抑制細胞の活性化を防ぐ多形核骨髄由来免疫抑制細胞注5の阻害剤を用いて3剤を併用することにより、治療抵抗性を克服できる可能性が示されました。
本研究は、国立研究開発法人国立がん研究センター研究所 腫瘍免疫研究分野 西中村 瞳研究員、 西川 博嘉分野長(名古屋大学大学院医学系研究科 微生物・免疫学講座 分子細胞免疫学教授、京都大学大学院医学研究科附属がん免疫総合研究センターがん免疫多細胞システム制御部門教授を兼務)の研究チームで実施し、本成果は、米国科学雑誌「Science Translational Medicine」に日本時間2025年2月13日に掲載されました。
背景
免疫チェックポイント阻害薬によるがん免疫療法は様々ながんの治療に用いられるようになりました。しかしながら、免疫チェックポイント阻害薬の治療を受けたがん患者さんの半数以上は他の薬剤との併用療法であっても治療効果が認められず、また初めは治療が奏効したとしても徐々に治療抵抗性を示すこともあります。その理由はがん免疫編集仮説注6に基づいて以下のように説明されています。臨床的ながんでは、免疫系からの攻撃を受けにくい非免疫原性のがん細胞が選択され(免疫選択)、様々な抑制機構によってがん細胞が免疫系から逃れ(免疫逃避)、がんが進展します。免疫選択と免疫逃避のバランスは、患者さんごとに異なり、がん組織内の環境の違い(炎症性がん注7または非炎症性がん注8)につながります。炎症性がんでは、活性化したCD8陽性T細胞が存在し、免疫チェックポイント阻害薬の効果が認められますが、非炎症性がんは、CD8陽性T細胞が少なく免疫チェックポイント阻害薬の治療が効きにくいことが分かってきています。したがって、免疫チェックポイント阻害薬の治療の効果を高めるために、がん組織の環境を炎症性へと変化させることが必要で、様々な試みが検討されてきました。その方法の1つとして、自然免疫応答を刺激するToll様受容体(Toll-like Receptor: TLR)注9に対する薬剤OK-432用いて樹状細胞注10などの抗原提示細胞の活性化(=自然免疫応答の活性化)を促す方法が挙げられます。活性化した樹状細胞がCD8陽性T細胞の活性化(=獲得免疫応答注11を活性化)を促し、がん細胞を直接殺傷する可能性があるからです。しかしながら、これまでに自然免疫応答の活性化を促す薬剤と免疫チェックポイント阻害薬との併用療法は臨床試験で検討されていますが、確立していません。
研究成果
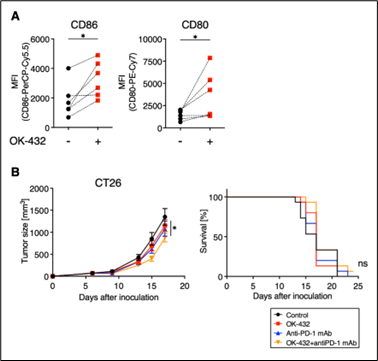
最初に、OK-432が自然免疫応答で重要な役割を果たす樹状細胞を活性化できるかどうかを調べました。消化器がんの患者さんの末梢血単核球細胞から樹状細胞を分化・誘導させて使用しました。OK-432を添加することで細胞表面に発現する活性化のマーカーがどのように変化するのかをフローサイトメトリー注12によって解析した結果、OK-432を添加後にCD86, CD80注13の発現がコントロールに比べて上昇したことから、OK-432は樹状細胞を活性化させる、つまり自然免疫応答を活性化させることが分かりました(図1-A参照)。そこで、マウス大腸がん細胞株CT26を皮下に生着させたモデルマウスを使用して、OK-432投与、抗PD-1抗体投与、OK-432と抗PD-1抗体の投与を行ってがんの増殖やマウスの生存に影響があるかどうかを調べました。OK-432の投与によってがんが縮小することを期待していましたが、結果はその逆で、OK-432投与、抗PD-1抗体投与、OK-432と抗PD-1抗体投与の全てにおいて、生着させたがんの大きさは無治療群に比べてあまり小さくならず、マウスが長期生存することもありませんでした(図1-B参照)。以上の結果より、OK-432を投与することによってがん組織内の自然免疫応答を活性化させて、がん免疫治療の効果を増強することは難しく、抵抗性を示すことが分かりました。
図1 OK-432による共刺激分子の活性化とがん免疫治療に対する抵抗性
(A) 樹状細胞にOK-432を添加した後、共刺激分子であるCD86, CD80の発現が上昇しました。
(B) OK-432を単独もしくは抗PD-1抗体と併用した場合、担がんマウスの腫瘍増殖曲線と生存率は無治療群と比較して大きな変化は認められませんでした。
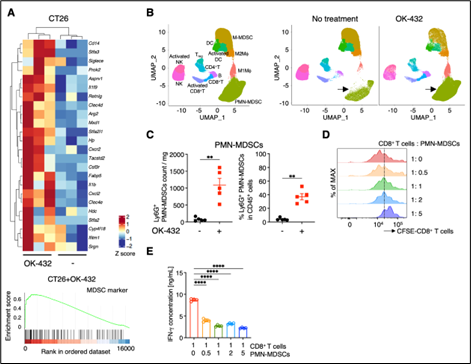
そこで、OK-432投与の効果が認められなかった理由を明らかにするため、OK-432投与後にがん組織内でどのような変化が起こっているのかをRNAシーケンス注14によって調べました。その結果、マウスの腫瘍内へOK-432を投与した場合には骨髄由来抑制細胞(Myeloid-derived suppressor cells: MDSCs)注15に特徴的な遺伝子の発現が有意に上昇していることが明らかになりました(図2-A参照)。さらにマスサイトメトリー注16による解析、フローサイトメトリーによる解析を行ったところ、OK-432投与後にLy6G陽性多形核骨髄由来免疫抑制細胞(PMN-MDSCs)が有意に増加していました(図2-B,C参照)。そこで、がん組織内で増加したLy6G陽性多形核骨髄由来免疫抑制細胞(PMN-MDSCs)が細胞傷害性CD8陽性T細胞に与える影響を調べるため、両者を試験管内で一緒に培養した結果、Ly6G陽性多形核骨髄由来免疫抑制細胞(PMN-MDSCs)はCD8陽性T細胞の増殖を強く抑制し、がん細胞の殺傷に重要なIFN-g注17の産生を低下させることも明らかになりました(図2-D,E参照)。
図2 マウスの腫瘍内にOK-432を投与した後にがん組織内で生じる免疫細胞の変化
(A) RNAシーケンスの結果、MDSC関連遺伝子群の発現が上昇しました。
(B) マスサイトメトリーの結果、矢印で示した多形核骨髄由来免疫抑制細胞(PMN-MDSCs)が大きく増えました(黄緑色部分)。
(C) フローサイトメトリーの結果、OK-432投与後には多形核骨髄由来免疫抑制細胞(PMN-MDSCs)の数と割合が増加しました。
(D) 多形核骨髄由来免疫抑制細胞(PMN-MDSCs)とCD8陽性T細胞の共培養実験の結果、CD8陽性T細胞の増殖が抑制されました。
(E) (D)の実験においてIFN-gの産生も抑制されました。
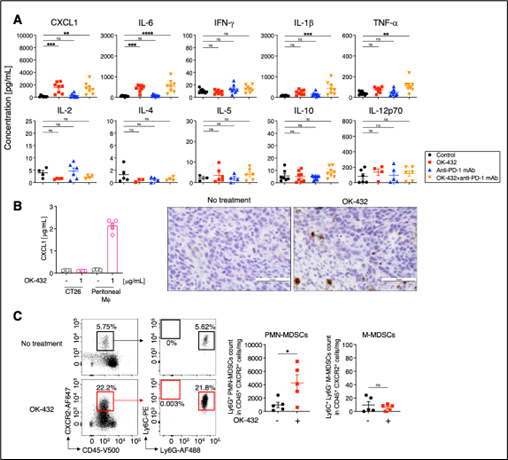
さらに、OK-432の投与によってがん組織内で多形核骨髄由来免疫抑制細胞(PMN-MDSCs)が増加したメカニズムを調べました。一般的に免疫細胞の機能や活性はサイトカイン注18やケモカイン注19によって強い影響を受けることから、OK-432投与後に増加するサイトカインやケモカインCXCL1, IFN-g, IL-6, IL-1b, TNF-a, IL-5, IL-2, IL-4, IL-10, IL-12p70の発現を測定しました。その結果、CXCL1の発現が有意に上昇していることが明らかになりました(図3-A参照)。 試験管内でのOK-432添加実験や組織染色の結果から、CXCL1を産生する細胞はがん細胞ではなく、マクロファージ注20であることが明らかになりました(図3-B参照)。さらに、CXCL1の受容体であるCXCR2が発現している細胞集団はLy6G陽性多形核骨髄由来免疫抑制細胞(PMN-MDSCs)が高い割合を占めていたことから(図3-C参照)、がん組織内に放出されたCXCL1によってCXCR2を発現する多形核骨髄由来免疫抑制細胞(PMN- MDSCs)が引き寄せられたと考えられます。
図3 マウスの腫瘍内へOK-432を投与した後にがん組織内で多形核骨髄由来免疫抑制細胞(PMN-MDSCs)が増えた作用機序
(A) OK-432投与後にケモカインCXCL1が増加していました。
(B) OK-432投与によりマクロファージからCXCL1が産生されました。
(C) フローサイトメトリーによる解析の結果、OK-432投与後のCXCR2陽性細胞集団にはLy6G陽性細胞(多形核骨髄由来免疫抑制細胞)が多く含まれていました。
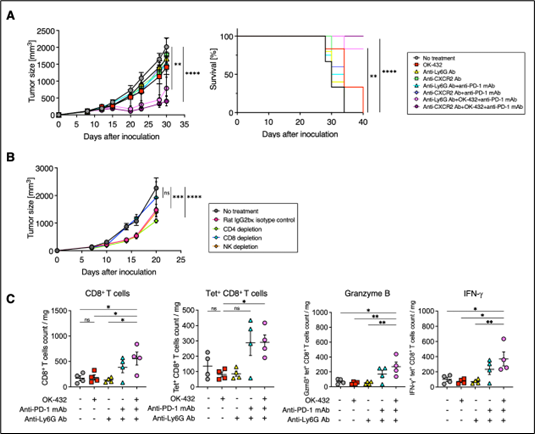
最後に、OK-432投与、多形核骨髄由来免疫抑制細胞(PMN-MDSCs)の除去(抗Ly6G抗体投与もしくは抗CXCR2抗体投与)、抗PD-1抗体投与の検討を行いました。その結果、無治療群や2剤治療群に比べ、3剤併用群では有意にがんが縮小し、生存率が高いことが分かりました(図4-A参照)。また、3剤併用治療群において、CD8陽性T細胞を除去した場合にがんが縮小しなかったことから、CD8陽性T細胞の働きが重要であることが示唆されました(図4-B参照)。がん組織内に浸潤したCD8陽性T細胞をフローサイトメトリーによって解析したところ、3剤併用治療の群ではCD8陽性T細胞およびがん抗原特異的なCD8陽性T細胞が増加していて、がん細胞を殺傷する際に重要なグランザイムB注21やIFN-gの産生も上昇していました(図4-C参照)。以上の結果より、OK-432の投与によって増加した多形核骨髄由来免疫抑制細胞(PMN-MDSCs)を除去する薬剤を使用するとCD8陽性T細胞の数が増え、機能が良くなり、がんを縮小することが明らかになりました。
図4 OK-432の投与、多形核骨髄由来免疫抑制細胞(PMN-MDSCs)の除去、抗PD-1抗体の投与の3剤併用治療の効果
(A) 3剤併用治療を行った群(ピンク色と紫色)ではがんが縮小し、長期生存が認められました。
(B) がんが縮小した3剤併用治療群からCD8陽性T細胞除去を行った群(水色)では治療効果が失われたことから、CD8陽性T細胞が重要な役割を果たしていることが分かりました。
(C) それぞれの治療群のがん組織内の免疫細胞の数を調べた結果、3剤併用治療群ではCD8陽性T細胞、がん抗原特異的なCD8陽性T細胞、グランザイムB及びIFN-gを発現するCD8陽性T細胞が増加していました(ピンク色)。
展望
OK-432を投与することによってがん組織内で非常に多くの数の多形核骨髄由来免疫抑制細胞(PMN-MDSCs)が検出され、これは治療によって獲得した抵抗性の原因であることが明らかになり、抗PD-1抗体投与との併用治療の効果の妨げになっていることを発見しました。この現象はがん組織内で働く多形核骨髄由来免疫抑制細胞(PMN-MDSCs)の多彩な抑制作用の1つであると考えられます。樹状細胞などの自然免疫応答に関与する細胞を活性化する試みは免疫を抑制する働きの望ましくない活性化を伴う可能性があります。したがって、自然免疫応答を活性化させる薬剤と抗PD-1抗体との併用療法には、多形核骨髄由来免疫抑制細胞(PMN-MDSCs)などの不必要な活性化を制御する治療を追加することが重要となります。このような併用療法の研究・開発はがん免疫治療の拡大に繋がり、将来的にはヒトでのがん免疫治療への応用が期待されます。
発表論文
雑誌名
Science Translational Medicine
タイトル
Coactivation of innate immune suppressive cells induces acquired resistance against combined TLR agonism and PD-1 blockade
著者
Hitomi Nishinakamura1,†, Sayoko Shinya1,2,†, Takuma Irie1, Shugo. Sakihama3,Takeo Naito1, Keisuke Watanabe1, Daisuke Sugiyama4, Motohiro Tamiya5, Tatsuya Yoshida6, Tetsunari Hase7, Takao Yoshida2, Kennosuke Karube8, Shohei Koyama1,9, and Hiroyoshi Nishikawa1,4,10*
所属
1Division of Cancer Immunology, Research Institute/Exploratory Oncology Research & Clinical. Trial Center (EPOC), National Cancer Center Japan, Tokyo 104-0045/Chiba 277-8577, Japan,
2Discovery and Research, Ono Pharmaceutical Co., Ltd., Osaka, 618-8585, Japan,
3Laboratory of Hemato-Immunology, Graduate School of Health Sciences, University of the Ryukyus, Nishihara, 903-0125, Japan,
4Department of Immunology, Nagoya University Graduate School of Medicine, Nagoya 466-8550, Japan.
5Respiratory Medicine, Osaka International Cancer Institute, Osaka 541-8567, Japan,
6Department of Thoracic Oncology, National Cancer Center Hospital, Tokyo 104-0045, Japan,
7Department of Respiratory Medicine, Nagoya University Graduate School of Medicine, Nagoya 466-8550, Japan.
8Department of Pathology and Laboratory Medicine, Nagoya University Graduate School of Medicine, Nagoya 466-8550, Japan.
9Department of Respiratory Medicine and Clinical Immunology, Osaka University Graduate School of Medicine, Suita, 565-0871, Japan
10Division of Cancer Immune Multicellular System Regulation, Center for Cancer Immunotherapy and Immunobiology (CCII), Graduate School of Medicine, Kyoto University, Kyoto 606-8501, Japan.
†These authors contributed equally to this study.
掲載日
2025年2月12日付
DOI
10.1126/scitranslmed.adk3160
URL
https://www.science.org/doi/10.1126/scitranslmed.adk3160(外部サイトにリンクします)
研究費
国立研究開発法人日本医療研究開発機構(AMED)
- ムーンショット目標7 日米連携による「がんゼロ社会」に向けた研究開発 慢性炎症の制御によるがん発症ゼロ社会の実現
- 次世代がん医療創生研究事業「がん細胞および免疫応答解析に基づくがん免疫療法効果予測診断法の確立」
- 次世代治療・診断実現のための創薬基盤技術開発事業「患者層別化マーカー探索技術の開発/がん免疫モニタリングによる患者層別化を行う基盤技術の開発」
- 革新的先端研究開発支援事業「腸内細菌叢のがん免疫応答への関わりの解明によるがん治療への展開」
- 次世代がん医療加速化研究事業「腫瘍浸潤細胞の時間的空間的変化に基づく免疫抑制機構の解明と治療への展開 」
文部科学省
- 科学研究費助成事業 基盤研究(S)「発がんの人種差と免疫応答の関わりの解明」
- 科学研究費助成事業 基盤研究(A)「がん組織の空間的マルチスケール解析による免疫監視と免疫寛容制御機構の解明」
国立がん研究センター研究開発費
- 28-A-7「先端的がん免疫モニタリング法開発体制に関する研究」
- 31-A-7「がん免疫療法抵抗性を解除する新規治療法の臨床展開に向けた開発研究」
用語解説
注1 自然免疫応答
病原体などが外部から侵入してきた際にその成分に反応して速やかに排除する応答のこと。
注2 CD8陽性T細胞
樹状細胞などから抗原を提示されて活性化し、IFN-gやグランザイムBなどの細胞を傷害する顆粒を発現してがん細胞を直接攻撃・死滅させる。獲得免疫応答の中心的な役割を果たし、キラーT細胞とも呼ばれる。
注3 OK-432
溶連菌抽出物で、日本国内で承認されている薬剤である。TLR2,4,9に結合して自然免疫系の細胞を活性化させることができる。
注4 PD-1阻害剤(抗PD-1抗体)
T細胞上のPD-1分子に結合する抗体で、免疫チェックポイント分子PD-1の働きを抑制する抗体薬である。
注5 多形核骨髄由来免疫抑制細胞(polymorphonuclear myeloid-derived suppressor cells: PMN-MDSCs)
免疫抑制作用を有する多形核細胞系で、癌・慢性炎症・感染症など多くの疾患において免疫応答を制限している細胞のこと。
注6 がん免疫編集説
免疫システムは自己と非自己を見分け、日々発生するがん細胞を排除する監視システムとして働くが、がん細胞は監視をすり抜けてがん増殖、進展に至る。この過程は排除相、平衡相、逃避相に分けられる。
注7 炎症性がん
がん組織の内部にT細胞が多く浸潤しているがん。
注8 非炎症性がん
T細胞が間質などに留まってがん組織の内部にはわずかしか存在しないがん。
注9 Toll様受容体
細菌やウイルスなどの特徴的な構造を見分ける受容体で樹状細胞などの自然免疫系の細胞表面上に発現している。
注10 樹状細胞
自然免疫応答細胞1つで、様々な末梢組織に存在して病原体などの外部からの侵入抗原を捕らえ、その後リンパ節に移動してCD8陽性T細胞に抗原を提示する役割がある。
注11 獲得免疫応答
病原体などが体内へ侵入して自然免疫応答では排除できない場合にT細胞やB細胞によって活性化される免疫応答のこと。免疫記憶によって2度目の侵入に素早く対処できる。
注12 フローサイトメトリー
サンプル溶液中の細胞を流し、一つ一つ整列させてレーザーを当てることによって細胞表面分子や細胞内分子の発現を解析する実験手法である。
注13 CD86, CD80
T細胞を活性化する際に必要で、活性化した樹状細胞などに発現する補助刺激シグナルを送る共刺激分子である。
注14 RNAシーケンス
次世代シーケンサーを使ってメッセンジャーRNAの配列を解読することによって遺伝子の発現レベルを定量する実験手法の一つある。
注15 骨髄由来抑制細胞(MDSCs)
骨髄由来の未熟な細胞で、単球系骨髄由来抑制細胞(Monocytic MDSCs: M-MDSCs)と顆粒球系骨髄由来抑制細胞(polymorphonucler MDSCs: PMN-MDSCs)より構成され、がんを攻撃する免疫システムを抑制する働きがある。
注16 マスサイトメトリー
細胞溶液の1細胞に発現する複数の分子を金属標識抗体によって検出する実験手法である。
注17 IFN-g
活性化したCD8陽性T細胞などから分泌されるサイトカインの一つで、がん細胞を殺傷する際に重要な役割を果たす。
注18 サイトカイン
免疫細胞などから分泌されるタンパク質で、極めて微量で標的細胞に対して作用を示して細胞間の情報伝達を担う。
注19 ケモカイン
様々な細胞から分泌されるタンパク質で濃度勾配の方向へT細胞などを遊走させる活性をもつ。
注20 マクロファージ
自然免疫応答に関与する食細胞で、病原体などの異物や死細胞などを捕食する細胞。
注21 グランザイムB
活性化したCD8陽性T細胞などから放出されるタンパク質の1つで、がん細胞などの標的細胞を殺傷することができる。
問い合わせ先
研究に関する問い合わせ
国立研究開発法人国立がん研究センター
研究所 腫瘍免疫研究分野/先端医療開発センター 免疫TR分野
西川 博嘉
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室