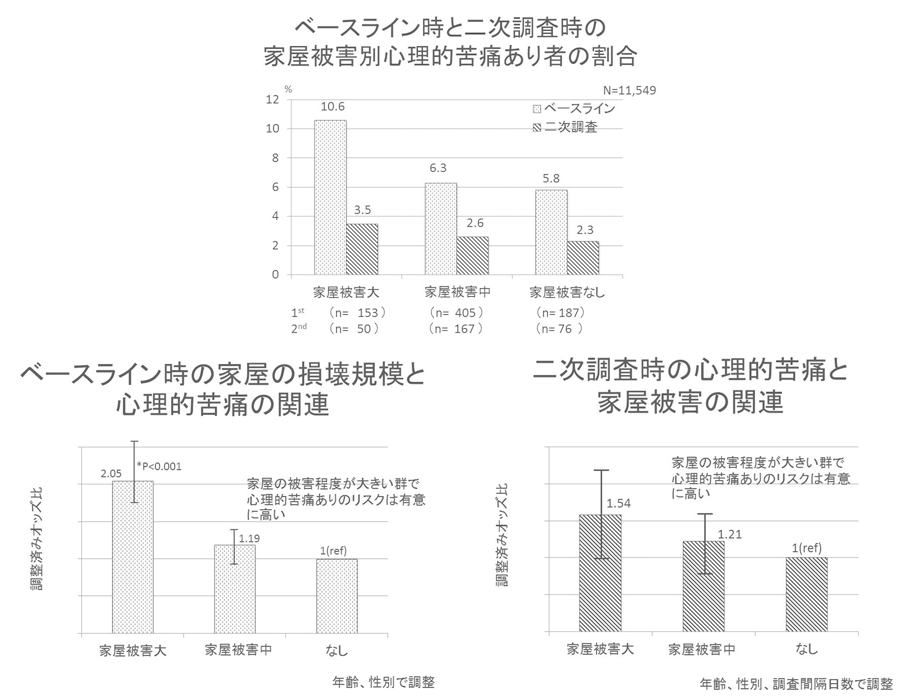
ナノ構造に閉じ込めた光でモータータンパク質の仕組みに迫る
2018-12-05 京都大学,分子科学研究所,青山学院大学
横川隆司 工学研究科准教授、藤本和也 同特定研究員(現・SOINN株式会社Senior researcher)らの研究グループは、飯野亮太 分子科学研究所教授、富重道雄 青山学院大学教授らと共同で、ナノ構造(ナノスリット)を用いてモータータンパク質であるキネシンとその運動に必要なアデノシン三リン酸(ATP)分子を同時に1分子観察する手法を開発しました。これにより、キネシンにATP分子が一つずつ結合する様子をリアルタイムで観察することができるようになり、キネシンが微小管と結合している場合には、ATP分子との結合時間が変化することを明らかにしました。
キネシンは細胞骨格を構成する微小管の上を運動することで、細胞小器官やタンパク質の輸送の原動力として働いています。この運動のエネルギー源はATPの加水分解反応であることが知られており、その化学反応と力学運動の相関について多くの研究が行われてきました。本研究では、幅100 nm程度のナノスリット内に光を閉じ込めて、1分子観察における背景光のノイズを抑制する新手法「Linear ZMWs」によって、蛍光ATPがキネシンに結合・解離する様子をリアルタイム観察しました。これにより、微小管の有無によってATPがキネシンに結合している時間や頻度が変化していることを1分子で捉えることに成功しました。
本研究で確立したナノスリットによるモータータンパク質の観察法は、キネシンだけでなく、ダイニンやミオシンなど他のモータータンパク質の1分子観察にも応用できます。本手法によって、モータータンパク質の運動機構について新たな知見を得ることが期待できます。
本研究成果は、2018年12月3日に、国際学術誌「ACS Nano」のオンライン版に掲載されました。
 図:Linear ZMWのイメージ図。 100 nm程度のスリットにより微小管(ピンク)、キネシン(緑)、蛍光ATP(赤)を用いた1分子観察におけるノイズを抑制することに成功した。
図:Linear ZMWのイメージ図。 100 nm程度のスリットにより微小管(ピンク)、キネシン(緑)、蛍光ATP(赤)を用いた1分子観察におけるノイズを抑制することに成功した。書誌情報
【DOI】https://doi.org/10.1021/acsnano.8b03803
Kazuya Fujimoto, Yuki Morita, Ryota Iino, Michio Tomishige, Hirofumi Shintaku, Hidetoshi Kotera, and Ryuji Yokokawa (2018). Simultaneous Observation of Kinesin-Driven Microtubule Motility and Binding of Adenosine Triphosphate Using Linear Zero-Mode Waveguides. ACS Nano.
詳しい研究内容について
―ナノ構造に閉じ込めた光でモータータンパク質の仕組みに迫る―概要
京都大学大学院工学研究科 横川隆司 准教授、藤本和也 同特定研究員(現、SOINN 株式会社 Senior researcher)らの研究グループは、分子科学研究所 飯野亮太 教授、青山学院大学理工学部 富重道雄 教授ら と共同で、ナノ構造 (ナノスリット)を用いてモータータンパク質であるキネシンとその運動に必要なアデノ シン三リン酸(ATP)分子を同時に 1 分子観察する手法を開発しました。これにより、キネシンに ATP 分子 が一つずつ結合する様子をリアルタイムで観察することができるようになり、キネシンが微小管と結合してい る場合には、ATP 分子との結合時間が変化することを明らかにしました。
キネシンは細胞骨格を構成する微小管の上を運動することで、細胞小器官やタンパク質の輸送の原動力とし て働いています。この運動のエネルギー源は ATP の加水分解反応であることが知られており、その化学反応 と力学運動の相関について多くの研究が行われてきました。本研究では、幅 100 nm 程度のナノスリット内に 光を閉じ込めて、1 分子観察における背景光のノイズを抑制する新手法 Linear ZMWs」によって、蛍光 ATP がキネシンに結合・解離する様子をリアルタイム観察しました。これにより、微小管の有無によって ATP が キネシンに結合している時間や頻度が変化していることを 1 分子で捉えることに成功しました。
本研究で確立したナノスリットによるモータータンパク質の観察法は、キネシンだけでなく、ダイニンやミ オシンなど他のモータータンパク質の 1 分子観察にも応用できます。本手法によって、モータータンパク質の 運動機構について新たな知見を得ることが期待できます。
本研究成果は、2018 年 12 月 3 日に、アメリカ化学協会(ACS)刊行の科学雑誌 ACS Nano」にオンライ ン掲載されました。
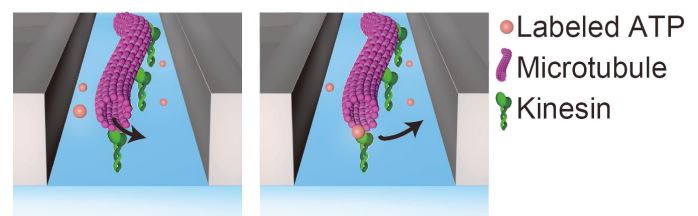
図 1:Linear ZMW の模式図。 100 nm 程度のスリットにより微小管・キネシンを用いた 1 分子観察におけるノイズを抑 制する。
1.背景
生物の主要な構成要素であるタンパク質は、生命の維持に必要な多種多様な機能を発揮します。筋肉の収縮 や細胞分裂に必要な機械的な運動は、モータータンパク質と呼ばれるタンパク質群によって駆動されています。 細胞内では、チューブリンタンパク質が重合して形成された微小管と呼ばれるフィラメント状の構造が、核を 中心に周辺部に向かって放射状に張り巡らされています。モータータンパク質の一つであるキネシンは、この 微小管と相互作用して運動することが知られており、詳細な運動の仕組みが研究されてきました。これまでに、キネシンが、アデノシン三リン酸 (ATP)分子が無機リン酸とアデノシン二リン酸 (ADP)分子に変化する加 水分解反応から運動のエネルギーを得ていることや、ATP 分子一つあたり約 8 nm (ナノメートル ナノは 10 億分の 1)ずつ運動することが解明されています。近年では、この運動の仕組みをより詳細に理解するために、 種々の顕微鏡技術を駆使して 1 つ 1 つのキネシン分子を個別に計測する手法が開発されてきました。
キネシンの運動のエネルギー源となる ATP についても 1 分子スケールで観察することで、運動機構の詳細 な理解という目標に近づくことが期待できます。観察対象に蛍光分子を結合させ、1 分子ずつ蛍光観察する 1 分子蛍光観察法は、キネシンの運動機構を計測する手法として有力なものです。しかし、生体内と同程度の高 い ATP 濃度の場合には背景光のノイズが大きくなり、1 分子観察が不可能になるという制限がありました。 このため、直径 100 nm 程度のピンホールに光を閉じ込めることでノイズを抑制し、より高い濃度の 1 分子観 察を行う Zero-Mode Waveguides (ZMWs)と呼ばれるデバイスが開発されましたが、フィラメント状の構 造である微小管はピンホールに導入することが困難であり、ZMWs をキネシンの運動評価に利用することが できていませんでした。
2.研究手法・成果
本研究では、100 nm 程度の幅を持つナノスリット構造によって、蛍光観察に必要な励起光の伝播を制限す ることで、1 分子観察時のノイズを抑制しました。この手法は ZMWs を応用したもので、Linear ZMWs と名 付けました。この方法を用いることによって、従来の研究で報告されているよりも高い濃度の蛍光標識 ATP と キネシンを用いて、1 分子観察を行うことができます
まず、数値シミュレーションを利用してナノスリット構造に励起光が入射したときの光の分布を計算し、そ の結果に基づいてスリットの寸法を設計しました。ガラス基板上のアルミ薄膜を電子ビームリソグラフィによ って加工してナノスリットを製作し、このスリットが Linear ZMWs として機能することを確認しました。そ の後、ガラス基板に固定したキネシン上を微小管が運動するグライディングアッセイと呼ばれる実験手法を用 い、蛍光 ATP が緑色蛍光タンパク質(GFP)を結合させたキネシンへと一時的に結合・解離する様子を 1 分 子観察することに成功しました。
観察結果から、蛍光 ATP がキネシンに選択的に結合している様子をリアルタイムで確認することができま した。また、微小管が存在する領域のキネシンでは、存在しない領域のキネシンと比較して ATP の結合時間 が短くなっていることがわかりました。これは、これまでにキネシンの運動計測から得られた知見を ATP 分 子の直接的な観察からも支持する結果であり、キネシンをはじめとするモータータンパク質が運動する仕組み をより詳細に理解することにつながるものです。

図 2::作成したナノスリットの電子顕微鏡写真 (左)。緑色蛍光 GFP で標識したキネシンと赤色の蛍光分子で標識した ATP の 1 分子蛍光顕微鏡観察画像(右)。
3.波及効果、今後の予定
本研究では、キネシンと蛍光 ATP の 1 分子観察に Linear ZMW を用いることで、観察に利用できる蛍光分 子の濃度を引き上げることに成功しました。今後は、同様の手法を用いて、キネシンの運動をより詳細に計測 するだけでなく、微小管上で運動するダイニンやアクチンフィラメント上で運動するミオシンなどのモーター タンパク質、さらに微小管に結合するタンパク質群の観察を行うことが期待できます。したがって、本研究の 成果は、生物物理学のさまざまな分野での進歩に有力な実験手法として貢献しうるものです。
4.資料提供
本研究成果に関連する画像や動画資料は下記 URL よりご利用いただけます。報道で使用される場合、提供元 は 横川隆司 京都大学工学研究科准教授」でお願いいたします。 https://pubs.acs.org/doi/10.1021/acsnano.8b03803
5.研究プロジェクトについて
JSPS 科学研究費補助金(16K13644, 2501836)の支援を受けました。ナノスリットデバイスの作製について は、京都大学ナノテクノロジーハブ拠点(ナノハブ)を利用しました。
<研究者のコメント>
我々は、機械工学に立脚したマイクロ・ナノ加工技術を専門として、生命科学分野におけるブレイクスルーに つながるような学際融合研究を推進しています。マイクロ・ナノスケールに微細化することで新たに現れる物 理現象や生命科学現象に興味を持っています。本学の物理工学科、機械系三専攻の学生に限らず、チャレンジ 精神のある学生・研究員を募集しています。興味のある方は、是非、下記の横川までご連絡ください。
<論文タイトルと著者>
タイトル: Simultaneous Observation of Kinesin-Driven Microtubule Motility and Binding of Adenosine Triphosphate Using Linear Zero-Mode Waveguides (線形ゼロモード導波路を用いたキネシン駆動 による微小管運動とアデノシン三リン酸の同時観察) 著 者 :藤本和也、森田有貴、飯野亮太、富重道雄、新宅博文、小寺秀俊、横川隆司
掲 載 誌 :ACS Nano DOI 10.1021/acsnano.8b03803