2025-12-12 京都大学

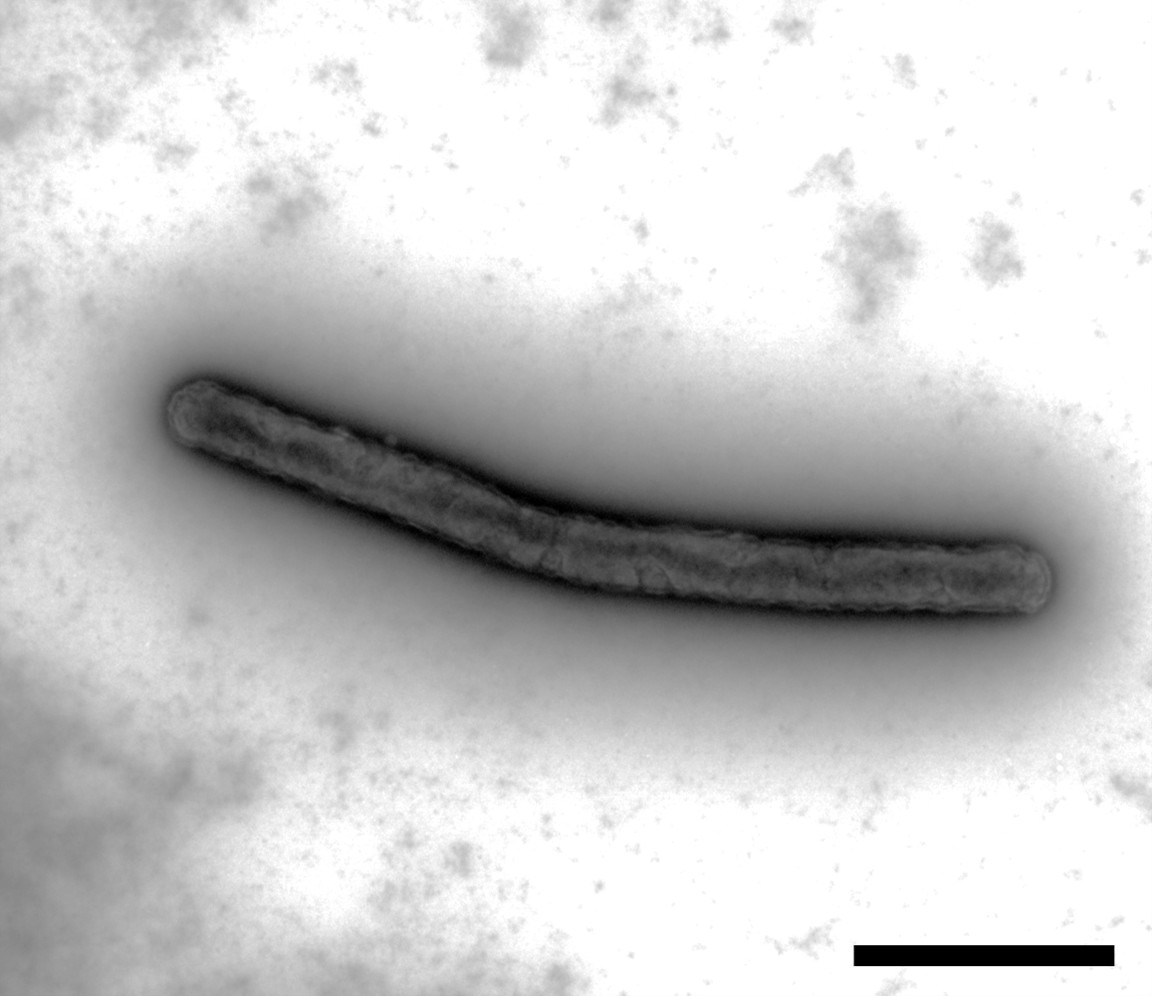
境界形状を細胞骨格構造体に転写するアクチン流れのイメージ図
<関連情報>
- https://www.t.kyoto-u.ac.jp/ja/research/topics/20251210
- https://www.t.kyoto-u.ac.jp/ja/research/topics/r71210seika_maeda
- https://pubs.acs.org/doi/10.1021/acs.nanolett.5c02558
ミオシン駆動による移流とアクチンの再編成が閉じ込められたアクトミオシンゲルの形状を制御する Myosin-Driven Advection and Actin Reorganization Control the Geometry of Confined Actomyosin Gel
Archit Negi,Ryota Sakamoto,Ryo Ienaga,Makito Miyazaki,Yusuke T. Maeda
Nano Letters Published: December 10, 2025
DOI:https://doi.org/10.1021/acs.nanolett.5c02558
Abstract
Harnessing nanoscale motor proteins to control material shape is a promising strategy in nanotechnology and material science. One notable system is the actomyosin network, composed of actin filaments and myosin motor proteins, providing a platform for constructing contractile, shape-adaptive materials. While the role of actomyosin in shaping cells has been studied, the reverse question of how the boundary shape affects the actomyosin system remains poorly understood. Here, we present a microwell system that reveals how geometrical confinement directs the organization of actomyosin networks. By combining experiments and simulations, we show that the asymmetric shape of the microwells is transferred to contracted actomyosin gels via actin flow, which propagates laterally and upward, leading to actomyosin accumulation at the top surface. Furthermore, tuning the myosin contractility and actin polymerization rate allows control over gel size and shape. Our findings provide a framework for integrating molecular motors and cytoskeletons into confined architectures to create responsive biomaterials.