2024-03-27 東北大学
学際科学フロンティア研究所 新領域創成研究部
助教 松林 英明
【発表のポイント】
- 細胞運動のアクセルとなる酵素PI3Kにブレーキ機構も内蔵されていることを解明しました。
- PI3Kとエンドサイトーシス(注1)分子AP2(注2)との結合を介したPI3Kの新規制御機構が判明しました。
- 細胞の運動やがん化過程におけるPI3Kの役割の理解を深め、新規治療薬開発への道を拓くことが期待される成果です。
【概要】
PI3K(ホスホイノシトール3-キナーゼ)は、細胞の運動や増殖、がん化などに関わる重要な酵素で、抗がん剤のターゲットとなるなど医学的にも重要な分子です。東北大学 学際科学フロンティア研究所の松林英明助教らは、PI3Kのアミノ酸配列の中に、従来知られていなかったAP2結合配列を発見し、このAP2結合配列が、PI3K本来の酵素活性とは別に、細胞膜を細胞内側へ取り込む働き(エンドサイトーシス)を誘発することを明らかにしました。さらにAP2と結合できないように改変したPI3Kは、細胞をより速く運動させることから、PI3KとAP2との結合が細胞運動のブレーキとして働くことが示されました。これまでPI3Kは、その酵素活性によって細胞運動のアクセルとして機能すると考えられてきましたが、本研究の成果によって、PI3Kには、AP2結合配列を介したブレーキ機構も内蔵されていることが分かりました。PI3Kの新たな制御機構が明らかになったことで、PI3Kが関わる疾患の機序解明や、それらの治療薬開発のための知見となることが期待されます。
本研究成果は、オンライン科学誌Nature Communicationsにて、2024年3月23日付で公開されました。
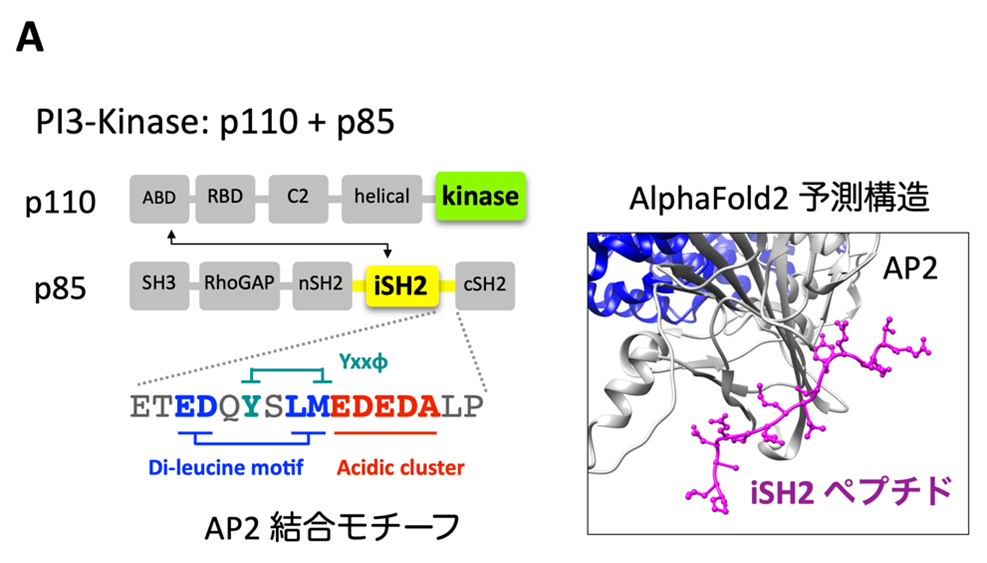
図A:PI3Kのドメイン構造とAP2との結合予測構造
PI3Kは、p110のABDドメインとp85のiSH2ドメインが結合する形で二量体を形成しています。本研究では、iSH2ドメインの中にAP2と結合するモチーフ(YxxΦモチーフ、di-leucineモチーフ、acidic cluster)があることを見出しました。AlphaFold2予測構造は、AP2とiSH2のYxxΦモチーフとの結合状態の構造を予測したものです(iSH2ペプチドはYxxΦモチーフを含む16アミノ酸の配列)。
【用語解説】
注1. エンドサイトーシス:
エンドサイトーシスは、細胞がその膜をくぼませて細胞膜や外部の物質を取り込むプロセスです。この過程により、細胞の外にある栄養素やシグナル分子などを細胞内に取り込むことができます。エンドサイトーシスは、物質の細胞内への輸送、細胞表面の受容体の調節などに重要な役割を果たします。
注2. AP2:
AP2複合体はエンドサイトーシスにおける中心的なアダプター分子の一つで、細胞内に取り込まれる細胞膜上のタンパク質のモチーフを認識し、クラスリンと呼ばれるタンパク質を結びつける働きがあります。クラスリンは、取り込まれる細胞膜をつつむ包装材のような役割を果たし、クラスリンに囲まれた小胞が「荷物」として細胞内部へと運ばれます。
問い合わせ先
(研究に関すること)
東北大学 学際科学フロンティア研究所
助教 松林英明
(報道に関すること)
東北大学 学際科学フロンティア研究所
特任准教授 藤原英明


