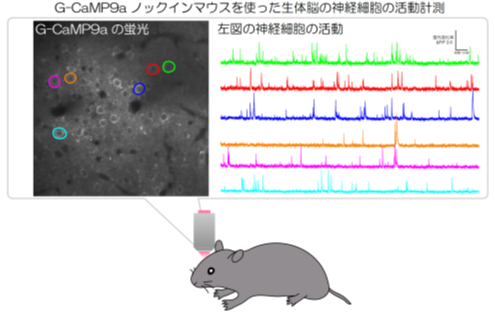
高感度・高速カルシウムセンサーによる神経活動の計測に成功
2022-02-15 京都大学,東京大学,科学技術振興機構,日本医療研究開発機構
概要
複雑な脳機能を解明するためには、生きた動物の脳から、個々の神経細胞の活動を正確に計測する技術が必要不可欠です。京都大学大学院生命科学研究科 坂本雅行 特定准教授、東京大学大学院医学系研究科 井上昌俊 特任助教(研究当時、現:スタンフォード大学 博士研究員)、東京大学大学院医学系研究科 尾藤晴彦 教授らの共同研究グループは、高感度・高速カルシウムセンサーを安定して発現する遺伝子改変マウスの開発に成功しました。
近年、神経活動を可視化する方法として、蛍光カルシウムセンサーを用いた神経活動イメージング法が広く用いられています。本研究では、より正確な神経活動の計測を実現するため、高感度・高速カルシウムセンサー(G-CaMP9a)の開発と、この新規センサーを細胞種特異的に発現誘導可能な遺伝子改変マウス(G-CaMP9aノックインマウス注1)の作製をおこないました。2光子励起顕微鏡注2を用いた生体イメージングにより神経細胞の活動を観察したところ、このマウスは感覚刺激に対する神経細胞の応答をより正確に検出できることが明らかとなりました。作製したマウスは、カルシウムセンサーの発現レベルが安定して均一なため、複雑な高次脳機能を解明するための有用なリソースとなることが期待されます。
本成果は、2022年2月14日(現地時刻)に米国の国際学術誌「Cell Reports Methods」にオンライン掲載されました。
背景
わたしたちの脳では、数百~千億の神経細胞(ニューロン)が巨大な神経ネットワークを形成しており、複雑な情報処理をおこなうことで、認知や学習などの様々な高次脳機能を実現しています。高次脳機能の仕組みはとても複雑かつ難解であり、解明が期待される現代科学の究極の課題の一つであるといえます。
高次脳機能のメカニズムを理解するためには、個々の神経細胞の活動を正確に計測する必要があります。この神経細胞の活動を計測するため、近年では、神経発火注3にともない細胞内へカルシウムイオンが流入することを応用した、蛍光カルシウムセンサーによるイメージング技術が急速な発展を遂げています。また、2光子励起顕微鏡を用いることで、生きた動物の脳から神経細胞の活動を記録することも可能となっています。
ところが、従来のカルシウムセンサーは、神経活動の有無やその強度のみを検出しており、神経発火の頻度やその回数を正確に計測するためには、時間分解能が不十分でした。正確な活動計測を実現するため、反応速度が早く、神経発火の回数とセンサーの蛍光変化量のあいだに線形関係を示すカルシウムセンサーの開発が望まれていました。また、カルシウムセンサーを神経細胞へ導入する方法として、アデノ随伴ウイルス注4がよく用いられています。ところが、ウイルスを用いた導入法では、カルシウムセンサーの発現レベルが細胞毎に異なることや細胞毒性などの問題が挙げられていました。この問題を解決するため、細胞毒性が無く、安定してカルシウムセンサーを発現誘導可能なマウス系統を樹立する必要がありました。
研究手法・成果
従来のカルシウムセンサーのほとんどは、カルモジュリン(CaM)注5結合領域として、筋肉由来タンパク質のカルシウム結合配列(M13)が用いられていました。本研究では、緑色カルシウムセンサーG-CaMP4.1の筋肉由来タンパク質のカルシウム結合配列を、カルシウム・カルモジュリン依存性プロテインキナーゼキナーゼ(CaMKK)のCaM結合領域に置換しました。先行研究において、我々はCaMKKはカルシウムイオンとCaMとの複合体に対し高親和性であることを示唆することを明らかにしていました。その結果、既存の緑色カルシウムセンサーに比べて感度が高く、かつカルシウムイオン濃度と蛍光強度の変化の関係を示すHill係数注6が1.6(既存のセンサーは2以上だった)と、線形性が非常に高いカルシウムセンサー(G-CaMP9a)の創出に成功しました。
次に、マウスゲノムのRosa26遺伝子座注7にG-CaMP9aを導入した遺伝子改変マウス(G-CaMP9aノックインマウス)の作製とその評価をおこないました。作製したノックインマウスは、Flp/FRTシステム注8を用いることで、目的とする組織や細胞種だけにG-CaMP9aを発現誘導できるようにデザインしました。G-CaMP9aノックインマウスの評価については、2光子励起顕微鏡を用いた生体イメージング技術を用いておこないました。その結果、マウス大脳皮質一次視覚野ならびに体性感覚野において、興奮性神経細胞の自発発火と感覚刺激に対する応答を1細胞レベルで検出可能であることが明らかとなりました。また、抑制性神経細胞のサブタイプの一つであるソマトスタチン陽性神経細胞のうち、一部の細胞群は活動パターンに非常に高い同期性があることを明らかにしました。さらに、G-CaMP9aノックインマウスに赤色カルシウムセンサーであるXCaMP-Rを遺伝子導入することで、興奮性神経細胞と抑制性神経細胞の活動を同時に計測可能な多色イメージングにも成功しました。
波及効果、今後の予定
本研究成果は、高感度・高速カルシウムセンサーを安定して発現誘導可能な遺伝子改変マウスが複雑な高次脳機能解明するための有用なリソースであることを示しています。開発したマウスを用いることで、学習や記憶の過程で脳がどのように機能しているか、新たな知見が得られると期待されます。また、開発したマウスに光遺伝学注9ツールを応用することにより、全光学的(All-optical)に神経活動計測と操作を同時におこなうことも可能となります。将来的には、疾患モデル動物の神経活動計測に応用することで精神疾患や高次脳機能障害の治療法開発にも役に立つことが期待されます。カルシウムイオンは全ての細胞種において重要な役割を果たすため、本研究で開発した遺伝子改変マウスは、神経科学分野にとどまらず、新規医薬品の開発など、様々な生命科学分野への応用が期待されます。
研究プロジェクトについて
本研究は、科学技術振興機構(JST)・戦略的創造研究推進事業のさきがけ研究領域「革新的光科学技術を駆使した最先端科学の創出」における研究課題「コンピュータホログラフィーを応用した活動電位発生機構の解明」(JPMJPR1906)、日本医療研究開発機構(AMED)・脳とこころの研究推進プログラム「革新的技術による脳機能ネットワークの全容解明プロジェクト(革新脳)」における研究開発課題「活動痕跡の多重化標識と全光学的検索に基づく回路機能解明技術開発」(JP19dm0207079)、文部科学省新学術領域研究「記憶・情動における多領野間脳情報動態の光学的計測と制御」(JP17H06312)、科学研究費補助金(JP21K19429、JP20H04122、JP18K19493、JP16H06728、 JP15K18372、JP19H01007、JP16H06276)の支援によって得られた成果です。
用語解説
- 注1 ノックインマウス
- 遺伝子操作により、標的とするゲノム領域に、外来遺伝子の導入をおこなったマウス。
- 注2 2光子励起顕微鏡
- 2光子吸収過程により分子を励起し、その蛍光を観察する顕微鏡。従来のイメージング技術では困難であった生体深部の蛍光分子であっても非侵襲的に観察することができる。
- 注3 神経発火
- 神経細胞の膜電位が活動電位に達すること。発火することにより上流の神経細胞から下流の神経細胞へ情報を伝達する。
- 注4 アデノ随伴ウイルス
- 外来遺伝子を細胞に導入するために使用されるウイルス。非病原性であり、近年では基礎研究だけでなく、遺伝子治療の臨床開発にも用いられている。
- 注5 カルモジュリン(CaM)
- カルシウム結合タンパク質。細胞内のカルシウムイオン濃度を検知し、カルシウム感受性酵素などのタンパク質へ信号を伝達する。
- 注6 Hill係数
- カルシウムイオンとセンサーの蛍光強度変化の協同性を示す指標。Hill係数が1より大きいほど協同性が高く、カルシウムイオンに対する蛍光強度は正の協同性が現れ、非線形的な変化を示す。
- 注7 Rosa26遺伝子座
- マウス第6染色体に存在するゲノム領域。挿入された遺伝子は、他の遺伝子からの影響を殆ど受けず、安定的に発現する。全ての細胞種において発現していることから、外来遺伝子の導入部位として用いられる。
- 注8 Flp/FRTシステム
- FRT配列と呼ばれる34塩基から構成されるDNA配列に対して、出芽酵母由来の組換え酵素Flpが働くことにより生じる部位特異的組換え反応。ターゲットとする遺伝子配列の前後にFRT 配列を設計することで、Flpの働きによって挟まれた領域が不可逆的に除去される。
- 注9 光遺伝学
- 光によって活性化されるタンパク質を細胞に発現させ、その機能を光によって操作する技術。光照射により、神経細胞に活動電位を非侵襲的に誘導することが可能となる。
論文タイトルと著者
- タイトル
- A Flp-dependent G-CaMP9a transgenic mouse for neuronal imaging in vivo(Flp依存的なG-CaMP9aトランスジェニックマウスを用いた生体神経活動イメージング)
- 著者
- Masayuki Sakamoto, Masatoshi Inoue, Atsuya Takeuchi, Shigetaka Kobari, Tatsushi Yokoyama, Shin-ichiro Horigane, Sayaka Takemoto-Kimura, Manabu Abe, Kenji Sakimura, Masanobu Kano, Kazuo Kitamura, Hajime Fujii, Haruhiko Bito
- 掲載誌
- Cell Reports Methods
- DOI
- 10.1016/j.cmeth.2022.100168
お問い合わせ先
坂本 雅行(さかもと まさゆき)
京都大学大学院生命科学研究科・特定准教授
尾藤 晴彦(びとう はるひこ)
東京大学大学院医学系研究科・教授
報道・取材に関する問い合わせ先
京都大学 総務部広報課国際広報室
東京大学 医学部・医学系研究科総務チーム
科学技術振興機構 広報課
JST事業に関する問い合わせ先
科学技術振興機構 戦略研究推進部グリーンイノベーショングループ
嶋林 ゆう子(しまばやし ゆうこ)
AMEDに関する問い合わせ先
日本医療研究開発機構 疾患基礎研究事業部 疾患基礎研究課
脳とこころの健康推進プログラム
革新的技術による脳機能ネットワークの全容解明プロジェクト