α線がん治療の実用化に向けて進展
2019-01-18 理化学研究所
理化学研究所(理研)開拓研究本部田中生体機能合成化学研究室の田中克典主任研究員、藤木勝将特別研究員らの研究グループ※は、理研クリック標識技術と仁科加速器科学研究センターのRI[1]製造技術を用いて、抗がん抗体(トラスツズマブ[2])に対する放射線がん治療効果が期待される、α線放射核種アスタチン-211(211At)の実用的な標識法を開発しました。
本研究成果は、抗体などのさまざまな生体高分子の211At標識に利用することにより、α線がん治療を大きく進展させることが期待できます。
田中主任研究員らはこれまでに、二つのクリック反応[3]「理研クリック反応(高速6π-アザ電子環状反応)[4]」と「テトラジンライゲーション(逆電子要請型Diels-Alder反応)[5]」を一挙に行い、生体高分子を効率的に放射性標識する「ワンポット三成分ダブルクリック標識法」を開発していました。
今回、研究グループは、211Atが安定に結合するデカボレートというホウ素化合物を導入した「デカボレート-テトラジンプローブ」を開発し、ワンポット三成分ダブルクリック標識法を用いて、仁科加速器科学研究センターのサイクロトロンで製造した211Atをトラスツズマブに効率的かつ簡便に標識することに成功しました。さらに、表皮がんマウスの腫瘍内に合成した211At標識トラスツズマブを投与したところ、高いα線がん治療効果を示すことが分かりました。
本研究は、英国王立化学会の科学雑誌『Chemical Science』(12月21日付け)に掲載されました。
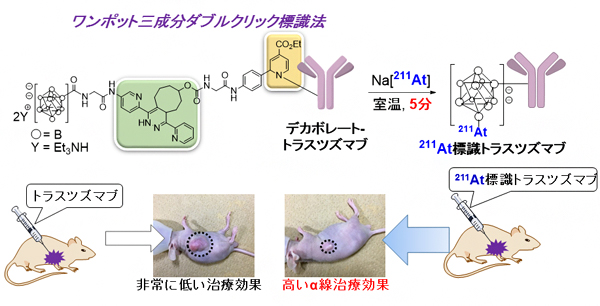
図 理研クリック標識技術による211At標識抗体(トラスツズマブ)の実用的合成法とα線治療
※共同研究グループ
理化学研究所
開拓研究本部 田中生体機能合成化学研究室
主任研究員 田中 克典(たなか かつのり)
特別研究員 藤木 勝将(ふじき かつまさ)
特別研究員 ペニ・アーマディ(Peni Ahmadi)
仁科加速器科学研究センター RI応用研究開発室核化学研究チーム
チームリーダー 羽場 宏光(はば ひろみつ)
テクニカルスタッフⅠ(研究当時)矢納 慎也(やのう しんや)
研究パートタイマーⅠ 佐藤 望(さとう のぞみ)
特別研究員 横北 卓也(よこきた たくや)
生命機能科学研究センター 健康・病態科学研究チーム
チームリーダー 渡辺 恭良(わたなべ やすよし)
研究員 金山 洋介(かなやま ようすけ)
背景
放射線治療は、外科療法、化学療法と並ぶ三大がん療法の一つです。がん治療に使われている一般的な放射線治療では、X線や電子線といった比較的高エネルギーの放射線を、患者の体外から腫瘍に向けて照射します(外部照射)。
また最近、放射線内用療法[6]の一種である放射免疫療法として、照射範囲の短いβ線やα線放射核種を抗体に標識した「放射性がん標的分子」の開発が行われています注1)。放射性がん標的分子は、がん細胞に特異的に結合するため、がん細胞だけに対して放射線を照射して効率的な治療ができ、周りの組織にダメージを与えるリスクを低減できます。実際に、β線核種を標識した、90Y標識リツキシマブ(ゼヴァリン)、131I標識トシツモマブ(ベキサール)などが放射性抗体医薬品として実用化されています。
これらに加え、より強力で、効果的な放射線治療が期待されるα線核種を用いた放射線内用療法の研究も進められています。現在、放射性抗体医薬品の作製において、放射性標識反応に使われている代表的な手法が活性エステル法[7]です。これまでに報告されたほとんどのα線核種標識分子が、この活性エステル法を利用して合成されています。しかし、この手法では、実用的な反応効率で標識反応を達成するために、高濃度条件下で生体分子と標識剤を反応させる必要があり、また数時間から終夜の長い反応時間を要するという問題がありました。
田中主任研究員はこれまでに、さまざまな理研クリック試薬を開発し、理研クリック標識技術を用いたタンパク質や細胞の標識、診断技術の開発に成功しています注2)。2017年には、二つのクリック反応「理研クリック反応(高速6π-アザ電子環状反応)」と「テトラジンライゲーション(逆電子要請型Diels-Alder反応)」を一挙に行うことで、生体分子を簡便に標識できる「ワンポット三成分ダブルクリック標識法」という理研クリック標識技術を開発し、この標識法を用いて、ヒト血清アルブミン(HSA)や抗体に対して、放射性診断・治療用β線核種67Cuの実用的な標識を達成しています(図1)注3)。
今回研究グループは、実用的なα線免疫療法を達成するため、α線核種である「アスタチン-211(211At)」が安定に結合するデカボレートというホウ素化合物を導入したデカボレート-テトラジンプローブの開発を試みました。このプローブとワンポット三成分ダブルクリック標識法を用いることで、抗体にデカボレートを効率的に導入し、続いて211Atで標識することで簡便に211At標識抗体を合成できると考えました。
注1)Milenic D. E., Brady E. D. and Brechbie M. W. Antibody-targeted radiation cancer therapy. nature reviews drug discovery. 2004;3:488-99.
注2)2018年2月23日プレスリリース「理研クリック試薬の誕生」
注3)K. Fujiki, S. Yano, T. Ito, Y. Kumagai, Y. Murakami, O. Kamigaito, H. Haba, K. Tanaka: “A One-Pot Three-Component Double-Click Method for Synthesis of [67Cu]-Labeled Biomolecular Radiotherapeutics”, Sci. Rep. 7, 1912 (2017).
研究手法と成果
まず、ダブルクリック標識法を用いた効率的な211At標識法を開発するために、デカボレート-テトラジンプローブを設計・化学合成しました。そして、理研クリック反応とテトラジンライゲーションにより、デカボレートを導入したトラスツズマブ(デカボレート-トラスツズマブ)の効率的な合成を達成しました(図2)。
一方で、抗体など生物活性を持つ分子を化学修飾した際、その分子の活性が低下することや、失活することがしばしば見られます。この方法で合成したデカボレート-トラスツズマブのタンパク質HER2[8]に対する結合定数[9]を水晶振動子マイクロバランス解析[10]により測定したところ、元のトラスツズマブと同等の結合力(1.6nM)を示したことから、結合活性を低下させることなく、デカボレートが導入されたことが分かりました(図2)。
次に、合成したデカボレート-トラスツズマブにNa[211At](アスタチン-211ナトリウム)を作用させて、211At標識トラスツズマブを合成しました。ここで用いた211Atは、仁科加速器科学研究センターのサイクロトロンを使用して製造しました。Na[211At](75メガベクレル[MBq]、メガは100万)を用いて標識反応を行った結果、211At標識トラスツズマブを放射化学収率49%、比放射能[11]1.7MBq/μgで合成できました(図3条件A)。さらに、この211At標識トラスツズマブの結合定数の測定値は1.0nMであり、結合力を保持して211At標識できたことが分かりました。
100メガベクレル以上の非常に高い放射能のNa[211At](104メガベクレル[MBq])を用いて標識反応を行った結果、報告された合成例では最高レベルの比放射能15MBq/μg(放射化学収率30%)で211At標識トラスツズマブの合成を達成しました(図3条件B)。
また、211At標識トラスツズマブのα線に対する安定性について、合成後24時間においても放射線による分解はなく、安定であることを確認しました。
さらに、開発した211At標識抗体の合成法が実用的か調べるために、合成した211At標識トラスツズマブのα線治療効果を評価しました。HER2が過剰に発現しているヒト表皮がんA431細胞を移植したマウスに、211At標識トラスツズマブを腫瘍内注射により投与して解析しました。まず、211At標識トラスツズマブが、がん細胞特異的に、また十分な時間集積するか解析を行ったところ、図4aに示すように、投与1日後で非常に高い集積が見られ、投与2日後においても十分な集積が見られたことから、この211At標識トラスツズマブががん細胞の標的分子として利用できることが分かりました。一方で、比較として211Atだけではがんに集積しないことも確認しました(図4b)。
続いて、腫瘍内投与後のα線照射による治療効果を調べました。図5bに示すように、211At標識トラスツズマブを投与したがん移植マウス群では、1カ月以上経過しても、がんのサイズは小さいままで、成長抑制が見られました。一方、トラスツズマブ、リン酸緩衝液をそれぞれ腫瘍内投与したがん移植マウス群では、がんの速い成長が見られました。各マウス群の生存率においても、図5cに示すように、211At標識トラスツズマブ投与マウス群では、全てのマウスが生存し、トラツズマブ、リン酸緩衝液投与マウス群は、それぞれ投与15日後から生存マウスが減り、ほとんどのマウスが生存しませんでした。また、毒性に関しては、211At標識トラスツズマブ投与マウス群では、体重の低下が少し見られましたがその後回復し、著しい毒性は見られませんでした(図5a)。
さらに、図5dに示すように、より高い放射能の211At標識トラスツズマブを投与したマウス群の方が、がん成長抑制が見られました。また、図5eに示すように、1MBqの211At標識トラスツズマブを投与したマウス群では、全てのマウスが生存しましたが、0.5、0.1MBqの211At標識トラスツズマブの投与マウス群では、投与17日後以降に生存マウスの減少が徐々に見られました。体重については、1MBq以下の211At標識トラスツズマブの投与では減少はなかったことから、毒性は見られないことが分かりました(図5f)。一方、1MBqのNa[211At]を腫瘍内投与しても、α線治療効果は見られませんでした。
今後の期待
今回、理研の技術を結集させ、効率的かつ簡便なα線治療効果を持つ211At標識トラスツズマブの合成法を開発しました。この研究成果は、合成化学を駆使したα線免疫療法の実用化に貢献すると期待できます。特に、本技術を用いることで、他の抗体など、さまざまながん標的分子を211At標識が可能であり、α線がん治療を大きく進展させるための基盤技術となると考えられます。
また、この理研クリック標識技術を用いて、診断用放射性標識分子を作製することが可能であることから、PET[12]による診断と合わせたがん治療も可能です。したがって、今後、本技術が実際のがん医療現場において、放射線診断・治療を改革していくと期待できます。
原論文情報
Katsumasa Fujiki, Yousuke Kanayama, Shinya Yano, Nozomi Sato, Takuya Yokokita, Peni Ahmadi, Yasuyoshi Watanabe, Hiromitsu Haba and Katsunori Tanaka, ” 211At-Labeled immunoconjugate via a one-pot three-component double click strategy: Practical access to α-emission cancer radiotherapeutics”, Chemical Science, 10.1039/C8SC04747B
発表者
理化学研究所
主任研究員研究室 田中生体機能合成化学研究室
主任研究員 田中 克典(たなか かつのり)
特別研究員 藤木 勝将(ふじき かつまさ)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- RI
- 物質を構成する原子核には、構造が不安定なため時間とともに放射線を出しながら原子核が崩壊していくものがある。このような原子核を放射性同位元素(RI)と呼ぶ。同じ元素であっても中性子の数が異なるものを同位体と呼ぶが、同位体は安定なものと不安定なものに分類される。
-
- トラスツズマブ
- がんの抗体医薬。乳がんの中でも細胞表面にHER2タンパク質が高発現するタイプは、治療が難しいとされていたが、トラスツズマブはHER2と結合することによりがん細胞のみを特異的に攻撃する。
-
- クリック反応
- スクリプス研究所のB. K. Sharpless教授(2001年ノーベル化学賞受賞)によって提起された効率的な結合形成反応。シートベルトを締める際、“カチッ”というように、2つの反応部位が、速やかに、かつ選択的に、しかも他の副生成物を与えることなく100%に近い効率で結合生成を起こすような型の反応をいう。
-
- 理研クリック反応(高速6π-アザ電子環状反応)
- 1-アザトリエンの末端炭素原子と窒素原子が結合してピリジン誘導体を与える反応を6π-アザ電子環状反応と呼ぶ。この反応は古くから知られていたものの、長い反応時間と高い反応温度が必要とされ、さらに収率もよくなかったことから積極的に合成法として活用されることは少なかった。しかし1998年に発表者らがアザ電子環状反応を強力に促進させる置換基効果を発見して以来、有機合成に限らず生体分子や細胞の標識、あるいは複合化のための反応として利用されている。現在、「理研クリック反応」として、理研を中心とした国際研究グループが中心となり診断や放射線治療に向けた研究を展開している。
-
- テトラジンライゲーション(逆電子要請型Diels-Alder反応)
- 二つのピリジン環が置換した電子欠損な1,2,4,5-テトラジンとトランス-シクロオクテン間で化学選択的に進行する環化反応(Diels-Alder反応)。代表的なクリック反応の一つとして、生体分子の化学修飾に幅広く利用される。反応速度が最も速いクリック反応として知られる。
-
- 放射線内用療法
- β線やα線を放出する放射線放出核種を体内に導入し、悪性腫瘍に対する放射線治療を行うこと。
-
- 活性エステル法
- カルボン酸の活性エステルの一つであるスクシンイミジルエステル化合物で、ペプチドやタンパク質のアミノ基を標識する方法。
-
- HER2
- 細胞の表面に存在するタンパク質で、正常細胞においては細胞の増殖・分化などの制御に関わっている。HER2遺伝子に変異が起こると、HER2遺伝子はがん遺伝子として働く。HER2は、乳がん、胃がん、卵巣がんなど、多くのがん細胞の表面に発現している。ハーツーと読む。
-
- 結合定数(解離定数)
- 分子と分子が可逆的に結合する場合の結合力を示す数値のことで、結合が平衡に達する濃度で表す。
-
- 水晶振動子マイクロバランス解析
- 周波数の経時変化から認識される微量分子の結合量を定量する解析方法。
-
- 比放射能
- 放射性同位体を含む物質の単位質量あたりの放射能の強さのこと。ここでは、単位質量(μg)のトラスツズマブあたりのアスタチン-211のα線量(メガベクレル[MBq])を示す。
-
- PET
- 陽電子を放出する陽電子放出核種(放射性同位体の一種)をプローブとして、生体内のプローブ分布を画像化する手法。人体に害のない微量のPETプローブを体内に注入し、その集積を非侵襲的に(生体を傷つけずに)3次元画像化し定量することができる。
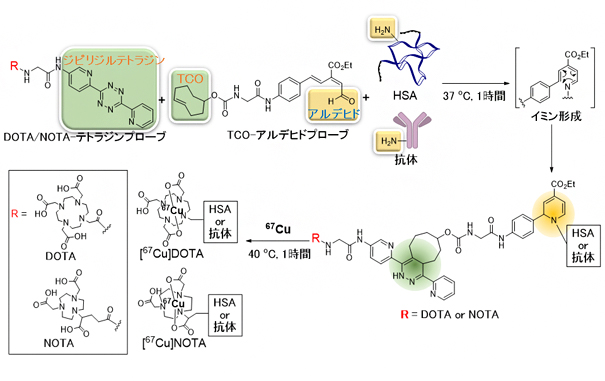
図1 二つの理研クリック試薬を用いたワンポット三成分ダブルクリックによる67Cu標識
ヒト血清アルブミン(HSA)や抗体に理研クリック試薬の「TCO-アルデヒドプローブ」と金属キレート剤を導入した「DOTA/NOTA-テトラジンプローブ」を同時に作用させることで、テトラジンライゲーション(緑の部分同士のクリック反応)と理研クリック反応(黄色の部分同士のクリック反応)を一挙に行い、DOTA/NOTAの導入を効率的に行うことができる。通常、クリック反応によるタンパク質の標識は、タンパク質にクリック反応が進行する官能基を化学的、遺伝子工学的手法を用いて導入する操作を必要とするが、この手法では、理研クリック試薬がタンパク質のリジン残基の側鎖のアミノ基と反応するため、そのような操作が不要である。続いて、DOTA/NOTAを導入した生体分子に67Cuを反応させ、67Cu標識を行う。
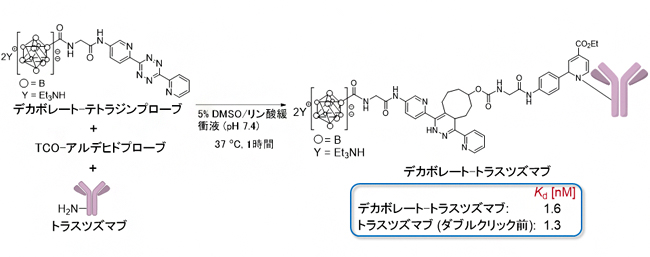
図2 ダブルクリック標識法によるデカボレート-トラスツズマブの合成
トラスツズマブ(10µM)、デカボレート-テトラジンプローブ(100µM)、TCO-アルデヒドプローブ(100µM)のリン酸緩衝溶液を、37℃で加温して1時間反応させた後、限外ろ過を行い、過剰分のデカボレート-テトラジンプローブおよびTCO-アルデヒドプローブを除去することで、効率的かつ簡便にデカボレート-トラスツズマブを得ることができた。水晶振動子マイクロバランス解析により、合成したデカボレート-トラスツズマブ、トラスツズマブのHER2に対する結合定数を測定したところ、ダブルクリック前の結合定数とほぼ同じであった。
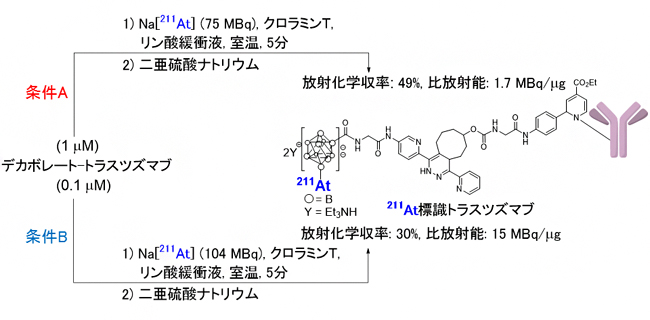
図3 デカボレート-トラスツズマブの211At標識
条件A:デカボレート-トラスツズマブ(1µM)にNa[211At](75MBq)、酸化剤のクロラミンT(211Atを酸化して反応活性種にする)をリン酸緩衝液中で混合し、室温で5分間反応後、還元剤の二亜硫酸ナトリウム(211Atを還元して反応不活性化する)を加え、限外ろ過で未反応211Atを除去することで211At標識トラスツズマブを合成した。
条件B:デカボレート-トラスツズマブ(0.1µM)にNa[211At](104MBq)、酸化剤のクロラミンT(211Atを酸化して反応活性種にする)をリン酸緩衝液中で混合し、室温で5分間反応させて、同様に限外ろ過処理を行い、211At標識トラスツズマブを合成した。
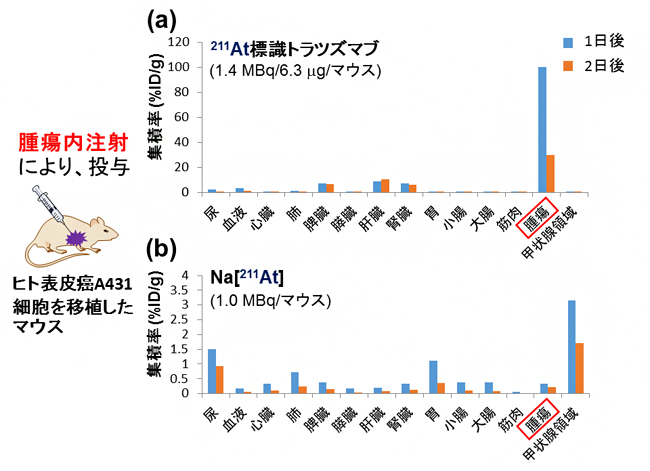
図4 ダブルクリック標識法により合成した211At標識トラスツズマブのα線治療効果解析I
(a)マウス1匹あたり211At標識トラスツズマブ(1.4MBq/6.3µg)を腫瘍内注射により投与した。投与1日後と2日後に解剖し、各臓器、血液、尿、腫瘍のγ線量を測定した。腫瘍への高い集積が見られた。
(b)マウス1匹あたりNa[211At](1.4MBq)を腫瘍内注射により投与した。投与1日後と2日後に解剖し、各臓器、血液、尿、腫瘍のγ線量を測定した。腫瘍への集積はほとんど見られなかった。
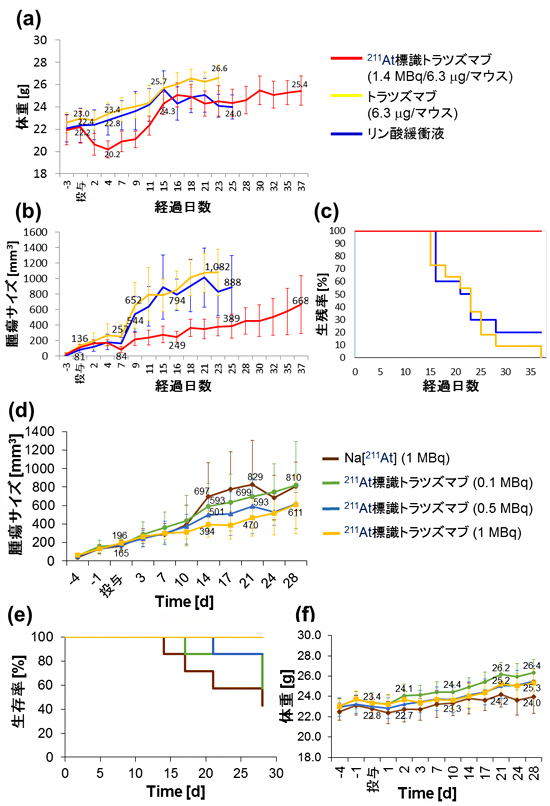
図5 ダブルクリック標識法により合成した211At標識トラスツズマブのα線治療効果解析II
(a-c)211At標識トラスツズマブ(マウス1匹あたり1.4MBq/6.3μg、赤線)、トラスツズマブ(マウス1匹あたり6.3μg、黄線)、リン酸緩衝液(青線)の腫瘍内注射による投与後の各マウス群の平均体重(a)、平均腫瘍体積(b)、生存率(c)。211At標識トラスツズマブを投与したマウスの体重は最初、少し低下したが、その後回復し、211At標識トラスツズマブを投与したマウスの腫瘍のサイズは、1カ月後でも小さかった。また、211At標識トラスツズマブを投与したマウスは100%生存した。
(d-f)マウス1匹あたり211At標識トラスツズマブ(1、0.5、0.1MBq/6.3µg)、Na[211At](1MBq)の腫瘍内注射による投与後の各マウス群の平均腫瘍体積(d)、生存率(e)、平均体重(f)。より高い放射能の211At標識トラスツズマブを投与したマウスの方が、腫瘍体積が小さくなった。また、。1MBqの211At標識トラスツズマブを投与したマウスは、100%生存し、1MBq以下の211At標識トラスツズマブの投与では、体重の減少はなかった。

