エクソソーム中の特定のマイクロRNAが病態に関与していることを解明
2018-01-12 国立研究開発法人 国立精神・神経医療研究センター(NCNP)
国立研究開発法人 国立精神・神経医療研究センター(NCNP、東京都小平市、理事長:水澤英洋)神経研究所(所長:武田伸一)免疫研究部の木村公俊 研究員(前・京都大学大学院 臨床神経学 博士課程学生)、山村隆 特任研究部長、神経薬理研究部の北條浩彦 室長らの研究グループは、多発性硬化症(MS, multiple sclerosis)において、血液中のエクソソームが、リンパ球の一種である制御性T細胞の分化を抑制することで病態に関与していることを発見しました。この仕組みにはエクソソーム中のマイクロRNA(miRNA)が関わっています。本研究は、miRNAを介したエクソソームによるMS病態を、世界に先駆けて解明したものです。MSでは、病勢を抑える役割のある制御性T細胞が血中で減少していることが知られていますが、その機序は明らかになっていませんでした。今回その機序の一端を解明したことで、制御性T細胞の異常を修復する、新しい治療法の開発が期待されます。
この研究成果は、2018年1月2日にNature Communicationsオンライン版に掲載されました。
本成果は、以下の事業・研究領域・研究課題によって得られました。
厚生労働省 厚生労働科学研究委託業務(難治性疾患等克服研究事業(難治性疾患等実用化研究事業(難治性疾患実用化研究事業)))「二次進行型多発性硬化症に対する革新的な医薬品の開発を促進させる研究」
国立研究開発法人日本医療研究開発機構 日本医療研究開発機構委託費難治性疾患実用化研究事業「二次進行型多発性硬化症の画期的な新規治療の開発に関する研究」
■研究の背景
多発性硬化症(MS)は、中枢神経(脳や脊髄)に炎症が起こり、運動・感覚・視力・認知機能など様々な機能に障害をきたす、自己免疫疾患です。発症年齢のピークは20~30歳頃であり、再発と寛解(症状の悪化と改善)を繰り返しながらも、生涯にわたって徐々に障害が蓄積していきます。再発を抑制する治療薬が数種類ありますが、いずれも効果・副作用の点で十分とは言えず、より有効で安全な治療法の開発が求められています。MSでは、リンパ球の一種である炎症性T細胞(Th1細胞やTh17細胞)が、病原性の(病気を起こす)細胞だと考えられています。一方で、制御性T細胞(Treg細胞)は炎症性T細胞を抑制し、病気を抑える働きを担っています。従って、これら炎症性T細胞と制御性T細胞のバランスが病態に関与していると考えられ、私達もこれまでに、このバランスの破綻が、治療中の病勢悪化と相関することを報告してきました(*1)。
現在までに、MS患者においては、末梢血中のTreg細胞の機能や数が低下していることが報告されてきましたが、その背景にある機序は明らかではありませんでした。そこで、私達は、MSにおける役割がわかっていないエクソソームに着目しました。エクソソームはリンパ球の約100分の1程度の大きさの微小胞で、血液中にあり体内を循環しています。エクソソームにはmiRNAが内包されており、様々な細胞から放出され、ターゲットとなる細胞に取り込まれることが知られています。miRNAは、細胞内で遺伝子の働きを調整する役割を担っており、リンパ球の機能や分化に深く関わっています。このため、私達は、エクソソームがmiRNAを介して、Treg細胞の変化を起こしているのではないかと考え、研究を始めました。
*1 Kimura, K., et al. Neurology Neuroimmunology & Neuroinflammation 3, e210 (2016)
■研究の内容
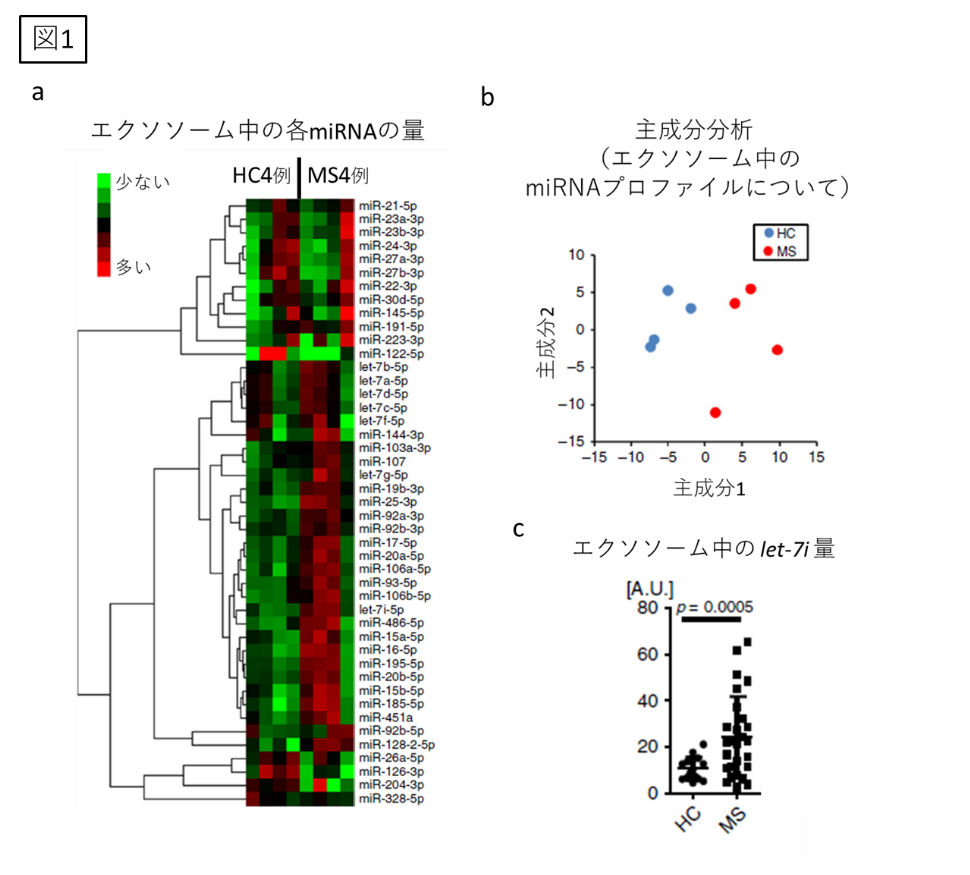 初めに、健常人(HC)とMS患者の血漿から、エクソソームを分離し、miRNAを抽出しました。マイクロアレイでmiRNAを解析すると、健常人とMS患者で、そのプロファイルが明確に異なっていることがわかりました(図1a, b: ヒートマップと主成分分析)。次に、多数のサンプルを解析し、MS患者のエクソソーム(MS-exo)中では、let-7iを含めた4種のmiRNAが増加していることがわかりました(図1c: let-7iの解析)。また、これらのmiRNAは、MSの病期(RRMSとSPMS: 再発寛解型MSと二次性進行型MS)やMSの病勢(再発期と寛解期)では変化がないことがわかりました。つまり、これらのmiRNAはMSにおいて、一貫して上昇していると考えられました。
初めに、健常人(HC)とMS患者の血漿から、エクソソームを分離し、miRNAを抽出しました。マイクロアレイでmiRNAを解析すると、健常人とMS患者で、そのプロファイルが明確に異なっていることがわかりました(図1a, b: ヒートマップと主成分分析)。次に、多数のサンプルを解析し、MS患者のエクソソーム(MS-exo)中では、let-7iを含めた4種のmiRNAが増加していることがわかりました(図1c: let-7iの解析)。また、これらのmiRNAは、MSの病期(RRMSとSPMS: 再発寛解型MSと二次性進行型MS)やMSの病勢(再発期と寛解期)では変化がないことがわかりました。つまり、これらのmiRNAはMSにおいて、一貫して上昇していると考えられました。
次に、エクソソームの機能を調べるため、ヒトのT細胞を用いた培養実験を行いました。すると、MS-exoは、HCのエクソソーム(HC-exo)に比較して、Treg細胞(IFNγ- IL- 17A- Foxp3+ CD4+ T細胞)の数を低下させることがわかりました。また、MS-exo中で増加していたmiRNAをT細胞に導入すると、let-7iの導入によって、Treg細胞の数の低下が観察されました。次に、let-7iのinhibitorで前処理をすると、MS-exoによるTreg細胞の数の低下がなくなることがわかりました。つまり、MS-exoによるTreg細胞の数の低下は、エクソソーム中のlet-7iの働きが中心になっていると考えられました。さらに、詳細に解析をすると、MS-exoやlet-7iは、ナイーブCD4+ T細胞からTreg細胞への分化を阻害していることがわかりました。
次に、let-7iの標的となる細胞内の遺伝子を解析しました。その結果、T細胞において、insulin-like growth factor 1 receptor (IGF1R)とTGF beta receptor 1 (TGFBR1)の発現が、let-7iによって抑制されることを見出しました。さらに、siRNAを用いてIGF1RとTGFBR1をノックダウンすると、ナイーブCD4+ T細胞からTreg細胞への分化が阻害されることがわかりました。
最後に、生体内で、これらの経路を通してエクソソームが機能しているかを探るため、末梢血の解析を行いました。すると、MSではHCに比べて、末梢血中のTreg細胞の数が少ないだけではなく、ナイーブCD4+ T細胞上のIGF1RとTGFBR1の発現が低下していることがわかりました。また、血漿中のエクソソームに含まれるlet-7iの量が多い人では、ナイーブCD4+ T細胞上のTGFBR1の発現がより低く、さらにTreg細胞の数もより少ないことがわかりました。つまり、MS患者において、エクソソームが、内在let-7iを介して、実際に病態に関与していることが示唆されました。
■研究の意義と今後期待される展開
 今回の研究で、私達は、内在miRNAを介したエクソソームの働きがMS病態に関与することを、世界に先駆けて見出しました。これまでに、MSにおいて、血清や血漿中に含まれるmiRNAプロファイルに変動があるという報告は数例ありましたが、それらはバイオマーカーとしての研究にとどまっていました。血中のmiRNAのなかでも、エクソソーム内に含まれるものは、それが取り込まれるターゲット細胞において遺伝子発現調整をするため、機能的に重要です。私達の研究で、MS患者のエクソソームや内在のlet-7iが、病態を悪化させていることが示唆されました(図2)。今後は、これらを標的にした、新領域の治療法の開発が期待されます。
今回の研究で、私達は、内在miRNAを介したエクソソームの働きがMS病態に関与することを、世界に先駆けて見出しました。これまでに、MSにおいて、血清や血漿中に含まれるmiRNAプロファイルに変動があるという報告は数例ありましたが、それらはバイオマーカーとしての研究にとどまっていました。血中のmiRNAのなかでも、エクソソーム内に含まれるものは、それが取り込まれるターゲット細胞において遺伝子発現調整をするため、機能的に重要です。私達の研究で、MS患者のエクソソームや内在のlet-7iが、病態を悪化させていることが示唆されました(図2)。今後は、これらを標的にした、新領域の治療法の開発が期待されます。
また、私達はこれまでに、MSと腸内細菌叢の関係性について報告を行ってきました(*2, 3)。近年、日本においてMS患者が急増していますが、食事様式の欧米化に伴う腸内細菌叢の変化が一因として考えられています。腸内細菌とヒトの免疫機構との間には、多様な相互作用がありますが、その一部にはmiRNA等の小分子RNAの伝搬を介した作用も示唆されています。私達の今回の研究を進めることで、今後そうした領域でも新知見が得られ、より詳細に病態が解明されることが期待されます。
*2 Yokote, H., et al. Am J Pathol. 173(6), 1714-23 (2008)
*3 Miyake, S., et al. PLoS One. 10(9), e0137429 (2015)
【用語の説明】
多発性硬化症
中枢神経(脳や脊髄)に炎症がおこり、運動・感覚・視力・認知機能など様々な機能が障害される、自己免疫疾患。若年で発症し、再発と寛解を繰り返しながらも、生涯にわたり徐々に障害が蓄積されるため、効果的な治療法が求められている。近年、日本において、患者数が急増している。(わが国の患者数は、約13,000人、人口10万人あたり約10人程度と推定されています。)
エクソソーム
径が約150nmまでの微小胞。内部にmiRNA等の核酸や、タンパク質、脂質を含み、細胞間で伝搬される。この伝搬は、細胞表面分子やサイトカイン等を介した様式とは異なる、新しい情報伝達様式と考えられており、癌や神経変性疾患といったMS以外の領域でも研究が進められている。
miRNA
約18~25塩基長の短いRNA。細胞内においては、DNAが転写された後、タンパク質へ翻訳される前の段階に関わり、最終的なタンパク質発現量を調整する。MS病態に重要とされるリンパ球の分化や機能にも関与することが知られている。
【原論文情報】
論文名:“Circulating exosomes suppress induction of regulatory T cells via let-7i in multiple sclerosis”
著 者:Kimitoshi Kimura, Hirohiko Hohjoh, Masashi Fukuoka, Wakiro Sato, Shinji Oki, Chiharu Tomi, Hiromi Yamaguchi, Takayuki Kondo, Ryosuke Takahashi, Takashi Yamamura
掲 載 誌:Nature Communications オンライン版/2018.1.2
DOI:10.1038/s41467-017-02406-2
URL:https://www.nature.com/articles/s41467-017-02406-2
■お問い合わせ先
【研究に関するお問い合わせ先】
国立研究開発法人 国立精神・神経医療研究センター
神経研究所 免疫研究部特任研究部長 山村 隆(やまむら たかし)
【報道に関するお問い合わせ先】
国立研究開発法人 国立精神・神経医療研究センター
総務課広報係