難治がんである悪性黒色腫の新規分子標的治療法の開発に期待
2019-02-04 東京医科歯科大学,日本医療研究開発機構
ポイント
- 難治がんの一つである悪性黒色腫(メラノーマ)の治療法の開発のためには新規がんマーカーの同定ならびに、がんの進展のメカニズムの解明が急務ですが、悪性黒色腫において特異的に発現し、その進展に寄与する細胞表面抗原については同定されていませんでした。
- 本研究により、悪性黒色腫の一部の患者の腫瘍組織において、正常組織においては精巣にしか発現していないインターロイキン13受容体α2(IL13Rα2)が発現しており、IL13Rα2ががん細胞の増殖に必要な新たな血管の形成を誘導することで、腫瘍形成を進展させることが明らかにされました。これによりIL13Rα2の作用を阻害することで悪性黒色腫の進展を抑制できる可能性が開けました。
- 悪性黒色腫進展のさらなる病態解明と、新たな分子標的治療開発への応用が期待できます。
概要
東京医科歯科大学大学院 医歯学総合研究科 硬組織病態生化学分野(元東京薬科大学 生命科学部 腫瘍医科学研究室)の渡部 徹郎教授と吉松 康裕講師らの研究グループは、東京大学大学院医学系研究科 人体病理学・病理診断学分野の深山 正久教授、先進循環器病学寄付講座の藤生 克仁特任准教授、分子予防医学分野の石川 俊平教授(元東京医科歯科大学・ゲノム病理学分野)との共同研究で、希少がん・難治がんである悪性黒色腫の患者の一部において高発現するインターロイキン13受容体α2(IL13Rα2)が、がん細胞の増殖に必要な新たな血管の形成を誘導することで、腫瘍形成を進展させることを明らかにしました。この研究は国立研究開発法人日本医療研究開発機構(AMED)次世代がん医療創生研究事業(P-CREATE)「口腔がんの悪性化機構の解明とそのメカニズムに基づく新規治療標的探索研究」(研究開発代表者:渡部 徹郎)、国立研究開発法人科学技術振興機構(JST)の戦略的創造研究推進事業(さきがけ)「生体における動的恒常性維持・変容機構の解明と制御」(研究代表者:渡部 徹郎)、文部科学省科学研究費補助金、上原記念生命科学財団等の支援のもとで行なわれたもので、その研究成果は、国際科学誌Scientific Reportsに、2019年2月4日午前10時(英国時間)にオンライン版で発表されます。
研究の背景
悪性黒色腫(メラノーマ)は、皮膚がんの一種であり、メラニン色素を産生するメラノサイトや母斑細胞(ほくろの細胞)ががん化したものだと考えられています。悪性黒色腫は悪性度が非常に高く、早期から浸潤・転移が認められる難治がんの一つです。治療においては、がん細胞の増殖性を標的とした抗がん剤を用いた化学療法などが主流ですが、副作用を伴う抗がん剤が多いことが問題となっています。悪性黒色種においても分子標的治療薬の開発は進められており、BRAF遺伝子を標的としたベムラフェニブ(vemurafenib)などが用いられていますが、副作用も報告されており、新たな標的分子の同定ならびに、がんの進展のメカニズムの解明が急務です。しかし、悪性黒色腫において特異的に発現し、その進展に寄与する細胞表面抗原についてはこれまで同定されていませんでした。
研究成果の概要
研究グループは、これまで悪性黒色腫の新規がん抗原を同定するために、A375悪性黒色腫細胞に対する特異抗体を探索し、その抗原の一つとしてインターロイキン13受容体α2(IL13Rα2)を同定しました。さらに、IL13Rα2の悪性黒色腫患者における発現パターンを検討するために、ティッシュマイクロアレイを用いて100例以上の病理標本を用いて免疫組織染色を行った結果、IL13Rα2が一部(約10%)の患者の腫瘍組織において発現していることを見出しました(図1)。正常組織においてIL13Rα2は精巣にしか発現しないことが確認されたため、IL13Rα2は悪性黒色腫においてがん細胞の細胞膜に発現する新規がんマーカーであることが明らかになりました。
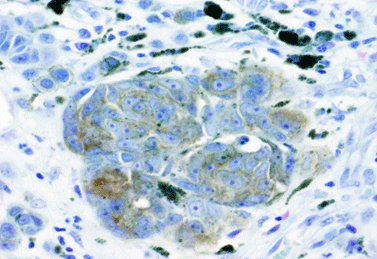
図1 悪性黒色腫におけるIL13Rα2の発現
悪性黒色腫組織を用いたIL13Rα2に対する免疫染色(茶色:赤矢印)。IL13Rα2の発現はがん細胞のみに限局し、間質(S)においては検出されなかった。赤矢頭:メラニン色素。スケールバー:20μm
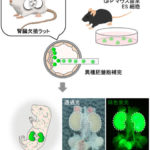
次に研究グループは、IL13Rα2が悪性黒色腫の進展に果たす役割を検討するために、IL13Rα2を発現していないSK-MEL-28悪性黒色腫細胞にIL13Rα2を発現させて(IL13Rα2発現細胞)、発現していないSK-MEL-28細胞をコントロール細胞として、がん細胞の増殖ならびに腫瘍形成能を比較しました(図2)。その結果、培養細胞レベルではIL13Rα2発現細胞の増殖はコントロール細胞と比較して低かったのですが(図2左)、免疫不全マウスの皮下に移植して形成される腫瘍の大きさを比較したところ、IL13Rα2発現細胞は腫瘍形成能が高くなるという結果が得られました(図2右)。また、この作用はIL13Rα2を発現するA375悪性黒色腫細胞においてIL13Rα2遺伝子を欠損させても同様に観察されました。

図2 悪性黒色腫の進展におけるIL13Rα2の役割
IL13Rα2を発現していないSK-MEL-28悪性黒色腫細胞(コントロール細胞)とIL13Rα2を発現させた細胞(IL13Rα2発現細胞)を培養し細胞数を計測したところ、IL13Rα2発現細胞の増殖能は低いことが示されたが、マウスに移植して腫瘍体積を測定したところ、IL13Rα2発現細胞の腫瘍形成能が高いことが明らかとなった。この作用の違いは腫瘍組織におけるがん細胞以外の間質(血管など)に依存することが考えられた。
がん微小環境においては、がん細胞以外に血管や線維芽細胞など、腫瘍形成を亢進する作用を持つ構成因子が存在します。特に血管はがん細胞の増殖に必要な酸素や栄養を供給することにより、腫瘍組織の増大に必須の役割を果たしていることから、研究者グループはIL13Rα2の腫瘍形成能に対する作用が血管新生を介している可能性を検討するために、悪性黒色腫細胞由来の腫瘍組織における血管新生を血管内皮細胞マーカーであるPECAM-1に対する抗体を用いて計測しました。その結果、IL13Rα2発現細胞由来の腫瘍組織における血管の量はコントロール細胞由来の腫瘍と比較して上昇していることが示されました。そこで、研究者グループはIL13Rα2の発現により悪性黒色腫細胞において血管新生を誘導する因子を網羅的に探索し、Amphiregulinという上皮細胞増殖因子(EGF)ファミリーの因子の発現がIL13Rα2により誘導することを見出しました。さらに、悪性黒色腫細胞においてAmphiregulin を発現させることで腫瘍形成能と血管新生能が上昇することを見出すことにより、IL13Rα2が悪性黒色腫細胞において血管新生因子であるAmphiregulinの発現上昇を介して、血管新生を亢進させ、 腫瘍形成が上昇することが示唆されました(図3)。
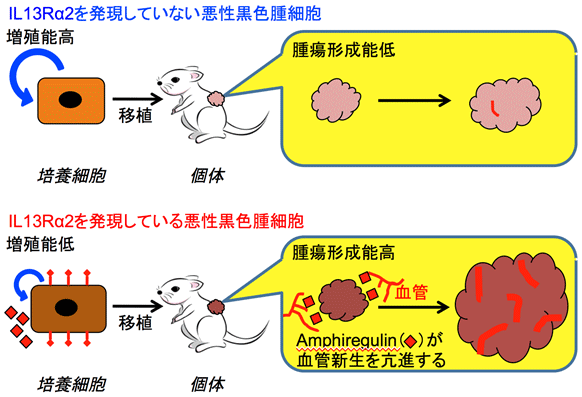
図3 本研究のまとめ
IL13Rα2を発現していない悪性黒色腫細胞(上)は増殖能は高いが、腫瘍形成能は低いのに対して、IL13Rα2を発現している細胞(下)の増殖能は低いが、Amphiregulinを発現しているため、血管新生を介して腫瘍形成能は高くなる。
研究成果の意義
本研究により、IL13Rα2が悪性黒色腫の新規バイオマーカーとして有用であることが初めて明らかとなりました。IL13Rα2は正常組織においては男性の生殖臓器(精巣)においてしか発現しておらず、他のがん種(悪性神経膠腫や膵がんなど)においても発現していることから、細胞のがん化とともに発現が上昇するがんマーカーであることが考えられます。そこで研究者グループが本研究に先立って樹立した特異抗体などを用いたIL13Rα2を標的とした新規分子標的治療の開発が期待されます。また、IL13Rα2を発現した悪性黒色腫においては、Amphiregulinなどの血管新生因子の発現上昇を介して腫瘍形成が進展することが明らかとなったため、IL13Rα2の作用を阻害することで悪性黒色腫の進展を抑制できる可能性が開けました。
論文情報
- 掲載誌:
- Scientific Reports
- 論文タイトル:
- Interleukin-13 receptor α2 is a novel marker and potential therapeutic target for human melanoma
問い合わせ先
研究に関すること
東京医科歯科大学大学院医歯学総合研究科
硬組織病態生化学分野 渡部 徹郎(ワタベ テツロウ)
報道に関すること
東京医科歯科大学 総務部総務秘書課広報係
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 がん研究課